基于PCR指纹技术鹿鞭鉴定方法的建立及检测试剂盒的研制
2021-01-08王雪松艾金霞孙丽媛王艳双周亭亭李明成张丽华北华大学临床免疫学检验教研室吉林吉林303吉林雷宁食品药品检测技术服务有限公司吉林吉林303
王雪松,艾金霞*,薛 晗,孙丽媛,王艳双,周亭亭,李明成,张丽华 (.北华大学临床免疫学检验教研室,吉林 吉林 303;.吉林雷宁食品药品检测技术服务有限公司,吉林 吉林 303)
鹿鞭为我国的传统名贵中药材,是鹿科动物梅花鹿(GervusnipponTemminck)和马鹿(CervuselaphusLinnaeus)雄性的外生殖器。鹿鞭又名鹿肾,味甘、咸,性温,自古以来就是临床常用的补肾壮阳、固本培元药物,对于治疗劳损、耳聋、不孕、肾虚、阳痿早泄有显著疗效[1]。由于鹿鞭药效独特、价格偏高,且鹿鞭品种繁多、成分复杂、货源紧俏,各种伪品屡见不鲜,其中牛鞭由于数量较多、价格低廉,常被用于冒充正品鹿鞭出售[2]。因此,急需一种能够快速、准确鉴别鹿鞭的方法,从而确保鹿鞭的临床疗效,为鹿鞭的鉴定和分析提供科学依据。
基于DNA指纹特征对中药材进行的鉴定,弥补了传统鉴定方法的不足,实现了分子水平快速鉴定的目的[3]。《中国药典》(2015年版)中已收录了部分中药材分子的生物学鉴定方法,但由于该方法对实验条件要求高,因此很难在普通药检部门广泛使用。目前多采用性状、纤维和理化[4]等方法,以上传统方法存在主观性强、专属性差等缺点。近年来,DNA条形码[5]、毛细管电泳[6]被应用于动物药材的鉴定,但也都存在不同程度的局限性。国内外尚无同类报道通过鹿鞭DNA检测试剂盒的方法进行鹿鞭及其伪品的快速筛查。本研究通过探讨鹿鞭DNA指纹特征,建立鹿鞭鉴定方法,开发鹿鞭DNA检测试剂盒,从而实现多样品、大规模、短时间、高精准的检测要求,为进一步规范中药材领域的质量标准提供可靠依据。
1 材料与方法
1.1 药材、试剂和主要仪器
正品鹿鞭药材由吉林市龙潭山鹿业有限责任公司提供并鉴定。鹿鞭与牛鞭样品10批次,随机抽取来自吉林、蛟河、四平、长春、延吉等城市,分别为:JLMHLB-1(吉林市梅花鹿鞭1号);JLMHLB-2(吉林市梅花鹿鞭2号);SPMHLB-1(四平市梅花鹿鞭1号);JLMLB-1(吉林市马鹿鞭1号);JHMLB-1(蛟河市马鹿鞭1号);JLNB-1(吉林市黄牛鞭1号);JLNB-2(吉林市黄牛鞭2号);CHNB-1(长春市黄牛鞭1号);YJNB-1(延吉市黄牛鞭1号);YJNB-2(延吉市黄牛鞭2号)。
蛋白酶K、裂解液(含10 mmol/L pH=7.6的Tris-HCl、10 mmol/L Na2EDTA、50 mmol/L NaCl);2×TaqPCR MasterMix(1000 u)(天根生化科技北京有限公司);100 bp DNA Ladder(天根生化科技北京有限公司);引物由上海生工生物工程技术服务公司合成;其他化学试剂均为分析纯。
Gene AmpRPCR System 2700 PCR仪(美国Perkin-Elmer公司);DYY-7C型水平电泳仪、DYY-8B型稳压稳流水平电泳仪(北京六一仪器厂);UV WHITE-2020D紫外凝胶成像分析仪(美国Biorad公司);JD100-3B型电子天平(沈阳龙腾电子有限公司);OSE-Y5型第三代变速组织研磨器(北京天根生化科技有限公司);紫外可见分光光度计(北京普析通用仪器有限责任公司);H2050R台式高速冷冻离心机(美国Becman公司)。
1.2 试剂盒组成
试剂盒由6部分组成,包括DNA提取、PCR扩增,可供20次用量(表1)。
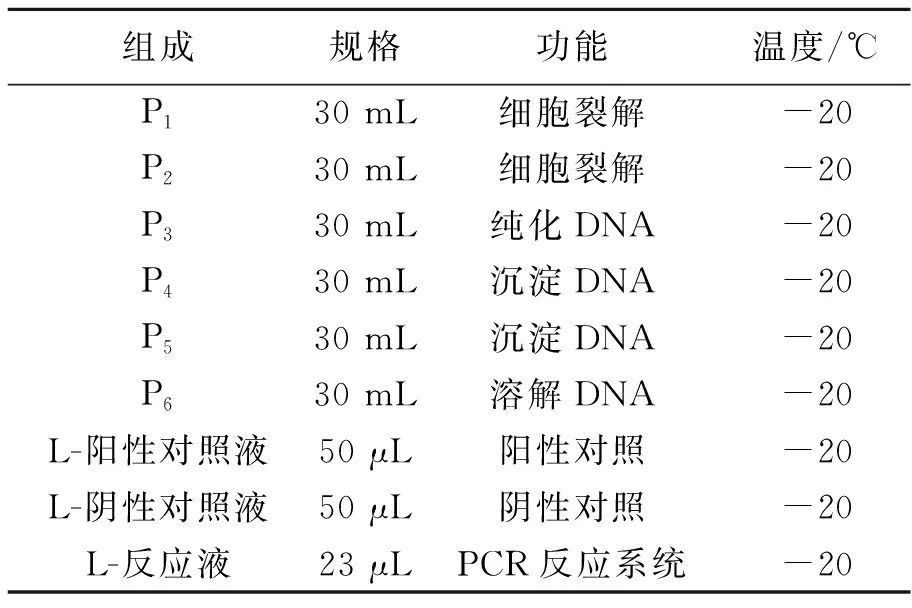
表 1 鹿鞭DNA检测试剂盒组成
1.3 试剂盒法样品总DNA的提取
将鹿鞭与牛鞭样品洗净、剪碎,鲜品于低温下在研钵中研磨或用粉碎机打磨,分别称取各样品50 mg;干品可研磨成粉末状,称取50 mg,备用。将样品置于Eppendorf管中,加入预热的P1溶液500 μL,同时加入P2、P3溶液(30 μL和15 μL)混匀,56 ℃水浴振荡1 h,取出加入P4500 μL,颠倒混匀10 min,4 ℃ 12 000 r/min离心10 min;取上清液加入等体积的P5500 μL,-20 ℃静置1 h,取出4 ℃ 10 000 r/min离心10 min,弃上清;室温干燥,得沉淀DNA。向沉淀中加入P680μL溶解DNA,-20 ℃保存[7]。
1.4 样品DNA纯度、浓度检测
将模板DNA提取液适当稀释后,用紫外分光光度计测定260 nm和280 nm处的吸光度A260和A280,计算OD260/280的比值即纯度值,并应用相应的稀释倍数计算得出模板DNA的浓度。根据浓度测定结果,将DNA储存液稀释至100 mg/L,-20 ℃保存,为后续PCR扩增备用。
1.5 样品基因组DNA琼脂糖凝胶电泳检测
将DNA稀释液与6×Loading buffer(3∶1)溶液混匀点样于0.8%琼脂糖凝胶板上,电压80 V,时间50 min,将凝胶置于成像分析系统上进行观察、照相。
1.6 引物设计
根据GenBank中梅花鹿鞭(AB 021091.1)、牛鞭(NC 001567)的线粒体细胞色素b基因序列,经过DNA Star 7.0软件比对后,利用Primer Premier 5.0软件设计出鹿鞭特异性引物,然后通过美国国家生物信息中心中的在线软件Primer-BLAST对设计的引物进行评估。最后筛选出一对引物,可特异性扩增出307 bp的目的基因片段。其上游引物为5′-AGACATGAAACATCGGAGTA-3′,下游引物为5′-ATGGGATTCCTGTTGGGT-3′。引物由上海生工生物工程技术服务公司合成。
1.7 PCR扩增
将DNA稀释液,阳性、阴性对照品各1 μL分别加入到PCR反应管中。PCR循环参数为94 ℃预变性5 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,经30个循环之后72 ℃延伸10 min,4 ℃保存。
1.8 样品PCR产物琼脂糖凝胶电泳检测
取6 μL PCR产物点样于2%琼脂糖凝胶上,调节电压至80 V,电泳50 min。停止电泳,将凝胶置于成像分析系统上进行观察、照相。
1.9 鹿鞭检测试剂盒参数的评价
鹿鞭试剂盒特异性、稳定性、重现性评价。随机挑选一盒试剂盒,对鹿鞭正品及随机抽取来自5个城市10批次市售样品进行特异性检测。将试剂盒由-20 ℃取出,室温下溶解,再置于-20 ℃冷冻,如此反复5次、10次和20次后,进行稳定性验证。并随机抽取3个鹿鞭样品和3个牛鞭样品,在本实验室,由同一实验员在相同条件下采用试剂盒进行3次重复检测,对试剂盒进行参数评价。
2 结 果
2.1 样品DNA纯度及浓度检测分析
用试剂盒提取样品DNA的纯度均在1.80±0.10之间,表明DNA样品基本无蛋白质污染。
2.2 样品DNA琼脂糖凝胶电泳结果
采用试剂盒提取鹿鞭和牛鞭样品中的基因组DNA大约在21 kb左右(图1)。

注:M-Marker;1.阳性对照1;2.阳性对照2;3.JLMHLB-1;4.JLMHLB-2;5.SPMHLB-1;6.JLMLB-1;7.JHMLB-1;8.JLNB-1;9.JLNB-2;10.CHNB-1;11.YJNB-1;12.YJNB-2图 1 鹿鞭、牛鞭样品DNA提取琼脂糖凝胶电泳图谱
2.3 PCR产物琼脂糖凝胶电泳结果
经PCR扩增反应后,鹿鞭扩增产物DNA分子片段为307 bp,而牛鞭无扩增条带(图2)。

注:M-Marker;1.JLMHLB-1;2.JLMHLB-2;3.SPMHLB-1;4.JLMLB-1;5.JHMLB-1;6.阳性对照1;7.阳性对照2;8.JLNB-1;9.JLNB-2;10.CHNB-1;11.YJNB-1;12.YJNB-2;13.阴性对照图 2 鹿鞭、牛鞭PCR产物琼脂糖凝胶电泳图谱
2.4 鹿鞭试剂盒检测参数结果
2.4.1特异性
由吉林市龙潭山鹿业有限责任公司提供并鉴定的正品鹿鞭药材,随机抽取来自吉林、长春、四平、蛟河、延吉等城市的鹿鞭与牛鞭样品10批次,采用试剂盒进行检验结果显示,所有鹿鞭正品扩增后在307 bp处出现一条片段。而牛鞭样品经扩增后无条带,试剂盒特异性强(图3)。

注:M-Marker;1.阳性对照1;2.阳性对照2;3.JLMHLB-1;4.JLMHLB-2;5.SPMHLB-1;6.JLMLB-1;7.JHMLB-1;8.JLNB-1;9.JLNB-2;10.CHNB-1;11.YJNB-1;12.YJNB-2;13.阴性对照图 3 鹿鞭、牛鞭PCR产物琼脂糖凝胶电泳图谱
2.4.2稳定性
试剂盒经反复冻融5次、10次和20次后,仍能提取鹿鞭DNA并经扩增后在307 bp处出现一条片段,试剂盒稳定性良好(图4、5、6)。

注:M-Marker;1.阳性对照1;2.JLMHLB-1;3.SPMHLB-1;4.JLMLB-1;5.JLNB-1;6.CHNB-1;7.YJNB-1;8.阴性对照图 4 试剂盒反复冻融5次检测样品PCR产物电泳图谱

注:M-Marker;1.阳性对照1;2.JLMHLB-1;3.SPMHLB-1;4.JLMLB-1;5.JLNB-1;6.CHNB-1;7.YJNB-1;8.阴性对照图 5 试剂盒反复冻融10次检测样品PCR产物电泳图谱

注:M-Marker;1.阳性对照1;2.JLMHLB-1;3.SPMHLB-1;4.JLMLB-1;5.JLNB-1;6.CHNB-1;7.YJNB-1;8.阴性对照图 6 试剂盒反复冻融20次检测样品PCR产物电泳图谱
2.4.3重现性
将试剂盒存放12个月后,对市售鹿鞭和牛鞭样品进行3次重复检测,鹿鞭均出现一条片段且与阳性对照品位置一致,牛鞭样品扩增后仍然无条带,表明试剂盒具有良好的重现性。
3 讨 论
DNA鉴定方法是目前研究的热点[8],由于DNA指纹技术具有专属性强、技术简便等优点,已被广泛用于物种的鉴定和遗传学研究[9]。《中国药典》(2015年版)已收录DNA指纹鉴定法作为检测中药的国家标准。采用线粒体DNA指纹特征构建鹿鞭DNA指纹图谱,该方法较为前沿[10],本团队成员建立了蕲蛇、乌梢蛇、川贝母等中药材特异性DNA指纹片段的克隆及鉴定方法[11],本研究在此基础上开发了鹿鞭DNA检测试剂盒,并进行结果分析。
本研究开发的鹿鞭DNA检测试剂盒分别对新鲜鹿鞭和干品鹿鞭提取线粒体DNA。结果发现,新鲜鹿鞭提取条带完整清晰,泳道背景没有抹迹现象,干品鹿鞭虽经过炮制、风干、存放,其纯度仍在1.80±0.10之间,说明试剂盒提取DNA峰度高、完整、没有降解和污染,为后续PCR扩增提供了良好的基础。
本研究利用自主研发试剂盒,建立了鹿鞭鉴定方法。结果显示:鹿鞭样品在307 bp处出现一条清晰的特异性条带,与阳性对照结果完全一致,而牛鞭样品则无条带,正品与伪品有明显差别,可作为鹿鞭药品鉴定的有效方法。并对试剂盒的特异性、稳定性、重现性进行验证。试剂盒经过反复冻融5次、10次、20次后,其提取和扩增结果完全能够特异性鉴别鹿鞭及其伪品。试剂盒经存放12个月后,对市售鹿鞭和牛鞭样品进行重复检测,结果依然准确可靠。
实验应用自主研发试剂盒,克服了现行质量鉴定方法的局限性。传统鉴别方法有薄层色谱法,其重现性较好,但对于牛鞭这种同源性较高的易混品会产生鉴别困难的情况[12]。红外光谱法其优点是不破坏样品、所提供信息量大,而在图谱分析方面要求有较为丰富经验的实验人员来操作[13]。高效液相色谱法检测灵敏度高,但分析成本以及仪器的日常维护费用较高[14]。而早期分子水平鉴定常常需要联合DNA测序技术,不仅成本高、繁杂费时,同时对实验条件要求也十分严格。本实验利用中药DNA指纹特征所建立的试剂盒检测方法,实现了标准化试剂、标准化操作,可避免不同因素对实验结果造成的影响,提高检测结果的可比性,每批次可检测20个样品,高效、特异、准确、省时、方便。可满足鹿鞭及其伪品的分析鉴定需求,可作为鉴别鞭类制品标准化研究的有效手段,可以广泛地应用到药品检验的各基层单位,具有重要推广价值。
