肝癌干细胞源性外泌体对肝癌细胞增殖耐药性的影响
2021-01-08白金权李柏文李景东范晓东严智勇邹向明杨海松杜希臣梅博升吉林医药学院附属医院普通外科吉林吉林132013
白金权,李柏文,鲁 晶,李景东,范晓东,严智勇,朱 波,邹向明,杨海松,杜希臣,韩 茜,梅博升 (吉林医药学院附属医院普通外科,吉林 吉林 132013)
肝癌早期无明显症状,确诊时大多数病人已失去手术治疗时机,病死率居高不下[1]。传统放化疗治疗肝癌尚未能取得良好的远期疗效,且存在较大的副作用。因此,如何提高肝癌的临床疗效仍是重大而紧迫的课题。外泌体是一种高效的细胞间信息交换通讯载体。研究表明[2],外泌体除在局部作用促进肿瘤形成和增殖外,还可以通过影响细胞迁移和侵袭能力影响远处细胞,在肿瘤早期诊断、监测发展、提高治疗效果等方面显示出良好的临床应用前景。肝癌干细胞的多药耐药性是导致肿瘤化疗失败的关键[3]。本研究采集肝癌干细胞外泌体并将其作用于普通肝癌细胞,观察其对肝癌细胞增殖和耐药性的影响。
1 资料与方法
1.1 材料与试剂
人肝癌细胞MHCC97购自上海通蔚生物科技有限公司;DMEM F12培养基、胎牛血清、胰蛋白酶均购自美国Gibco公司;荧光染料Hoechst33342购自西格玛奥德里奇(上海)贸易有限公司;四甲基偶氮唑盐(MTT)购自南京森贝伽生物科技有限公司;TIAN script RT Kit购自天根生化科技(北京)有限公司;Hot Start Fluorescent PCR Core Reagent Kits(SYBR GreenⅠ)购自生工生物工程(上海)股份有限公司;Western Blot检测试剂盒购自美国博士德生物工程有限公司;FACSCalibur流式细胞仪购自BD公司;NanodropRND-1000购自NanoDrop公司;GelDoc-It TS Imaging System型购自上海金鹏分析仪器有限公司;WFH100B凝胶成像系统购自上海精科实业有限公司;MC-15K微型高速离心机购自上海精胜科学仪器有限公司;FV1000激光共聚焦显微镜购自日本Olympus公司;JEM-1010透射电子显微镜购自日本JEOL公司。
1.2 细胞培养
MHCC97细胞复苏后接种于DMEM/F12培养基中(含100 u/mL青霉素、100 u/mL链霉素和10%胎牛血清),置于37 ℃、5%CO2、75%湿度条件下的恒温培养箱中培养。当细胞生长至80%融合度时倒掉培养基,胰蛋白酶-EDTA消化液(浓度0.25%)消化培养细胞成散在单个细胞,然后进行传代。
1.3 肝癌干细胞分选
0.25%胰蛋白酶消化培养的MHCC97细胞并制成单细胞悬液(细胞密度约为1×106~3×106/mL)。将其分为两组,一组加入Hoechst33342至终浓度为6 mg/L,一组单细胞悬液中加入钙通道阻滞剂维拉帕米进行对比,调节至终浓度为50 mmol/L。采用FACSCalibur全自动多色分析流式细胞仪对细胞进行检测分选,选择355 nm UV激光发射源进行检测,测量前向散射和侧向散射二维参数图。根据流式细胞仪显示的细胞二维散点图形态及参数,选择左下角荧光强度弱或者无表达的一小部分细胞,即为MHCC97细胞中的肝癌干细胞。
1.4 外泌体提取和实验分组
将肝癌干细胞和MHCC97细胞均常规培养48 h后,收集各组细胞培养基上清液。4 ℃的条件下离心:300×g离心10 min,2000×g离心20 min。然后将上清液移入无菌高速离心管中,分别在800×g离心30 min、1万×g离心30 min、1万×g离心60 min,收集颗粒,在PBS中重新悬浮,9万×g离心60 min以去除细胞碎片。然后在30%蔗糖/D2O密度梯度以106×g下超离心180 min,收集蔗糖中沉淀,用PBS重悬,106×g下超离心60 min,收集沉淀即为外泌体。最后,将沉淀重悬于PBS中,并在-80 ℃保存备用。采用Bradford assay(BioRad)测定蛋白浓度。取10 μL溶解外泌体的PBS悬液滴至电镜铜网上放置20 min。戊二醛固定液(4%,电镜专用)固定待观察样本30 min,PBS溶液洗涤3次,室温下自然晾干。然后置于在JEM-1010透射电子显微镜下进行观察并拍照。将提取的肝癌干细胞源性外泌体作用于MHCC97细胞(实验组),并设置对照组(常规培养的肝癌细分泌外泌体作用于MHCC97细胞)和普通组(常规培养MHCC97细胞)进行对比。
1.5 四甲基偶氮唑盐(MTT)实验
①细胞增殖检测:将各实验组肝癌细胞以每孔平均5×104个细胞接种到96孔板,每孔体积200 μL。培养72 h后,每孔加入20 μL MTT(5 g/L),置于37 ℃、5%CO2饱和湿度条件下孵育4 h。移液器吸去孔板内培养上清液,每孔中各加入150 μL DMSO溶液,振荡器上振荡10 min以充分溶解结晶产物。在BioTek ELx800全自动酶标仪上,设置以490 nm波长检测96孔板各孔的吸光度(OD),以时间(d)为横坐标,OD值为纵坐标来绘制细胞生长曲线图,评估实验肿瘤细胞的生长增殖情况。
②药物敏感性实验:按5×104/孔将各实验组肝癌细胞接种到96孔板中,常规培养72 h。配制不同浓度梯度的含5-氟尿嘧啶(5-Fu)和阿霉素(ADM)的培养基进行干预培养,每种药物不同浓度分别设置5个复孔;同时设置无药物干预的细胞对照组和无细胞的空白对照组。干预培养细胞24 h后,加入20 μL MTT(5 g/L)孵育4 h,移液器吸去孔板内培养上清液,加入150 μL DMSO,振荡器上振荡10 min以充分溶解结晶产物。在BioTek ELx800全自动酶标仪上,以490 nm波长检测各孔的OD值,计算半数抑制剂量(IC50)。
1.6 实时荧光定量PCR
采用Trizol法提取各实验组分离纯化的外泌体中总RNA。cDNA的合成按照TIAN script RT Kit的说明进行操作。Total RNA 40 μg,10×DNaseⅠbuffer 5 μL,RNase Inhibitor 20 U,DNaseⅠ(RNase-free)2 μL(10 U),加入RNase free dH2O至总体积50 μL,混匀,离心。反应条件:42 ℃ 50 min,95 ℃ 5 min。PCR反应:RT product 1 μL,10 μmol/L的PCR特异引物F 1 μL,10 μmol/L的PCR特异引物R 1 μL,2×Master Mix 10 μL,Nucleasr-Free Water 7 μL,加入RNase free dH2O至总体积20 μL。反应条件:94 ℃ 2 min,94 ℃ 30 S、55 ℃ 30 S、72 ℃ 4 min、30个循环,72 ℃ 5 min。以GAPDH为内参基因,2-ΔΔCT法分析检测基因相对表达值。
1.7 Western Blot检测
收集实验组细胞分离纯化的外泌体,按照每毫升样品外泌体中加入0.1 mL的RIPA裂解液,放置于冰上裂解30 min,然后振荡器上振荡30 s。4 ℃条件下,12 000 g离心30 min。取上清,Bicinchoninic acid法对上清中蛋白浓度进行定量检测。将样品加入SDS-PAGE蛋白上样缓冲液,沸水浴加热5 min。冷却至室温后用移液器加入到10%SDS-PAGE胶的上样孔内,40 V电压下电泳3 h,然后转印至硝酸纤维素膜上。转膜完毕后,封闭液室温下封闭1 h。加入一抗,室温下孵育2 h后,TBST洗涤液洗涤3次,每次10 min。加入辣根过氧化物酶标记的二抗,室温下孵育2 h,TBST洗涤液洗涤3次,每次10 min。ECL法显色,GIS凝胶图像分析系统照相,Image Studio图像分析软件分析图片。
1.8 统计学分析
采用SPSS 19.0中文版统计软件对采集的实验数据进行统计学处理。采用均数±标准差对数据进行描述,采用t检验对组间数据差异进行分析,以P<0.05为差异具有统计学意义。
2 结 果
2.1 肝癌干细胞分选
流式分选荧光散点图显示:A组左下角区域细胞占所有分选肝癌细胞的4.1%;在加入维拉帕米的B组中,该区域的细胞则明显减少,相应的细胞所占百分比也明显降至0.4%;该区域细胞即为肝癌干细胞(图1)。
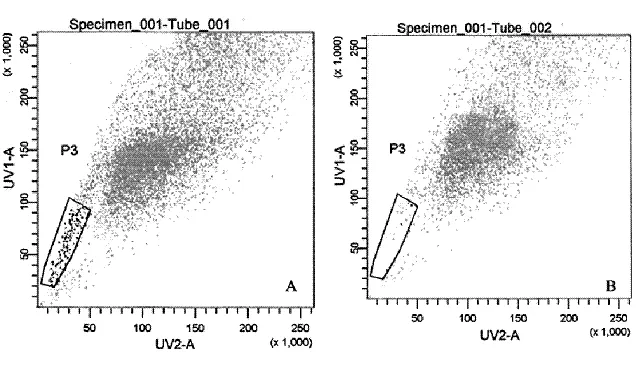
图 1 肝癌干细胞流式分选图
2.2 分离提取的外泌体鉴定
透射电镜下观察(图2):从肝癌干细胞培养上清液样本提取的物质中可见散在分布的小囊泡,呈杯口状或囊泡状,50~120 nm直径大小。Western blot检测结果显示,这些提取的物质表达肝癌干细胞来源外泌体表面标志性蛋白CD63。

图 2 肝癌干细胞来源外泌体电镜下形态
2.3 外泌体对肝癌细胞增殖能力的影响
细胞MTT生长曲线结果显示:外泌体对肝癌细胞的增殖有促进作用,因而实验肝癌细胞各时间点OD值要明显高于对照组和普通组,比较差异具有统计学意义(P<0.05);而对照组和普通组各时间点OD值比较差异无统计学意义(P>0.05)(图3)。
2.4 外泌体对肝癌细胞化疗敏感性的影响
实验组肝癌细胞对5-Fu和ADM的IC50明显高于对照组和普通组,比较差异具有统计学意义(P<0.05);对照组和普通组对5-Fu和ADM的IC50比较无统计学差异(P>0.05)(表1)。
2.5 外泌体中增殖和耐药基因mRNA的表达
RT-PCR结果显示(图4):实验组肝癌干细胞外泌体中survivin、c-myc、ras癌基因和ABCG2、MDR-1、MRP-1耐药基因的表达均明显高于对照组的普通肝癌细胞,而抑癌基因P53和PTEN表达则明显低于对照组(P<0.05)。
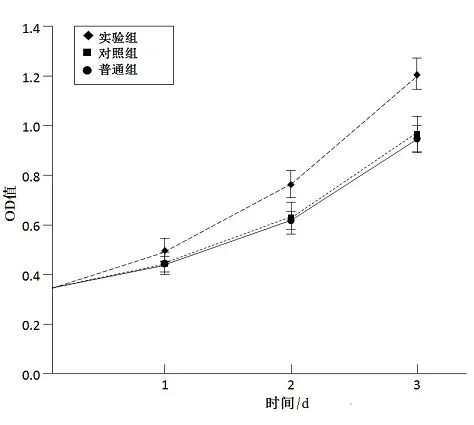
图 3 各组肝癌细胞增殖曲线比较

表 1 各组肝癌细胞对5-Fu和ADM的IC50(mg/L)
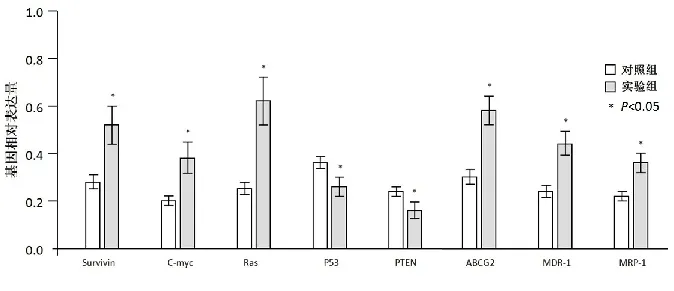
图 4 各组外泌体中基因表达比较
2.6 外泌体中增殖和耐药基因蛋白的表达
Western blot灰度值检测后显示(表2):实验组肝癌干细胞外泌体中survivin、c-myc、ras、ABCG2、MDR-1、MRP-1基因蛋白的表达均高于对照组的普通肝癌细胞,而P53和PTEN基因蛋白表达水平值则低于对照组(P<0.05)。
3 讨 论
肿瘤干细胞(cancer stem cells,CSCs)理论认为恶性肿瘤是由一个独特的自我更新的癌细胞亚群按等级组织和维持的。肿瘤起始细胞位于金字塔的顶端,它们可以自我更新,通过细胞分裂形成相同的子细胞,并分化成各种类型的后代。CSCs具有对放疗和化疗的内源性耐药机制,具有生存优势。此外,CSCs可导致肿瘤组织中细胞组成的多样性,产生表型不同的亚克隆,从而增加抗癌治疗后的耐药概率。越来越多的证据表明CSCs是导致肿瘤治疗失败的关键所在[4]。近年来外泌体的发现为肿瘤细胞间耐药性传递影响的机制提供了新的思路。外泌体是细胞间进行物质和信息交流的重要媒介[5]。目前针对外泌体在免疫调节、肿瘤侵袭和转移、肿瘤耐药性等研究领域已经开展了大量的研究[6]。对肺癌的相关研究发现,高转移性肺癌细胞外泌体较低转移肺癌细胞更能促进肿瘤细胞迁移。在体外诱导因素下,肺癌细胞能增加外泌体中TGF-β和IL-10的含量来提高对靶肿瘤细胞的迁移能力,进而促进其侵袭转移。本研究采用FACS从人肝癌细胞MHCC97中分选出的SP细胞。结果显示分选出的肝癌干细胞约占所有细胞的4.1%,这一结果与相关报道数据是一致的。
表 2 各组外泌体中基因蛋白表达水平
肿瘤干细胞能够影响普通肿瘤细胞增殖、迁徙/转移和耐药性。研究表明肿瘤干细胞外泌体可能是导致这一现象的关键所在[7]。Bourkoula等[8]研究发现,神经胶质瘤干细胞外泌体能够增强胶质瘤细胞的生物学侵袭性。Setti等[9]也证实,神经胶质瘤干细胞源性的外泌体能够诱导肿瘤细胞体外增殖和体内转移。而这可能与神经胶质瘤干细胞源性的外泌体中含有的氯离子通道1蛋白并传递给靶细胞有关。本研究将肝癌干细胞来源的外泌体同肝癌细胞进行培养。结果显示,肝癌干细胞来源的外泌体均能够促进肝癌细胞的增殖,增强肝癌细胞对5-Fu和ADM的耐药性。由于外泌体参与细胞间信号转导和物质传递,因此进一步检测增殖和耐药基因mRNA和蛋白的表达。结果显示,肝癌干细胞外泌体中survivin、c-myc、ras癌基因和ABCG2、MDR-1、MRP-1耐药基因的表达均明显高于普通肝癌细胞,而抑癌基因P53和PTEN表达则明显低于普通肝癌细胞。推测是肝癌干细胞来源的外泌体包含了促进增殖和化疗耐药相关功能活性介质,在同普通肝癌细胞共同培养过程中通过传递并直接介导肿瘤细胞或者塑造肿瘤微环境来支持肿瘤的增殖和耐药。
总之,本实验证实了肝癌干细胞分泌外泌体作用肝癌细胞后能促进其增殖和化疗耐药,这种效应可能与外泌体能通过胞间传递促增殖基因和耐药蛋白有关。然而肝癌干细胞源性外泌体对细胞增殖和耐药影响的相关机制尚不明确,还有待进一步深入研究。
