不同干燥方式枸杞子的识别
2021-01-08刘旭霞杨志刚刘建飞巩媛王茂鹤邸多隆
刘旭霞 杨志刚刘建飞巩 媛王茂鹤邸多隆*
(1.甘肃中医药大学药学院,甘肃 兰州 730000;2.中国科学院兰州化学物理研究所,中国科学院西北特色植物资源化学重点实验室,甘肃省天然药物重点实验室,甘肃 兰州 730000;3.兰州大学药学院,甘肃兰州 730000)
枸杞子为茄科植物宁夏枸杞Lycium barbarum L.的干燥成熟果实[1],是一种药食两用中药材,具有抗氧化、抗阿尔茨海默病、降血糖、抗肿瘤、神经保护等多种活性[2-5],由于鲜品含水量、含糖量较高,容易在储藏过程中发霉变质,而干燥可除去其水分,抑制微生物生长,从而延长储藏时间[6]。文献报道的干燥方式有自然干燥、热风对流干燥、冷冻干燥、真空干燥、超声波干燥、膨化干燥、渗透干燥等[7],但不同手段会造成枸杞子化学成分有所差异,导致其质量有差别,曲云卿等[8]印证了这一点。
脱蜡处理是一种损坏蜡质层、加快水分排出的方法[9-10],虽然非脱蜡枸杞子外果皮表面依然有蜡质层保护,但如果脱蜡过度会导致其内部糖分受热融化,随着水分迁移至样品表面,从而影响药材品质[11]。本实验建立了15 批枸杞子的HPLC 指纹图谱,考察了自然晾干、设备干燥(均经1% Na2CO3脱蜡处理)、非脱蜡干燥对药材品质的影响,以期为其质量控制提供科学依据。
1 材料
1.1 仪器 Agilent 1200 型高效液相色谱仪(美国Agilent Technologies 公司),配置G1312A 恒流泵、G1315B 检测器、G1328B 手动进样器、Agilent Chemstation software 工作站;AT-950 型柱温箱(天津奥特赛恩斯仪器有限公司);KQ-250DE 型数控超声波清洗器(昆山市超声仪器有限公司);BSA224S-CW 型电子分析天平(万分之一,北京赛多利斯仪器系统有限公司);XQ100 g 型多功能高速粉碎机(上海广沙工贸有限公司);DHG-9140A 型电热恒温鼓风干燥箱(上海精宏实验设备有限公司);飞鸽牌高速离心机(上海安亭科学仪器厂);SHB-Ⅳ型双循环水式多用真空泵(郑州长城科工贸有限公司)。
1.2 试剂与药物 15 批枸杞子均为宁夏中宁产区种植的宁杞7 号品种,经甘肃中医药大学晋玲教授鉴定为宁夏枸杞Lycium barbarum L.的干燥成熟果实,具体见表1。乙腈为色谱纯(美国Mreda Technology Inc.);冰乙酸为色谱纯(天津市大茂化学试剂厂);水为纯净水(杭州娃哈哈集团有限公司)。

表1 样品信息
2 方法与结果
2.1 供试品溶液制备 药材粉碎后过2 号筛。精密称取3.0 g 粉末于250 mL 锥形瓶中,加15 倍量水,60 ℃下超声提取30 min,提取液离心(10 000 r/min) 20 min,转移至50 mL 量瓶中加水定容,摇匀,过0.22 μm 微孔滤膜,取续滤液,即得。
2.2 色谱条件 依利特 Sepherisorb ODS2 色谱柱(250 mm×4.6 mm,5 μm);流动相0.2%冰乙酸(A) -乙腈(B),梯度洗脱(0~60 min,95%~75%A);体积流量1.0 mL/min;柱温25 ℃;检测波 长310 nm;进 样 量20 μL。
2.3 方法学考察
2.3.1 精密度试验 取供试品溶液(ND1-1),在“2.2”项色谱条件下进样测定5 次,以峰面积稳定、峰形良好、保留时间适宜的20 号色谱峰为参照峰,计算其余色谱峰相对保留时间RSD 为0.12%~2.08%,相对峰面积RSD 为0.37%~3.68%,表明仪器精密度良好。
2.3.2 稳定性试验 取同一供试品溶液(ND1-1),于0、2、4、6、8、24 h 在“2.2” 项色谱条件下进样测定,测得共有峰相对保留时间RSD 为0.37%~2.35%,相对峰面积RSD 为0.33%~4.66%,表明溶液在24 h 内稳定性良好。
2.3.3 重复性试验 取同一供试品(ND1-1) 5 份,按“2.1” 项下方法制备供试品溶液,在“2.2” 项色谱条件下进样测定,测得共有峰相对保留时间RSD 为0.02%~1.51%,相对峰面积RSD 为0.96%~4.89%,表明该方法重复性良好。
2.4 HPLC 指纹图谱建立 称取15 批药材粉末,按“2.1” 项下方法制备供试品溶液,在“2.2” 项色谱条件下进样测定,将上述数据导入“中药色谱指纹图谱相似度评价系统(2012 版) ”,以ND1-1、ED1-1、W1-1 为参照谱图,生成不同干燥方式下共有模式,再将其导入相同软件中,以自然晾干样品共有模式为参照谱图,采用平均数相关系数法进行多点校正,时间窗宽度为0.3 s,进行自动匹配,建立共有模式[12],共确定35 个共有峰,见图1~2。由图1 可知,不同干燥方式下样品虽然色谱峰数量均一致,但其峰面积及峰高存在显著差异,即其质量有所不同。

图1 不同干燥方式下样品标准指纹图谱

图2 样品对照指纹图谱
然后,将上述数据导入“中药色谱指纹图谱相似度评价系统(2012 版) ” 进行相似度评价,结果见表2,可知不同批次样品之间的相似度均大于0.900,说明同一干燥方式下样品整体一致无差异。再以自然晾干样品对照指纹图谱为参照,计算不同干燥方式下的相似度,结果见表3,可知相似度为0.759~0.997,表明不同干燥方式下样品成分组成相同,但含有量有差异,其中设备干燥、自然晾干样品相似度均大于0.900,而非脱蜡干燥样品仅为0.759,表明该方式可能会对其质量产生影响。

表2 相同干燥方式下相似度测定结果

表3 不同干燥方式下相似度测定结果
2.5 化学计量学分析
2.5.1 聚类分析 以峰面积稳定、峰形良好、保留时间适宜的20 号色谱峰为参照峰,计算其余35 个色谱峰的相对保留时间和相对峰面积,将上述数据导入SIMCA 14.1 软件进行聚类分析,采用Ward 法计算样品之间的分类距离[13],结果见图3。由此可知,3 种干燥方式下样品各自聚为一类,并且自然干燥、设备干燥样品又聚为一类,非脱蜡干燥样品单独聚为一类,与相似度分析结果一致。

图3 样品聚类分析图
2.5.2 主成分分析[14]将共有峰相对峰面积数据导入SIMCA 14.1 软件进行主成分分析,发现前2 个主成分累积贡献率达91.4%,能代表大部分特征峰信息,再以前2 个主成分建立坐标系得到其得分图,结果见图4。由此可知,样品按照不同干燥方式呈现明显的离散,同一干燥方式下可很好地聚到一起,其中设备干燥、自然干燥样品离的较近,表明其成分含有量相似;非脱蜡干燥样品离的较远,表明其成分含有量与其他两者差异较大,与相似度分析、聚类分析结果一致。
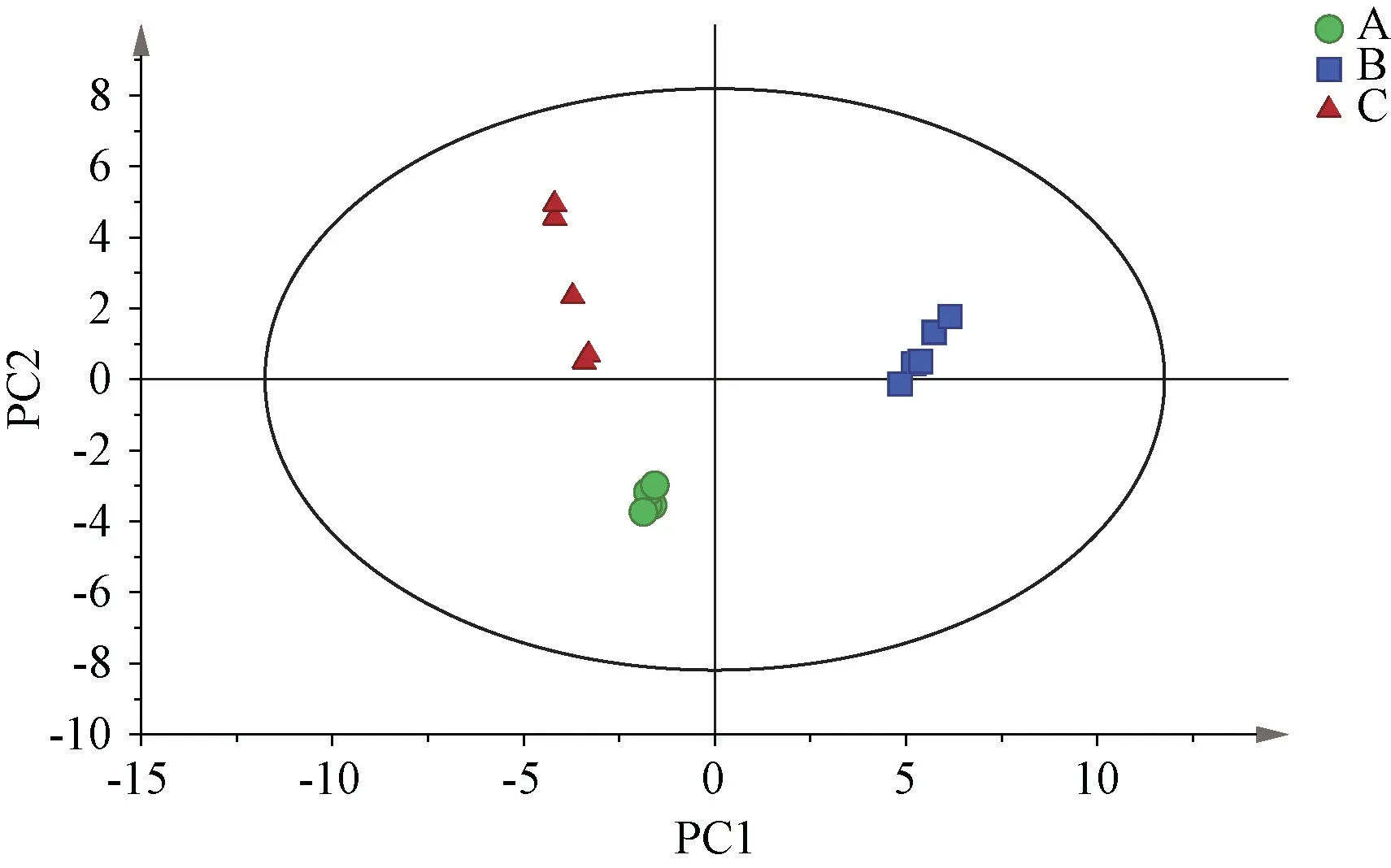
图4 样品主成分分析得分图
2.5.3 正交偏最小二乘判别分析[15-17]本实验以各批样品共有峰相对峰面积数据建立了正交偏最小二乘判别分析模型,其R2Y 为0.992,Q2为0.981,表明模型有较好的预测效果,再以预测成分得分值(Tp [1]) 和第1 个正交成分的得分值(To [2]) 绘制得分散点图,结果见图5。由此可知,不同干燥方式样品在得分散点图上得到明显区分,可视化效果明显。
2.5.4 置换检验 随机打乱Y 变量的顺序200 次,观察其随机排列模型与原始变量模型之间的差异,再对两者R2值、Q2值绘制回归线,结果见图6。由图可知,R2、Q2回归线与纵轴的截距分别为0.337、-0.664,右边原始模型的相关数值均大于左边随机排列模型的,表明模型无过拟合现象,有效可靠[14]。

图5 样品正交偏最小二乘判别分析得分图

图6 模型置换检验图
3 讨论
本实验通过HPLC 指纹图谱技术结合化学计量学方法,对不同干燥方式枸杞子进行识别。相似度分析结果显示,设备干燥、自然晾干样品相似度均大于0.900,而非脱蜡干燥仅为0.759,表明不同干燥方式会对药材化学成分有较大影响,其原因可能是未脱蜡样品表面有蜡质层保护,光敏性、热敏性成分未受到影响,而自然晾干样品上述2 类成分有一部分被破坏,设备干燥样品热敏性成分亦然[18-19];聚类分析、主成分分析结果与相似度分析一致。利用主成分分析可以区分不同干燥方式的样品,但是可视化效果不好,通过OPLS-DA 建立样品识别模型,模型稳定可靠,识别率为98.1%,可以很好的鉴别不同干燥方式的样品。本研究建立了一种不同干燥方式枸杞子的辨别模型,同时也为其他中药材的鉴别研究提供了新的思路。
