滩羊骨骼肌卫星细胞体外培养及成肌和成脂诱导分化研究
2021-01-07徐小春陈文娟马文平
徐小春,赵 瑞,陈文娟,马文平,马 森
(1.北方民族大学 生物科学与工程学院,宁夏 银川 750021;2.河南农业大学 牧医工程学院,河南 郑州 450002)
骨骼肌卫星细胞(Skelatal muscle satellite cells,SMSCs)是位于骨骼肌纤维基底板下的一小群肌原性干细胞[1],因直接参与骨骼肌分化而受到广泛关注[2-4]。在肌发生过程中,刺激成肌细胞启动表达肌源性分化特异性基因,如中间丝蛋白(desmin)[5]、配对盒基因7(Pax7)[5-6]、肌肉细胞生成素(MyoG)[7]、肌球蛋白重链(MHC)[8]。SMSCs活化后表达肌特异性转录因子Pax7和MyoD[9],分化后表达肌原蛋白desmin,参与运动,并可用于识别其他组织中的骨骼肌细胞[10]。因此,MyoG和MHC是骨骼肌发育的调控因子,可促进SMSCs向成熟肌细胞分化,并作为SMSCs分化的标志物。SMSCs是参与生长后肌肉再生的最重要的细胞类型,通过对SMSCs成肌分化的调控可以有效改善畜禽的肉品质。骨骼肌卫星细胞是一种多功能干细胞,既可以向成肌细胞分化,也可以向脂肪细胞分化[11-12]。研究证明,过氧化物酶体增殖物激活受体γ(PPARγ)、CCAAT/增强子结合蛋白α(C/EBPα)是调节脂肪形成的主要转录因子,并且不同程度地调控脂肪的发育。脂肪酸合成酶(FAS)在调控脂肪酸合成及脂肪细胞分化过程中起着重要作用,因此常被作为检测脂肪细胞分化的标志基因[13-14]。目前滩羊优良肉质性状的体内研究形成机制尚不清楚,因此获取便捷的体外研究材料对深入揭示其优良肉质性状形成分子机制具有重要意义,而SMSCs正是一种理想的研究材料。本研究通过对滩羊SMSCs进行分离培养和鉴定,同时建立SMSCs成肌和成脂诱导分化体系的,以期为在体外条件下研究调控滩羊肌肉生长发育及脂肪沉积的分子机制提供模型。
1 材料与方法
1.1 试验动物与主要试剂
选取10日龄健康滩羊公羔1只(宁夏盐池县春浩林草产业专业合作社提供),颈部处死后无菌条件下采取背最长肌组织,放于加双抗的(100 IU/mL青霉素和100 μg/mL链霉素)无菌磷酸缓冲液(phosphate buffer saline,PBS)中备用。0.1%I型胶原酶(Gibco,美国)、胎牛血清(fetal bovine serum,FBS)(Gibco,美国)、马血清(Hyclone,美国)、DMEM/F12培养基(Sigma,美国)、0.25%胰蛋白酶(Gibco,美国)、青链霉素(Gibco,美国)、OriCell SD大鼠脂肪间质干细胞成脂诱导分化培养基试剂盒(Cyagen Biosciences,中国)、油红O染料(Sigma,美国)、二甲基亚砜(dimethyl sulfoxide,DMSO;Sigma, 美国)、RNA提取试剂盒(Takara,日本)、反转录试剂盒(Takara,日本)、实时荧光定量qPCR Mix(Takara,日本)、0.1%明胶(Sigma,美国)、0.1%多聚赖氨酸(Sigma,美国)、0.1%TritonX-100(Sigma,美国)、4%多聚甲醛(Solarbio,中国)、封闭用山羊血清(中杉金桥,中国)、MHC一抗(Bioss,中国)、Desmin二抗(FITC标记羊抗兔二抗)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide, MTT(Sigma,美国)等。
1.2 骨骼肌卫星细胞分离培养
采取腿部肌肉组织,用含有双抗的PBS溶液冲洗5次,放入无菌培养皿中。剔除肉眼可见的血管和结缔组织,用手术剪刀剪成约0.5~1.0 mm的组织块。先加入0.1%I型胶原酶于37 ℃水浴锅中消化组织50 min,然后加入0.25%胰蛋白酶(Gibco)消化组织10~20 min(振荡1次/10 min),在消化完全后加入等体积的完全培养基(DMEM/F12+20% FBS+10%马血清+100 IU/mL青链霉素)终止消化。将消化液过孔径为200目的细胞筛,滤液1 000 r/min离心10 min,弃上清,得到细胞即为SMSCs。将细胞以1×106个/mL接种在包被的培养皿中(0.1%明胶+0.1%聚赖氨酸),在37 ℃,5% CO2培养箱中培养3 h后,将上清加入到新的培养皿中继续培养3 h,后再次吸取上清到新的培养皿中,此时获得细胞为含杂细胞较少的SMSCs。
1.3 骨骼肌卫星细胞传代培养
原代细胞培养汇合至80%~90%时,吸去培养液,用PBS冲洗3次,加入0.25%胰蛋白酶进行消化约3 min,显微镜下待细胞回缩并且少量细胞飘起时,加入等体积的完全培养液终止消化。收集细胞悬液,1 000 r/min离心10 min,弃上清,完全培养基重悬细胞,按1:2或1:3的比例进行传代培养,之后置于37 ℃、5% CO2培养箱中,每隔2 d换液1次,直到细胞生长汇合至90%,并铺满整个培养皿。
1.4 细胞生长曲线的测定
原代细胞培养汇合至80%~90%时,经胰蛋白酶消化后收集细胞,接种至96孔培养板内,每孔密度为1.0×105个/mL,随机分为7组,每组3孔。采用MTT法测定细胞活力:每孔加入MTT 20 μL,37 ℃、5% CO2培养箱中培养4 h,弃MTT溶液,加入DMSO 150 μL,震荡10 min,在490 nm波长处读取OD值,每隔48 h进行测定。设置空白调零,计算每孔吸光度值的平均值,绘制曲线,即为骨骼肌卫星细胞的生长曲线。
1.5 骨骼肌卫星细胞诱导分化
第二代细胞培养至80%汇合度时分别进行成肌和成脂诱导分化。将SMSCs接种于6孔细胞培养皿中,待SMSCs生长融合至80%时,PBS清洗细胞2次,6孔细胞培养皿中加入成肌分化培养基(98% DMEM/F12+2%马血清)诱导SMSCs成肌分化,37 ℃、5% CO2培养箱中连续诱导SMSCs成肌分化8 d,每隔2 d更换新鲜培养液。
将SMSCs接种于6孔细胞培养皿中,待SMSCs生长融合至80%时,PBS清洗细胞2次,加入OriCell SD大鼠脂肪间质干细胞成脂诱导分化培养基A液72 h,后换以OriCell B液培养继续培养24 h,重复上述处理两次共8 d。
1.6 骨骼肌卫星细胞的免疫荧光鉴定
利用细胞免疫荧光技术对成肌诱导分化4 d后的SMSCs标记蛋白MHC进行鉴定。将SMSCs接种至6孔板内,按上述流程诱导分化4 d后,吸除培养基,4%多聚甲醛室温固定15 min,PBS清洗3次;0.25%TritonX-100通透15 min,PBS清洗3次;10%山羊血清封闭液封闭1 h,PBS清洗3次;MHC一抗(1:100稀释)4 ℃孵育过夜;PBS清洗3次, FITC(1:100稀释)标记的山羊抗兔二抗室温孵育1 h;PBS清洗3次;DAPI室温孵育15 min;共聚焦显微镜拍照。
1.7 油红O染色法及鉴定
SMSCs成脂诱导成熟后,弃完全培养基,PBS洗2次。用4%多聚甲醛固定30 min,PBS洗2次,油红O染色60 min,弃染色液,PBS洗2次,倒置显微镜下观察。用60%异丙醇进行萃取,测定萃取液在510 nm波长处的OD值。
1.8 引物设计及合成
参照GenBank中Pax7、Desmin、MyoG、PPARγ、C/EBPα、FAS基因序列,用Primer Premier 5.0及NCBI软件设计实时荧光定量PCR特异性引物,引物序列见表1。引物送至生工生物工程(上海)股份有限公司合成。

表1 qRT-PCR引物相关信息Table 1 Related information about the primers used for qRT-PCR
1.9 实时荧光定量PCR
分别在SMSCs成肌、成脂诱导第0、2、4、6、8 d提取总RNA,利用PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)逆转录试剂盒将RNA反转录为cDNA,以β-actin为内参基因,实时荧光定量RT-PCR法检测脂肪细胞分化关键基因mRNA的相对表达水平。PCR反应体系20 μL:其中Mix 12.5 μL,上、下游引物各1 μL,模板cDNA 2 μL,ddH2O补足体系。PCR反应程序:95 ℃预变性3 min;95 ℃变性15 s,退火30 s,72 ℃延伸30 s,39个循环,65~95 ℃熔解曲线5 s。
1.10 数据处理
数据均以“平均值±标准差”表示,采用GraphPad Prism 5进行统计分析,采用独立样本t检验进行组间差异分析,显著性水平为P<0.05。
2 结果与分析
2.1 SMSCs的形态学观察
新分离的SMSCs培养2 h后,大部分非特异性细胞已经附着。大多数非附着的SMSCs随培养基转移到新的明胶处理的培养板中以促进粘附生长。新分离的SMSCs呈球形,具有较强的折射率。9 h后,细胞开始附着在细胞培养皿上,贴壁细胞呈椭圆形、梭形或多角形(图1A);2 d后细胞全部附着,细胞逐渐向梭形或多边形延伸(图1B);培养至4 d时,细胞形态与第二天相似,细胞数目增多(图1C);培养至8 d时,细胞呈现长梭形且平行排列紧密(图1D)。

图1 SMSCs的原代培养(100×)A~D. SMSCs原代培养9 h、2 d、4 d和8 dFig.1 Primary culture of SMSCs (100×)A~D. Primary culture of SMSCs for 9 h, 2 d, 4 d, and 8 d, respectively
培养汇合至90%时传代培养,与原代细胞相比,传代SMSCs的增殖能力明显增强。在培养皿中,接种第二代细胞第2天,细胞生长旺盛,细胞形态正常(图2A)。传代第4、6天细胞呈现梭形及不规则三角形,可见部分融合细胞,折射率增加;在培养过程中,发生了更多的融合(图2B、图2C);培养至8 d时,细胞长梭形且平行排列紧密,呈长管状,体积明显大于单个SMSCs(图2D)。
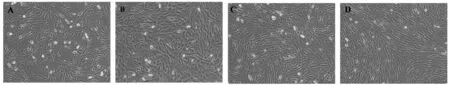
图2 SMSCs的传代培养(100×)A~D. 传代培养2 d、4 d、6 d和8 dFig. 2 Subculture of SMSCs (100×)A~D. Subculture of SMSCs for 2 d, 4 d, 6 d, and 8 d, respectively
2.2 SMSCs的成肌诱导分化及免疫荧光鉴定
体外培养SMSCs至汇合度到60%~70%加入成肌诱导液,第2天开始有方向不一致的SMSCs相互融合,形成短小的肌管细胞(图3A)。随着时间的延长,细胞密度增大,细胞之间的融合更为广泛,肌管细胞的形成明显增加(图3B)。诱导至第6天,肌管细胞之间也开始出现相互的连接和融合,连接成片状、网状(图3C)。诱导至第8天,细胞呈长管状,体积明显大于单个骨骼肌卫星细胞,各肌管细胞之间出现拉网和连接现象,最终彼此融合(图3D)。在SMSCs成肌诱导分化第8天,利用细胞免疫荧光技术检测MHC的表达情况,结果显示在分化第8天可以明显观察到呈染色阳性的细胞核(图3E)和肌管(图3F)。

图3 SMSCs的成肌诱导及鉴定(100×)A~D. 诱导分化2、4、6、8 d;E,F. MHC免疫荧光鉴定(诱导分化第8天)Fig. 3 Induced differentiation of SMSCs towards myogenic cells and identification (100×) A~D. Induced differentiation of SMSCs towards myogenic cells at 2, 4, 6, and 8 d, respectively;E,F. MHC immunofluorescence identification (8th day post-induction)
2.3 SMSCs成脂诱导分化及油红O染色
SMSCs在成脂分化培养基的作用下,随着时间的增加,长梭形细胞缩短成不规则三角形及片状(图4A和图4B),在诱导第6天时能观测到有少量脂滴形成(图4C),在第8天时细胞内沉积大量脂滴(图4D)。油红O染色后,细胞内脂滴被油红O着色而成红色,说明SMSCs已经被成功诱导分化为成熟脂肪细胞(图4E(100×)和图4F(200×)。
2.4 生长曲线
SMSCs接种后的潜伏期为0~4 d,此时完成细胞的贴壁和伸展。4~6 d进入对数生长期,细胞增殖迅速,第6天后开始进入到平台期,细胞增殖缓慢。观察细胞形态发现,已有部分SMSCs开始相互融合形成散在的肌管细胞(图5)。
2.5 SMSCs成肌、成脂诱导前后相关基因表达差异比较
SMSCs成肌诱导分化前后Pax7、MyoG和Desmin的表达量有显著性变化(图6A)。SMSCs成肌诱导第8天Pax7表达量显著降低(P<0.05),为诱导第0天的0.08倍;SMSCs成肌诱导第8天MyoG和Desmin表达量显著增加(P<0.05),分别是诱导第0天的11.03倍和5.48倍。SMSCs成脂诱导分化第8天与诱导第0天相比,PPARγ表达量增加,但差异不显著(P>0.05);C/EBPα和FAS的表达量均显著增加(P<0.05)(图6B);SMSCs成脂诱导第8天C/EBPα和FAS表达量分别是诱导第0天的5.51倍和2.01倍。

图4 MDSCs的成脂诱导及鉴定A~D. 诱导分化2、4、6、8天;E,F. 油红O染色(诱导分化第8天)Fig. 4 Induced differentiation of MDSCs towards adipogenic cells and identificationA~D. Induced differentiation of MDSCs towards adipogenic cells at 2, 4, 6, and 8 d, respectively;E,F. Oil red O staining (8th day post-induction)
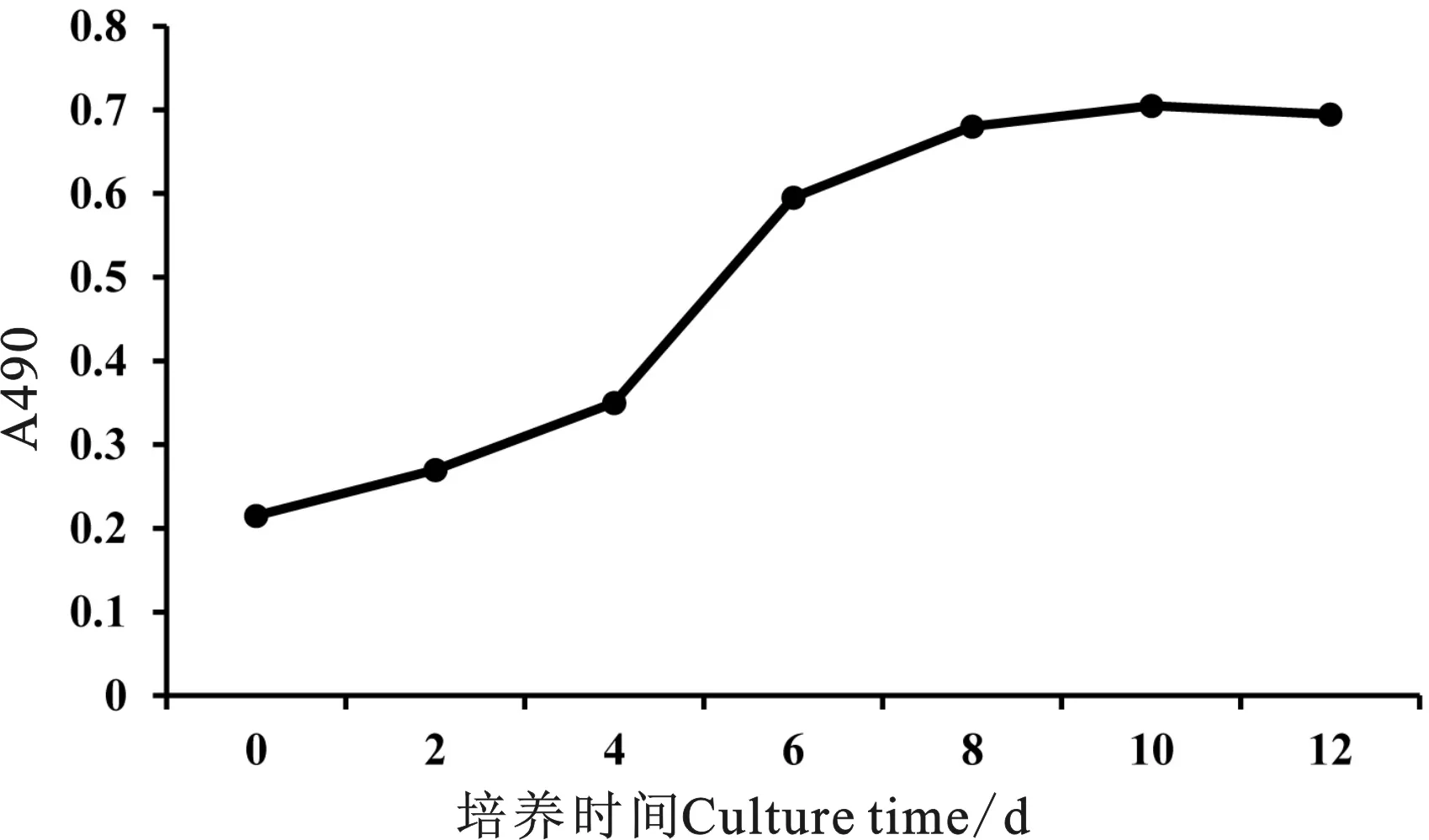
图5 SMSCs生长曲线Fig. 5 The growth curve of SMSCs
3 讨 论
3.1 SMSCs分离培养
SMSCs是位于肌膜和基底膜之间的一类肌源性干细胞,直接参与骨骼肌分化,是脊椎动物出生后调节肌肉再生长的最主要方式。一般情况下,SMSCs处于休眠状态,当肌肉受到损伤或者受到外界信号的刺激诱导后,肌肉组织的再生主要由肌卫星细胞完成的。SMSCs在幼龄动物肌肉组织中占的比例较高,但是其总体数量和肌肉组织细胞占比会随着动物年龄增加而不断减少[15]。目前,羊、牛、猪、鸡等畜禽的SMSCs的分离培养已经被报道。SMSCs的分离方法主要有组织块培养法和酶消化法两种,其中酶消化分离法主要有胶原酶法和胰蛋白酶法等[16-19]。本研究利用0.1%I型胶原酶和0.25%酶两步消化法成功地分离了滩羊SMSCs,并对其进行了细胞学鉴定。郑琪等[20]使用10%马血清的培养基对安淮山羊骨骼肌卫星细胞进行分离培养;解一凡等[21]采用15%马血清血清培养基对哈萨克羊骨骼肌卫星细胞进行了分离培养。本研究采用10%马血清的培养基对滩羊骨骼肌卫星细胞进行了分离培养,并进一步利用差速贴壁法对细胞进行纯化。两步消化法使得细胞充分释放,差速贴壁法可以去掉成纤维细胞,获得的骨骼肌卫星细胞经过传代后纯度较高,增殖和分化能力较强。新分离的、未激活的SMSCs处于休眠状态,很难附着在未处理的培养皿底部[21],本研究采用0.1%明胶和0.1%聚赖氨酸对细胞培养皿进行包被,明胶和聚赖氨酸有助于绵羊SMSCs的附着。
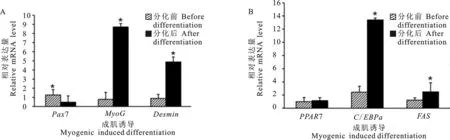
图6 SMSCs成肌、成脂诱导前后相关基因的表达“*”表示2组数据差异显著(P<0.05)Fig. 6 Expression of genes involved in myogenic and adipogenic potentials of SMSCs before and after induced differentiation“*” indicates significant difference between two data sets (P<0.05)
3.2 SMSCs的诱导分化及鉴定
SMSCs在未激活和已激活状态表达不同的基因或蛋白质,其中一些已经被用作标记物利用免疫荧光、蛋白印记等技术对SMSCs进行分子鉴定或者细胞状态的识别。目前,研究证实SMSCs表达骨骼肌标志性蛋白如MHC、Desmin、Pax7、MyoD、MyoG等[16,22-24],已经证实SMSCs能够合成骨骼肌特异性的蛋白。例如,MHC作为表皮生长因子超家族的一员,已被证明在骨骼肌发育中发挥重要作用,常作为成肌标记基因。正常的成肌细胞中会表达MHC,利用细胞免疫荧光技术对MHC的表达进行检测,可以说明该细胞是否为成肌细胞。本研究结果表明诱导分化的细胞中MHC的表达呈阳性,证实分离得到的SMSCs可诱导分化成为成肌细胞。SMSCs除了具有成肌潜力以外,还具有向成脂细胞和成骨的潜力。本研究采用成脂诱导剂诱导滩羊SMSCs分化为类脂肪细胞,油红O染色鉴定发现,诱导分化培养8d后细胞内有明显脂肪滴形成,表明分离的滩羊SMSCs亦具有成脂细胞的潜力,可以作为细胞模型探究相应的调控机制。
3.3 SMSCs成肌、成脂诱导前后相关基因表达差异比较
SMSCs从静息状态到激活状态,再从激活状态到成肌分化形成成熟的肌纤维受到有序复杂基因网络的调控,精准控制SMSCs发挥其生物学功能。静止和激活SMSCs最广泛使用的标记物是Pax7,这是一种属于参与肌肉发育的螺旋-转-螺旋-配对盒家族的转录因子[25]。Myogenin(MyoG)是最后的MRFs之一,参与了发育和再生过程中肌肉分化的晚期阶段,特别是在成肌细胞肌管和成熟纤维的形成中[26]。随着MyoG的表达,细胞进入生肌分化阶段,最后MHC基因表达,标志着生肌分化进入最后时期[27]。结蛋白(desmin)是中间丝蛋白的一种,是静止的卫星细胞和增殖的成肌细胞标志之一,在损伤后再生的肌纤维以及鸡、大鼠和小鼠等的胚胎成肌纤维中表达[28]。肌细胞的生成和分化过程由Pax7和MRFs家族成员相互作用共同参与,Pax7在静止的肌卫星细胞中表达, 激活后则同时表达Pax7和MyoD。肌卫星细胞激活后,Pax7正调控下游基因Myf5、MyoD、myogenin和MRF4,它们介导骨骼肌标志基因的表达并诱导肌卫星细胞分化[29]。本研究发现,SMSCs成肌诱导分化前后Pax7表达量显著降低,而MyoG和Desmin的表达量表达量显著增加。原代山羊肌卫星细胞成肌分化过程中Pax7基因显著下调,MyoG基因与Desmin基因显著上调[30], 这与本试验结果一致。静息状态下的肌卫星细胞表达Pax7,进入活化阶段后,Pax7表达下调,最终分化进入晚期阶段,MHC开始表达,说明肌细胞逐渐停止增殖,并开始分化、融合。研究证明SMSCs能在体外分化为成脂细胞[31-32]。PPARγ和C/EBPα是参与脂肪细胞成熟的关键转录调控因子,C/EBPα被激活后能上调其他成脂分化相关基因的表达,从而促进细胞的成脂分化[30,33]。本研究发现,SMSCs成脂诱导分化后C/EBPα和FAS的表达量显著增加,说明C/EBPα激活后上调FAS的表达量,促进SMSCs的成脂分化。这说明通过改变诱导培养条件,骨骼肌卫星细胞能够分化成为脂肪细胞,并且成脂相关的基因PPARγ、C/EBPα和FAS的表达量均呈现了上升趋势,此结果与细胞染色结果完全相符。这可能是由于部分细胞已分化为类脂肪细胞,成脂标志性基因开始特异性表达,也可能受到脂肪酸沉积的影响,同时也可能受到PPARγ和C/EBPα的调控。
4 结 论
本研究通过I型胶原酶和胰蛋白酶消化分离骨骼肌卫星细胞,并利用差速贴壁法对细胞进行纯化,所分离的细胞经过传代后纯度较高,增殖和分化能力较强。成肌和成脂诱导分化分别通过免疫荧光和油红O染色鉴定所分离的细胞为骨骼肌卫星细胞,并且具有成肌和成脂分化能力。MDSCs成肌诱导分化前后Pax7、MyoG和Desmin的表达量有显著性变化,MDSCs成肌诱导第8天Pax7表达量显著降低,MyoG和Desmin表达量显著增加;MDSCs成脂诱导分化第8天与诱导第0天相比;C/EBPα和FAS的表达量显著增加。滩羊骨骼肌卫星细胞的成功分离培养为滩羊骨骼肌的发育及再生机制,提供了可靠的细胞模型。
