枯草芽孢杆菌N2- 10 体外益生特性评价
2021-01-07张亚茹张伟涛李术娜郭伟婷王树香李红亚
张亚茹 张伟涛 王 硕 李术娜 郭伟婷 王树香 李红亚*
(1.河北农业大学生命科学学院,河北保定071000;2.河北省畜牧总站,河北石家庄050035;3.石家庄市畜牧技术推广站,河北石家庄050006)
近年来,因抗生素在畜牧养殖业中的广泛应用而引起的病原菌耐药性、药物残留及环境污染等问题日益凸显。欧盟、日本和韩国等国家和地区已全面禁止抗生素类添加剂在动物饲料中的应用。2019年7月,我国农业农村部亦发文公告自2020年起全面禁止抗生素类饲料添加剂。寻找安全且绿色的抗生素替代品成为当前研究的热点。益生菌作为抗生素最有潜力的代替品之一,日益受到人们的广泛关注。
益生菌是一类含有活菌或其代谢产物的生物制剂,因其具有安全可靠、无残留、无抗药性、不污染环境等优点而备受关注。大量研究表明益生菌的益生作用广泛,除了能发挥抑菌作用外,还能调节肠道菌群组成、机体免疫机能、血糖和血脂代谢等功能。因此益生菌在食品保健、医药及畜牧养殖等领域中得到较好的应用。芽孢杆菌除了能够增强动物免疫力、改善动物体内微生态环境、助消化等益生功能外,还具有产芽孢、快速繁殖、高耐受性等特点,被认为是最有应用前景的抗生素替代品之一。本课题组前期从西门塔尔牛新鲜粪便中筛选到了一株枯草芽孢杆菌N2-10,并证实该菌株能通过产生以脂肽类物质为主的抑菌物质来抑制大肠杆菌、沙门氏菌及金黄色葡萄球菌等病原菌。为进一步全面评价枯草芽孢杆菌N2-10 的益生作用,本文就该菌株对胃肠道环境的耐受性、肠道黏附性、细胞表面疏水性、抗生素敏感性、体外抗氧化能力及产酶情况进行体外评价,旨在为枯草芽孢杆菌N2-10 作为益生菌在畜牧养殖和饲料中的应用奠定理论基础,以期为替代抗生素提供更多的选择。
1 材料和方法
1.1 菌株与培养基
试验菌株:枯草芽孢杆菌N2-10菌株由本课题组分离;大肠杆菌(Escherichia coli)CICC-10004、金黄色葡萄球菌(Staphylococcus aureus)CICC10306 均购自中国工业微生物菌种保藏管理中心。以上菌株保存于河北农业大学农牧与饲用微生物协同创新平台。
营养肉汤(NB)培养基:牛肉膏5.0 g、蛋白胨10.0 g、氯化钠5.0 g,蒸馏水1 000 ml,pH值7.2~7.5。
营养琼脂(NA)培养基:含2%琼脂的固体NB 培养基。
发酵培养基:玉米粉13.0 g、葡萄糖10.0 g、大豆粉13.0 g,蒸馏水1 000 ml。
1.2 菌株的发酵培养
将N2-10 菌株接种于NB 培养基中,于(37±0.5) ℃、150 r/min摇床培养18 h,制得芽孢杆菌N2-10菌液。以8%接种量转接于发酵培养基中,相同培养条件下培养48 h,得发酵液。
1.3 指标测定
1.3.1 人工胃、肠液耐受性评价
参照刘秀侠等报道的方法配制人工胃液与肠液。配制后的溶液经微孔滤膜(0.22 μm)除菌,备用。分别将菌液按照10%的接种量(V/V)转接至pH值2.0、3.0、4.0 的人工模拟胃液中,混匀,放入41 ℃恒温水浴锅中,不断震荡。5 min后计时,3 h后取出,平板计数,计算存活率。吸取1 ml经pH值2人工胃液处理后的菌液,加入到9 ml人工肠液中,混匀,置于41 ℃恒温水浴锅中震荡。5 min后开始计时,4 h后取出,平板计数,计算存活率。以无菌水处理为对照,每组设3次平行。
1.3.2 肠道黏附性评价
1.3.2.1 菌悬液的制备及染色
分别将菌株N2-10、大肠杆菌和金黄色葡萄球菌接种至NB 培养基,37 ℃培养24 h 后,取菌液放于灭菌离心管中于4 ℃、4 500 r/min 离心10 min,收集菌体沉淀。用PBS溶液冲洗菌体3次,制成菌液。
取各菌液8 ml,分别与2 ml 10 μg/ml 的Hoechst 33258 染色液混匀,37 ℃下避光染色30 min,用PBS溶液冲洗2 次,收集各菌体悬浮于10 ml 的PBS 溶液中备用。
1.3.2.2 肠上皮细胞悬液的制备
肠上皮细胞的制备参照华荣虹等报道的方法:在超净台中,取10 cm的新鲜鸡回肠,用无菌PBS溶液反复冲洗。将除净内容物的肠末端结扎,用蔗糖缓冲液灌入肠管至轻微膨胀,结扎肠段的另一端。室温静置30 min 后,解开一端结扎线,弃去肠内溶液,再注入EDTA 缓冲液(蔗糖缓冲液量的1/2)灌充后结扎。将肠段放入37 ℃的无菌PBS溶液中处理30 min,每隔3 min 轻揉肠壁。后将肠段中的EDTA 溶液收集至离心管中,纵向剪开肠段,用载玻片轻刮黏膜表面到离心管中,反复吹打细胞悬液后,于4 ℃、3 000 r/min离心10 min,弃上清,沉淀用PBS 溶液悬浮离心反复洗涤3次,最后用10 ml PBS溶液悬浮,立刻用于黏附试验。
1.3.2.3 肠黏液蛋白的制备
肠黏液蛋白的制备参照张璐报道的方法:在超净台中,取15 cm 的新鲜鸡回肠,先用PBS 溶液冲洗,然后在PBS溶液中剪开肠管,洗涤,除去肠道内容物。将肠段转移至15 ml PBS溶液中,用载玻片轻刮肠黏膜表面的黏液不断搅拌。在4 ℃、8 000 r/min离心15 min。吸取上清液至离心管中,加入2 倍体积的无水乙醇混匀,离心,收集沉淀。沉淀悬浮于15 ml PBS 溶液中,-20 ℃保存,待用。
1.3.2.4 细胞黏附性测定
采用荧光法测定菌株N2-10 对肠上皮细胞的黏附性。取已染色的菌液1 ml 与等量肠上皮细胞悬液混匀,37 ℃孵育1 h,3 000 r/min 离心10 min,收集沉淀。PBS 溶液悬浮洗涤4 次,最后将沉淀悬浮于5 ml PBS溶液中。测定菌悬液的荧光强度F1(激发波长为340 nm,吸收波长为460 nm)。以染色的菌液1 ml与4 ml PBS溶液的混悬液为对照F0,每组3个平行。
菌株对肠细胞的黏附率(%)=F1/F0×100
1.3.2.5 肠黏液蛋白黏附性测定
将肠黏液蛋白悬浮液于4 ℃条件下解冻,采用荧光法测定菌株N2-10 对肠黏液蛋白的黏附性。分别取1 ml黏液蛋白加入到10支1.5 ml离心管中,4 ℃过夜,蛋白包被在离心管上。弃上清液,用PBS 溶液洗涤2次,除去未包被好的黏液蛋白。分别取各染色菌液1 ml 加入到蛋白包被的离心管中,温箱37 ℃孵育1 h 后弃去上清液,PBS 溶液洗涤2 次。再加入1 ml PBS 充分震荡,使黏附在壁上的菌悬浮于PBS 中,测其荧光值F2。以染色的菌液1 ml 与4 ml PBS 的混悬液为对照F0,每组3个平行。
菌株对肠黏液蛋白黏附率(%)=F2/F0×100
1.3.2.6 竞争试验
参照张璐报道的方法,测定菌株N2-10对供试病原菌的黏附阻断能力。分别取500 μl 染色的病原菌和500 μl 未染色的枯草芽孢杆菌N2-10 于包被好蛋白的离心管中,于37 ℃孵育1 h 后弃去上清液,洗涤离心管3次。加入1 ml PBS充分震荡,使黏附在壁上的菌悬浮于PBS溶液中,测定荧光值F3,每组设置3个平行。以1.3.2.5中的F2为对照。
菌株对病原菌阻断率(%)=F3/F2×100
1.3.3 细胞表面疏水性评价
参照碳烃化合物(BATH)黏着方法测定细胞表面的疏水性。取1 ml枯草芽孢杆菌N2-10菌液加入9 ml无菌PBS 溶液中,制成菌悬液。取2 ml 的菌悬液与2 ml的正十六烷混合于漩涡振荡器上充分振荡后静置分层。用紫外分光光度计测定水相部分在600 nm波长下的吸光度值(OD1)。对照为不加正十六烷的菌悬液,测吸光度值为OD2。试验在1 h内完成。
细胞表面疏水性(%)=(OD2-OD1)/OD2×100
1.3.4 抗生素敏感性评价
1.3.4.1 耐药性测定
采用滤纸片抑菌圈法测定枯草芽孢杆菌N2-10对抗生素的敏感性。取4 ml 枯草芽孢杆菌N2-10 菌液加入到100 ml融化的NA培养基(45 ℃左右)中,摇匀后倒平板。待枯草芽孢杆菌N2-10 的指示菌平板凝固后,分别将吸有25 μg/ml抗生素溶液的灭菌滤纸片(直径9 mm)以合适的间距置于平板上,每组3个平行。于37 ℃培养24 h,观察并记录抑菌圈情况。
1.3.4.2 最小抑菌浓度(MIC)
参照CLSI标准,采用平皿二倍稀释法。向融化的NA培养基(45 ℃左右)中加入抗生素药液至终浓度分别为100.0、50.0、25.0、12.5、6.25 μg/ml和3.0 μg/ml,倒平板。待平板凝固后,吸取枯草芽孢杆菌N2-10菌液70 μl 接种到不同浓度的抗生素平板上,涂布均匀,37 ℃培养24 h,观察菌落,无菌生长的平皿中所含药物的最小浓度即为最小抑菌浓度(MIC)。
1.3.5 体外抗氧化能力评价
1.3.5.1 铁离子还原能力(ferric reducing antioxidant power,FRAP)测定
FRAP工作液的配制及测定参照孟歌等报道的方法,绘得Fe2+标准曲线,计算回归方程为y=0.606 9x-0.030 4,相关R2=0.998 3。
样品FRAP 测定:取枯草芽孢杆菌N2-10 发酵液5 000 r/min、离心20 min。取100 μl 上清液加入到3.9 ml 2,4,6-三吡啶基三嗪(TPTZ)工作液中,经35 ℃水浴30 min,593 nm 波长下测定OD 值。根据OD 值在标准曲线上对应的Fe2+浓度,定义为FRAP值。
1.3.5.2 ABTS+自由基清除能力测定
ABTS+自由基工作液的制备:吸取176 μl 的140 mmol/l过硫酸钾加入到10 ml ABTS(7 mmol/l)溶液中,室温下避光反应12 h。
ABTS+自由基清除能力的测定,参照孟歌等报道的方法,用60%体积分数的乙醇溶液将ABTS+自由基工作液在734 nm 波长下的吸光度值调至(0.700±0.020)。取100 μl 枯草芽孢杆菌N2-10 发酵上清液,加入到3.9 ml的ABTS+自由基工作液中,充分混匀,常温放置10 min,测定其在734 nm 波长下的OD 值(A1)。以添加100 μl 60%体积分数的乙醇为空白对照(A0),每组设3 个平行。发酵上清液对ABTS+自由基的清除率用下列公式计算。
ABTS+自由基清除率(%)=(A0-A1)/A0×100
1.3.6 菌株体外产酶能力
挑取枯草芽孢杆菌N2-10 分别接种于产纤维素酶、淀粉酶和蛋白酶的鉴别培养基上,置于37 ℃恒温培养箱中培养。以鉴别培养基平板上透明圈(或脱色圈)直径的大小及快慢来定性检测各种酶的产生情况。酶活力测定参照Fernandes等报道的方法。
1.3.7 数据统计方法
采用Excel 2007 软件进行数据整理,采用SPSS 23.0 软件的one-way ANOVA 程序对数据进行单因素方差分析,以Duncan's法进行多重比较,结果以“平均值±标准差”表示,以P<0.05 和P<0.01 作为差异显著和极显著的判断标准。
2 结果与分析
2.1 胃肠道耐受性评价
枯草芽孢杆菌N2-10 在体外模拟胃肠道环境中的存活率,如表1 所示。在pH 值2、3 的胃酸环境下,较对照存活率极显著下降(P<0.01),pH值4的胃酸环境下,存活率显著下降(P<0.05),但存活率均较高,在80%以上,且不同酸性环境下存活率差异不显著(P>0.05),说明该菌对胃酸环境耐受力较强。将在pH值2 的人工胃液中处理3 h 后的菌株N2-10 继续在人工肠液中处理4 h,菌株的存活率下降至36.1%。
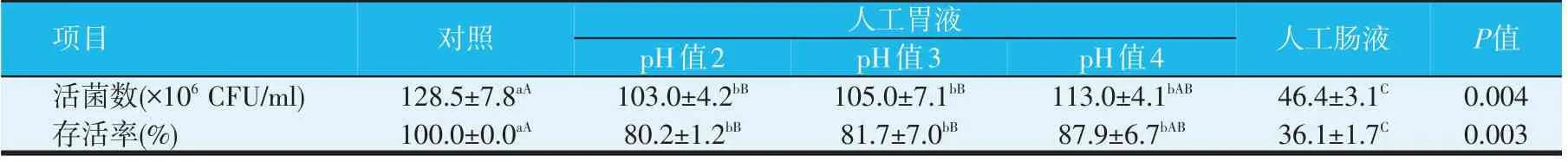
表1 枯草芽孢杆菌N2-10在体外模拟胃肠道环境中的存活率
2.2 黏附性评价
枯草芽孢杆菌N2-10对鸡肠上皮细胞、黏液蛋白的黏附性以及对2株供试病原菌的黏附阻断能力,如表2 所示。菌株N2-10 对肠上皮细胞有极好的黏附性,黏附率为78.31%,极显著高于大肠杆菌和金黄色葡萄球菌的黏附率(P<0.01)。同时,枯草芽孢杆菌N2-10 对肠黏液蛋白也表现出一定的黏附性,黏附率为45.50%,与金黄色葡萄球菌的黏附率45.12%相近,但极显著低于大肠杆菌的黏附率96.19%(P<0.01)。枯草芽孢杆菌N2-10对2株供试病原菌均表现出黏附抑制作用,且对金黄色葡萄球菌和大肠杆菌的抑制能力差异极显著(P<0.01)。其中,菌株N2-10 能完全阻断金黄色葡萄球菌对肠黏液蛋白的黏附,对大肠杆菌有部分阻断作用,阻断率为58.40%。

表2 枯草芽孢杆菌N2-10的黏附性评价结果(%)
2.3 疏水性评价(见表3)

表3 枯草芽孢杆菌N2-10的细胞表面疏水性
枯草芽孢杆菌N2-10 的疏水率为31.9%,表明该菌株具有中度疏水性能,利于其在肠道内定植。
2.4 抗生素敏感性(见表4)
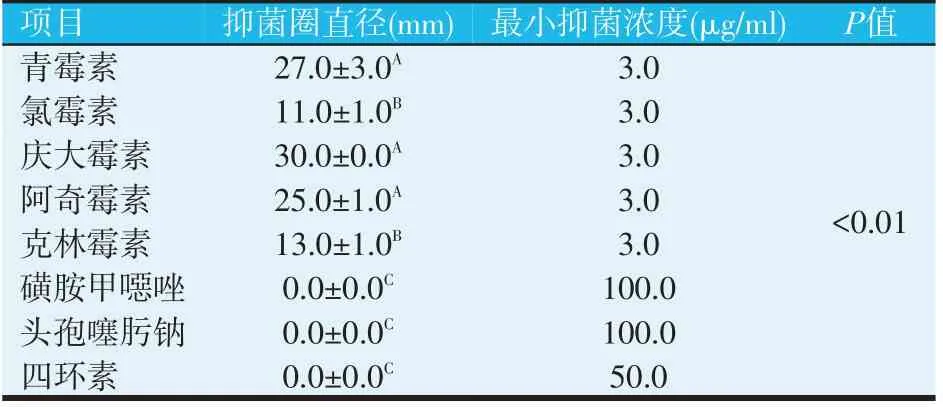
表4 枯草芽孢杆菌N2-10对抗生素的敏感性
由表4可知,枯草芽孢杆菌N2-10对青霉素、氯霉素、庆大霉素、阿奇霉素和克林霉素敏感,而对四环素、磺胺类和头孢类抗生素较不敏感。青霉素、氯霉素、庆大霉素、阿奇霉素和克林霉素对菌株N2-10的最小抑菌浓度(MIC)为3 μg/ml,四环素的MIC为50 μg/ml、磺胺甲噁唑和头孢噻肟钠的MIC为100 μg/ml。25 μg/ml庆大霉素和青霉素对N2-10菌株抑制作用最强,抑菌圈可达30 mm和27 mm。
2.5 体外抗氧化及产酶能力(见图1、表5)
枯草芽孢杆菌N2-10 表现出较强的体外抗氧化活性:FRAP 为0.488 mmol/l,对ABTS+自由基的清除率可达90.47%(表5)。
N2-10 菌株还具有产淀粉酶、蛋白酶及纤维素酶的能力。定性鉴别试验及酶活力测定结果分别如图1和表5所示。
3 讨论
不断开发新的菌种资源,并对菌株安全性和有效性进行评价是获得更优良的益生菌的必要前提和保障。本研究针对前期获得能抑制肠道病原菌的枯草芽孢杆菌N2-10的体外益生特性进行深入探讨,以期为其作为益生菌在畜牧养殖和饲料生产中的应用提供理论依据。

图1 菌株产酶能力检测结果

表5 枯草芽孢杆菌N2-10的抗氧化和产酶能力
首先,益生菌必须能耐受胃的酸性条件,才能到达结肠,使之处于可生存状态,发挥其积极作用。这就要求益生菌除能耐受胃酸外,还要耐受肠道中胆盐形成的高渗环境。人和动物胃液酸性高,正常pH 值2.0,进食后可达到4.0。本文研究发现菌株N2-10在含胃蛋白酶、pH值2~4范围内人工胃液中的存活率均在80%以上,与杨伟平等研究中的益生枯草芽孢杆菌的胃酸耐受能力相似,但明显优于周明等对猪源枯草芽孢杆菌的研究结果。虽然在pH值2的人工胃液中处理3 h 后,再经人工肠液中处理4 h,菌株的存活率下降至36.1%,但是其对于肠道胆盐环境的耐受性仍显著优于其他益生菌,如大肠杆菌Nissle 1917(EcN)。
其次,黏附性对于益生菌在肠道中的定植至关重要。优良的黏附特性不仅可以确保益生菌避免因肠道的收缩和蠕动而被迅速排出,还能阻断病原体通过空间相互作用或特定的细胞受体堵塞而附着,从而将它们从肠道中清除。本文选取革兰氏阴性菌大肠杆菌和革兰氏阳性菌金黄色葡萄球菌为供试病原菌,采用荧光法对比发现:枯草芽孢杆菌N2-10对鸡上皮细胞的黏附性能远高于金黄色葡萄球菌和大肠杆菌,对肠道黏液蛋白的黏附作用与金黄色葡萄球菌相似,但低于大肠杆菌。在竞争试验中,菌株N2-10能完全阻断金黄色葡萄球菌对肠黏液蛋白的黏附,而对大肠杆菌表现出部分黏附抑制作用,阻断率为58.4%。众所周知,动物肠道中生存着大量的微生物,这些微生物定植于肠道的黏膜表面,与肠道黏膜共同建立起一层稳定的生物屏障。曾东等的研究则表明:黏附力较强的菌株能在宿主体内很好地定植,并通过菌株的竞争作用降低致病菌的黏附力。菌株N2-10 对肠上皮细胞和黏液蛋白黏附性能较佳,且对金黄色葡萄球菌和大肠杆菌均表现出黏附抑制作用。同时前期研究也表明:菌株能产生抑制大肠杆菌等病原菌的脂肽类抑制物质,由此可推测:菌株N2-10进入动物肠道后,能黏附于肠黏膜表面而定植,并能明显抑制致病菌黏附,甚至能通过产生脂肽类抑菌物质杀死病菌,从而调节、改善肠道菌群结构,提高肠道微生态的稳定性。另外,益生菌菌株的黏附通常与细胞表面的疏水性、细胞外成分和蛋白质谱等性质有关。具有高疏水性的细菌细胞通常与黏膜细胞有很强的相互作用。经测定,菌株N2-10的疏水率为31.9%,表现出一定的疏水能力,这也解释了菌株N2-10对肠上皮细胞和肠黏液蛋白的黏附作用。
再者,随着益生菌的广泛使用,其安全性成为人们广泛关注的重点。抗生素敏感性是分析菌株在应用中安全使用的重要特征。菌株N2-10 对多种类型的抗生素敏感,能保证其在使用过程中安全可控,防止因其过度增殖而造成危害。
此外,氧化应激会破坏机体内正常的氧化和抗氧化系统间的平衡,从而引起细胞和组织的生理和病理反应。氧化应激会影响畜禽的健康,降低生产性能,对畜牧生产造成较为广泛的危害。人们在不断开展抗氧化剂的研究,以减少氧化应激给生产带来的损失。本文通过FRAP和ABTS法测定了菌株N2-10的抗氧化能力,发现其FRAP能达到0.488 mmol/l,对ABTS+自由基的清除率可达到90.47%,与孟歌等报道的灵芝发酵液的抗氧化活性相当。说明了枯草芽孢杆菌N2-10可产生抗氧化活性物质,能有效清除体内过量自由基,从而提高机体免疫能力,具有对抗氧化应激的潜力。
最后,益生菌定植后,它们会释放相关的消化酶和其他必要的生长因子,可促进营养同化,从而防止肠道失调和促进生长。试验证明菌株N2-10 可产生淀粉酶、蛋白酶及纤维素酶,可在一定程度上促进饲料营养成分的消化代谢,提高动物生长性能。
4 结论
综上,枯草芽孢杆菌N2-10 耐受胃肠道内环境、在肠道中定植、能阻断病原菌金黄色葡萄球菌和大肠杆菌在肠道内的黏附,并具有产酶和抗氧化活性,有较强的应用潜力。

