核酸质谱检测结核分枝杆菌耐药方法的建立
2021-01-06余艳芳赵开顺屠春林陈娓梁海鹰易清清
余艳芳 赵开顺 屠春林 陈娓 梁海鹰 易清清
2019年世界结核报告显示,2018年全球结核潜伏感染人群占全人群的1/4左右(感染人群高达约17亿),其中结核新发病例近1 000万,其中中国新发结核患者86.6万;报告显示我国58%初诊结核病例(细菌学上确认)对利福平耐药,复诊患者(有治疗经历的患者)100%耐利福平,耐药结核病(drug-resistant tuberculosis, DR-TB)尤其是耐多药结核病(multidrug- resistant tuberculosis, MDR-TB)是严重影响中国乃至世界的公共卫生难题[1]。吡嗪酰胺、乙胺丁醇作为一线口服类抗结核药物,其药敏结果均存在不够准确性,且吡嗪酰胺在耐多药、广泛耐药结核病中的耐药率较高,临床上对于复诊患者(有治疗经历的患者)应谨慎使用[2-3]。WHO强调,在治疗耐药结核病的强化期均使用一种二线注射类药物,其中氟喹诺酮类药物是治疗耐多药结核病最有效的药物,并能够用于不耐受现有一线抗结核药物的患者[4-5]。临床药敏试验是检测结核耐药的临床金标准,但耗时久,导致的诊断延迟无论对于患者本身的治疗,还是控制耐药结核菌的传播,都是十分不利的[6]。对于结核患者的耐药检测,临床上迫切需要一种快速、准确的手段,减小延迟诊断导致的不良影响,由于耐结核药物的临床菌株的分子机制目前尚不完全明确,因此,分子生物学手段可作为传统细菌学检测的补充,不能完全代替药敏检测技术来鉴定临床菌株的耐药性[7-9]。
核酸飞行质谱检测平台是复杂生物样品中痕量核酸进行全方位研究的技术平台,具有通量高、检测速度快、成本低的特点[10],美国食品药品监督管理局(FDA)于2014年批准MALDI-TOF MS可用于临床核酸检测,该技术其检测效率、检测通量均远高于荧光定量PCR检测,而检测周期又远低于传统的一代测序和二代测序(≥18h),少量的临床标本也可进行多基因多位点的检测[11-12],可极大程度的满足临床检测的需求。本研究基于MassARRAY核酸飞行质谱检测平台,分析复治患者(有治疗经历的患者)抗结核药物异烟肼、氟喹诺酮类药物(左氧氟沙星、莫西沙星)和二线注射类药物(阿米卡星、卷曲霉素)的耐药性,并与临床药敏测试结果对比,为建立快速准确的鉴定结核患者耐药的分子检测技术奠定一定的基础。
资料与方法
一、一般材料
收集2016年1月-2019年6月上海市嘉定区中心医院肺科肺结核复诊患者(有治疗经历的患者)的菌培养样本55例,最低抑菌浓度法(minimum inhibitory concentration, MIC)[13-14]鉴定为临床耐药的样本45例,其中异烟肼和氟喹诺酮类耐药45例,二线注射类耐药23例,药物敏感样本10例。结核病患者中男性患者44例,女性患者11例,年龄范围35~64岁,平均年龄47岁。培养其菌液样本,提取DNA,用于后续实验。
二、仪器与试剂
1 仪器
洁净工作台购自苏州安泰技术有限公司(中国,VD-650-U),PCR仪购自Eppendorf(德国),板式离心机购自Eppendorf(德国,5804R),去离子水仪购自上海舟技化工科技有限公司(中国,EasyQ-A0.5),Hula翻转摇匀仪购自其林贝尔仪器制造有限公司(中国, BQ-210),MassARRAY® RS1000 Nanodispenser购自Agean公司(美国,63008),MassARRY® Analyzer 4 System-96购自Agena公司(美国, 63010)。
2 试剂
Complete iplex pro genotyping reagent购自Agena(美国,10160),PCR引物和UEP探针购自Genscript(中国),菌株提取试剂盒购自宁波重鼎(中国,ZD-TG-08-100)。
三、方法
1 临床耐药菌株培养和提取
用最低抑菌浓度法(minimum inhibitory concentration, MIC)鉴定为MTB临床耐药的样本45例,药物敏感样本10例,取其痰液2 mL,用2.94%和枸橼酸钠溶液和4%的NaOH溶液(用之前加0.5 g NALC)混合的溶液进行液化,振荡30s,如果样本粘稠,可适当延长消化时间,室温(20℃~25℃)放置15 min,加入1/15 M PBS缓冲液20 mL,混匀,以3 000 g离心20~30 min,倾去上清液,加入1/15 M PBS缓冲液0.5 mL,混匀后接种于培养基中。接种的培养基在37℃孵育。培养后的菌株,提取菌液基因组DNA。MIC的临床耐药标准按照前人的研究中为标准进行判读[13]。本实验采用重鼎试剂盒提取结核分枝杆菌菌株基因组DNA。
2 耐药相关位点引物和单碱基延伸引物(unextended extend primer,UEP)设计

表1 质谱检测耐药位点与药物
MALDI-TOF MS其检测原理为:基于多重PCR,检测标本经普通PCR引物(多重)扩增后,将PCR扩增产物经虾碱性磷酸酶(Shrimp Alkaline Phosphatase,SAP)去除PCR产物中的脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate, dNTP),纯化后的产物在加入双脱氧核苷三磷酸(dideoxy-ribonucleoside triphosphate, ddDNP)的体系中,经特异的单碱基延伸引物进行单碱基延伸反应,1个反应管可同时检测高达40个SNP位点,且无需荧光标记[11],将所获得的延伸产物转移至特制的芯片上并进行质谱分析。根据此原理,结合前人研究,针对异烟肼、氟喹诺酮类和二线注射类的阿米卡星、卷曲霉素耐药相关位点设计引物(见表2)和UEP(见表3),检测涵盖耐药相关的6个基因的14个位点,利用MassARRAY® Assay Design Suite(Agena)进行设计引物和UEP设计。
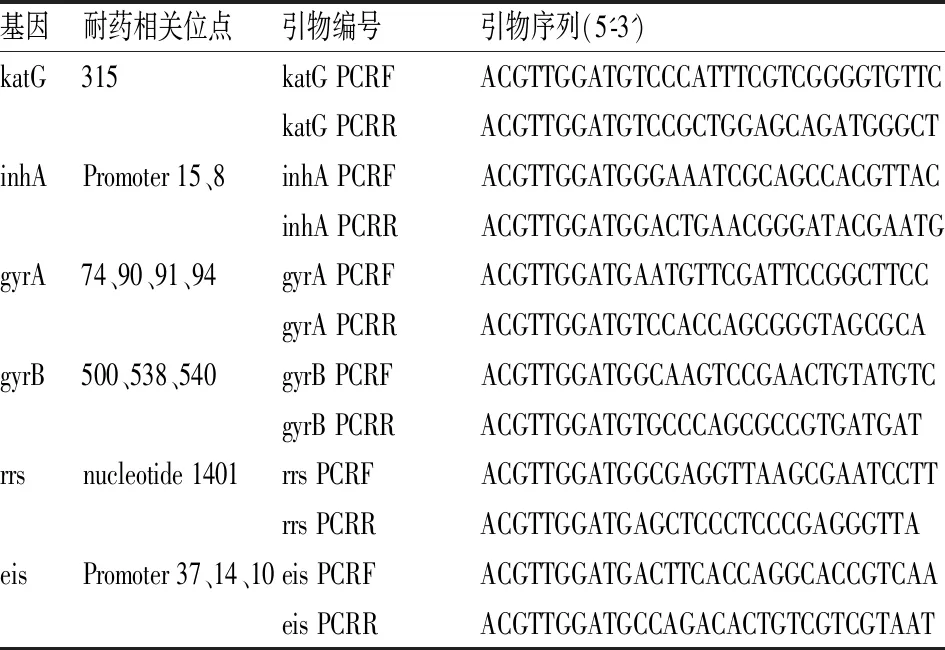
表2 核酸飞行质谱检测位点扩增引物表
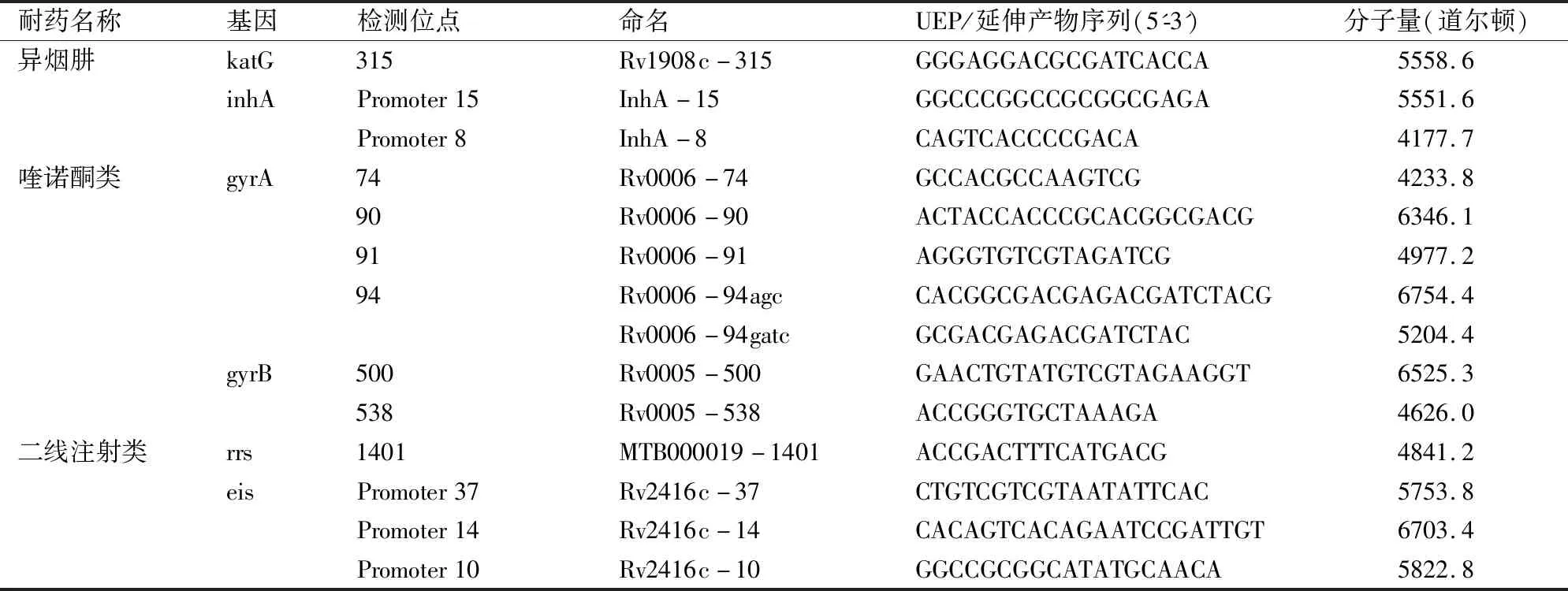
表3 核酸飞行质谱检测突变位点单碱基延伸序列表
3 核酸质谱检测耐药位点的突变与一代测序验证
提取后的基因组DNA用于核酸质谱检测,检测方法概括为:配置反应液5 μL,进行PCR扩增,扩增程序为95℃ 2分钟,(95℃ 30秒,56℃ 30秒,72℃ 60秒)45个循环,72℃ 5分钟;扩增后的产物取5 μL加入2 μL的SAP酶和缓冲液的混合溶液进行dNTP和多余引物的去除,程序为37℃ 40分钟,85℃ 5分钟;再加入2 μL的单碱基反应液(UEP反应液)2 μL进行检测位点的单碱基延伸反应,反应程序为94℃ 30秒,(94℃ 5秒,52℃ 5秒,80℃ 5秒)40个循环,72℃ 3分钟;将反应液中加入适量洁净树脂,在Hula翻转摇匀30分钟;将96孔板离心10分钟,在MassARRAY® RS1000 Nanodispenser上点样到芯片,将芯片在MassARRY® Analyzer 4 System-96上打质谱。将质谱检测位点涉及的区域PCR扩增并用一代测序检测该区域突变,比对与质谱检测一致性。
四、统计学处理
以一代测序和MIC方法检测的突变和临床耐药为金标准,敏感度计算方法为真阳性数/(真阳性数+假阴性数)×100%;特异性计算方法为真阴性数/(真阴性数+假阳性数)×100%;符合率计算方法为[(真阳性数+真阴性数)/检测总数]×100%。应用统计学软件SPSS 20.0进行Kappa检验,Kappa≥0.75认为一致性良好,Kappa在0.4~0.75之间认为一致性一般,Kappa<0.4认为一致性较差。[15]
结 果
一、临床耐药菌株培养和提取
将MIC方法鉴定为耐药的菌株分离,培养后提取,耐药培养结果和提取浓度结果(见表4)。
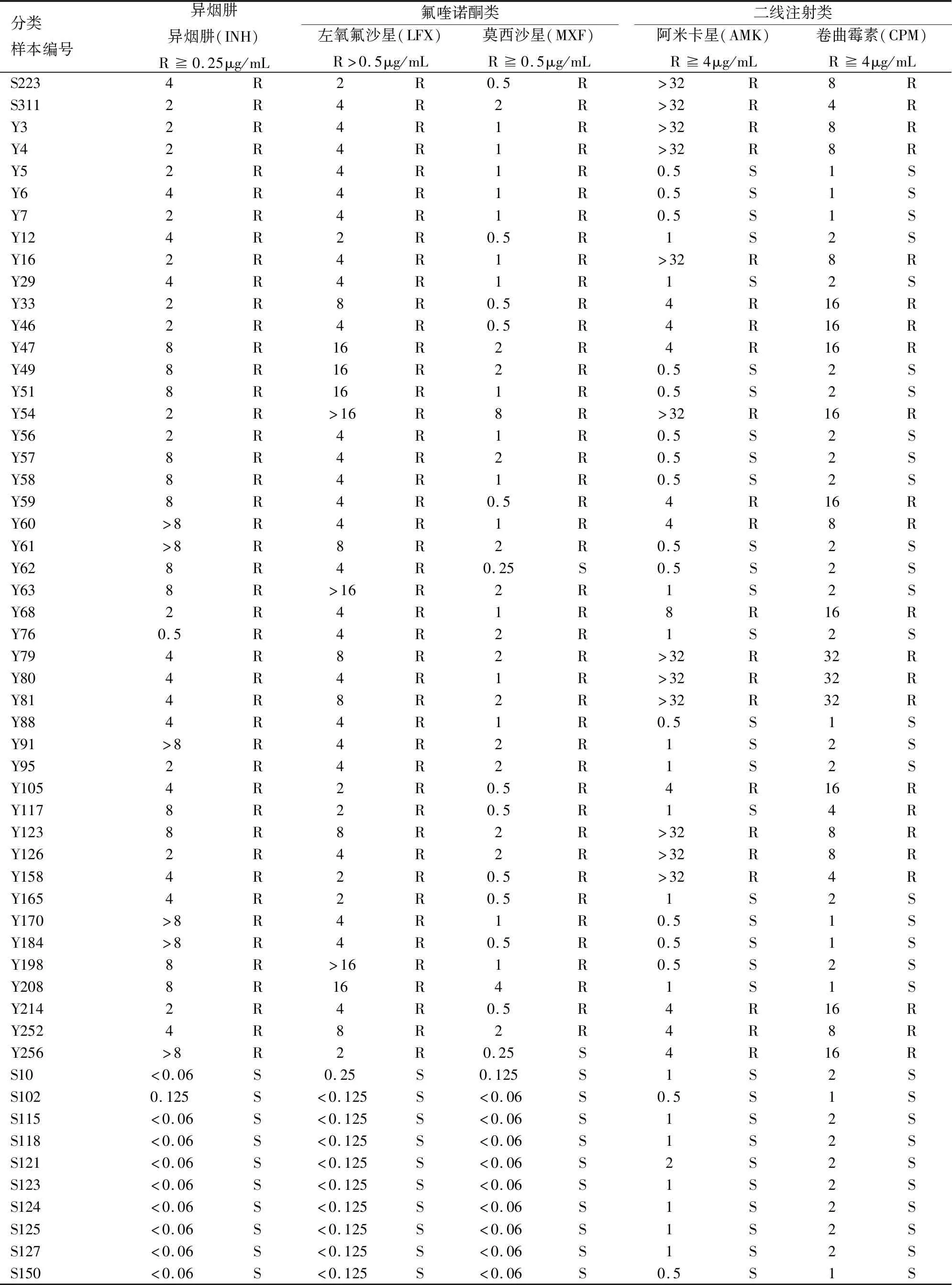
表4 耐药菌株MIC结果
二、核酸质谱基因突变检测与一代测序突变检测结果比较
目前,单核苷酸多态性(SNP)的金标准验证技术为Sanger测序技术[16],,本研究中55株临床菌株样本的核酸质谱检测与一代测序检测结果(见表5),其中检测异烟肼的耐药突变灵敏度为100%(37/37),特异性为100%(18/18);检测氟喹诺酮类的耐药突变灵敏度为100%(34/34),特异性为100%(21/21);检测二线注射类的耐药突变灵敏度为100%(10/10),特异性为(45/45)。总体核酸质谱检测与一代测序检测一致率100%,一致性检验Kappa值为1。表明质谱检测耐药相关突变位点的准确性与金标准检测方法一致,而相比一代测序,核酸质谱检测更加快速,操作简便。

表5 55例MTB菌株核酸质谱耐药突变与一代测序检测结果比较
三、核酸质谱基因型药敏试验与表型药敏试验对比结果
质谱检测基因型药敏与临床表型药敏的比对结果(见表2~3)。在45株异烟肼耐药菌株中,质谱检测含耐药突变的菌株有37例,检测灵敏度为82.2%(37/45),特异性为分别为100%(10/10);在45株氟喹诺酮类耐药菌株中,质谱检测含耐药突变的菌株有34例,检测灵敏度为75.6%(34/45),特异性为100%(10/10);在临床药敏检测的23株二线药耐药株中,质谱检测含耐药突变的菌株有10例,全部为rrs基因1401 A→G的突变,检测灵敏度为45.5%(10/22),特异性为100%(33/33)。两种方法的总一致率为89.1%,一致性检验Kappa值为0.703。
四、常见突变位点的分析
在45株异烟肼耐药菌株中,KatG基因的315密码子AGC→ACC为最常见突变,有36例(97.3%,36/37),其中有12例样本含有inhA-promoter的双突变,且含双突变的样本,其临床MIC检测耐药性更强(MIC≥8)。在45株氟喹诺酮耐药菌株中,gyrA基因94密码子GAC→GGC为最常见突变位点,有15例(44.1%,15/34),与gyrA基因相关的突变样本有32例(包含一代测序检测出的突变样本)。Y198、Y 47、Y 49、Y 51、Y 63样本含有两个突变,其临床MIC检测耐药性更强(MIC≥16)。在临床药敏检测的23株二线药耐药株中,质谱检测含耐药突变的菌株有10例,全部为rrs基因1401 A→G的突变。临床检测灵敏度与前人研究存在较大差异。
讨 论
本研究中核酸质谱检测基因变异与一代测序具有良好的一致性,并且在预测MTB菌株耐药方面具有一定的一致性,可同时预测多种药物的耐药性,由于检测法需8h获得结果(其手工操作时间<30min),1个反应管可同时检测高达40个SNP位点,使其检测效率、检测通量均远高于荧光定量PCR检测,而检测周期又远低于传统的一代测序和二代测序(≥18 h),少量的临床样本也可进行多基因多位点的检测,可极大程度的满足临床检测的需求[12]。

表6 55例MTB菌株核酸质谱基因型药敏试验与表型药敏试验结果比较
研究发现,超过80%的异烟肼耐药与KatG基因及inhA 基因突变相关,本研究用一代测序对KatG基因和inhA基因的突变热点区域进行检测,发现本研究耐药突变检测位点中不包含的katG基因315位密码子AGC→ACG和inhA 基因promoter(-34)C→T两个突变位点,而在其他的研究中,这两个位点的突变发生频率很低[17];氟喹诺酮类药物耐药与gyrA基因和gyrB基因突变相关,gyrA基因耐药决定区(quinolone resistance determining region, QRDR)发生 突变可以解释60%~90%的菌株耐药,且gyrA基因和gyrB基因双突变的菌株表现为高水平的耐药[18-19],本研究与前人的研究相符。Ruiru Shi[20]等人,研究显示gyrA双点突变报道较多,其研究中有56%的临床菌株存在gyrA基因双突变,Avalos E[19]等人研究显示,仅1%~3%的耐药菌中存在 gyrA 基因双突变,本研究总共31例在gyrA基因突变的菌株中(包含一代测序结果),含2株(6.25%,2/32)gyrA双点突变株,可能与各研究中不同的检测方法和检测区域有关,也可能与不同区域的菌株本身突变特性相关。本研究用一代测序方法筛查gyrA基因和gyrB基因的序列,发现gyrA基因的(70位密码子CAC→CGC)和gyrB基因的(539位密码子ACC→GCC、543位密码子GCG→ACG、551位密码子GGG→AGG)突变型均不在喹诺酮类药物的耐药决定区,是值得关注的耐药突变相关位点。
本研究中二线注射类药物的灵敏度为45.5%,与前人研究结果差异较大,总结国内外部分研究发现[21-22],通过该位点的突变检测结核菌株耐药的灵敏度从1.8%~100%范围内不等,其中在中国人群中,灵敏度从50.6%~86.4%不等。由于本研究所有检测标本均进行一代测序验证检测,且验证结果和核酸质谱多重检测结果一致,因此可排除由于多重PCR设计导致引物间相互作用致使其检测不到耐药突变,因此,推断二线注射类药物灵敏度低可能是本研究中二线注射类耐药患者纳入的临床研究标本相对较少,也可能由于设计涉及的耐药突变位点(rrs基因A1401G)与临床耐药存在地域性差别,或者是该类菌株存在其他耐药位点或其他耐药机制,这扩大研究标本量和扩大突变检测区域进行更进一步的验证。
