BMI、NLR、PLR以及网织红细胞系列指标与肥胖合并OSAHS患者病情的相关性分析
2021-01-06张颖刘九玉马长秀项莹檀竹霞赵卉
张颖 刘九玉 马长秀 项莹 檀竹霞 赵卉
阻塞性睡眠呼吸暂停低通气综合征(obestructive sleep apnea hypopnea syndrome,OSAHS)是一种以睡眠打鼾伴呼吸暂停和日间嗜睡为主要临床表现的睡眠呼吸疾病,近年来全球的OSAHS患病率逐年增高,随着病情的进展,还会导致机体其他器官的损伤。流行病学及相关研究已证实,OSAHS与心脑血管疾病如高血压、冠心病等密切相关。此外OSAHS患者中肥胖者比例高达50%~70%[1],若不及时治疗,会显著增加高血压、糖尿病、甚至猝死的发生风险。所以针对严重肥胖合并OSAHS 患者,采取积极减重措施以减低OSAHS风险很有必要。最新研究[2]认为,减重代谢手术能够显著改善肥胖型OSAHS患者症状,但由于肥胖患者中OSAHS发病率高而诊断率低,围手术期各种呼吸系统并发症都对减重手术的安全性带来了极大的挑战。因此,如何及时评估减重代谢手术患者术前OSAHS严重程度以及术后病情的改善情况以指导术后进一步治疗,成为临床研究者关注的问题。目前国际公认该疾病的诊断金标准为多导睡眠监测(PSG),但其诊断过程困难复杂,难以普及。因此寻找客观敏感的生物学标志物来诊断OSAHS 已经成为目前的热点。
研究发现OSAHS与肥胖交互作用共同导致全身性异常炎症反应,间歇性低氧(IH)是OSAHS 患者病理生理的主要特征,反复低氧及高碳酸血症诱发炎症反应,同时缺氧可导致细胞坏死与巨噬细胞浸润和促炎脂肪细胞因子的产生,因此OSAHS与肥胖共同促进炎症的发生[3]。中性粒细胞与淋巴细胞比值(NLR)、血小板与淋巴细胞比值(PLR)是近来发现反映机体炎症状态的新指标。另有研究发现,网织红细胞绝对值(RET)在间歇性低氧暴露数天后显著增加[4]。这些指标从理论上可反应OSAHS的严重程度。因此,我们旨在探索外周血相关指标变化与OSAHS病情程度的相关性,以期利用这些简单易得的指标对行减重手术患者进行术前OSAHS的筛查,从而指导术前使用无创呼吸机等治疗以降低手术并发症的发生风险,继而通过手术前后相关数据的改变程度以判断病情是否改善,为诊断及治疗带来更大获益。
资料与方法
一、研究对象
收集2019年1月至2020年1月于安徽医科大学第二附属医院减重代谢中心住院期间拟行减重代谢手术(LSG)的70例肥胖患者术前相关资料。本研究方案经过我院伦理委员会批准,所有参试患者检测均获得过患者或家属的知情同意。
1 纳入标准 (1)根据WHO制定标准BMI≥ 32.5 Kg/ m2;或27.5 Kg/m2≤ BMI< 32.5 Kg/m2,经改变生活方式和内科治疗难以控制,且至少符合2项代谢综合征或糖尿病;(2)具备正常交流能力,能积极配合完成多导睡眠监测(PSG),并根据《2012年AASM睡眠及相关事件评分手册》[5]进行判读:当满足以下所有标准时,定义呼吸暂停(热传感器峰值较基线下降≥90%;事件持续时间至少持续10秒;至少90%的事件持续时间符合呼吸暂停幅度降低标准);当满足以下所有标准时,定义低通气(热传感器峰值较基线下降≥30%;氧饱和度较基线降低≥3%;事件持续时间至少持续10秒)。呼吸暂停-呼吸紊乱指数( AHI=每小时睡眠内呼吸暂停+低通气的次数) ≥5/h可诊断为OSAHS;(3)具有完整的临床资料。
2 排除标准 (1)BMI<27.5 Kg/m2,且无合并症及代谢综合征组分;(2)患有任何已知的循环系统、呼吸系统、血液系统、慢性肝肾疾病者;(3)患有任何已知的恶性肿瘤;(4)近半年接受抗凝或全身皮质类固醇治疗;(5)有癫痫等精神疾病者;(6)患有甲状腺功能减退症或肢端肥大症等疾病而继发性肥胖者,曾接受或正接受药物治疗的肥胖患者。
二、研究方法
1 一般资料采集 包括性别、年龄、体重、身高、有无合并高血压、糖尿病,并计算体质量指数(BMI)=体重(kg)/身高(m)2(BMI=kg/m2)。
2 PSG 所有研究对象均于安徽医科大学第二附属医院呼吸睡眠中心进行PSG检查,保证患者在安静、舒适的状态下,采用安波澜S4500多导睡眠监测仪,进行夜间睡眠呼吸监测(持续时间≥7 h),国际标准方法同步记录脑电图(EEG)、双眼眼电图(EOG)、颏舌肌肌电图(EMG)、胸腹呼吸运动、口鼻气流、鼾声、心率和末梢血氧饱和度等,次日分析各项PSG监测指标,由两位呼吸内科专科医师共同得出PSG监测报告。通过AHI将研究对象分为四组:非OSAHS组(AHI<5/h),OSAHS轻度组(5≤ AHI<15/h),OSAHS中度组(15≤ AHI<30/h),OSAHS重度组(AHI≥30/h)。
3 血液指标检测 使用含乙二胺四乙酸(EDTA-K2)的真空采血管,向患者告知实验目的,得同意后于行多导睡眠监测次日晨起后早6:00-7:00静息状态下抽取患者外周静脉血2 mL。采用日本Sysmex K-4500全自动血液分析仪进行血液分析,主要指标包括NLR、PLR、RET、IRF、血红蛋白(Hb)、红细胞分布宽度(RDW)、中性粒细胞绝对值、淋巴细胞绝对值和血小板计数。本研究中血液样本的检测由安徽医科大学第二附属医院检验科完成。
三、统计学分析
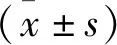
结 果
一、一般情况
本研究共纳入70例患者,其中男性24例(34.3%),女性46例(65.7%),平均年龄30.7±9.1岁。非OSAHS组及轻中度组女性比例明显高于男性,而重度组男性比例高于女性。各组年龄、高血压、糖尿病比较差异无统计学意义(P>0.05)。
二、临床资料比较
中重度OSAHS组患者BMI明显高于轻度及非OSAHS组(P<0.05),重度OSAHS组睡眠相关参数平均指脉氧饱和度(MSpO2)、最低指脉氧饱和度(LSpO2)均显著低于轻度及非OSAHS组(P<0.01),而OSAHS组血液学指标NLR、RET、IRF重度组均高于非OSAHS组,(P<0.05),但PLR组间比较差异无统计学意义(P>0.05)(见表1及图1)。
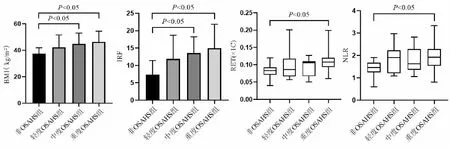
图1 各组临床资料分布特征
三、肥胖合并OSAHS患者影响因素分析
对肥胖患者合并OSAHS发生的可能影响因素进行统计学分析,通过单因素Logistic 分析发现BMI、NLR、RET、IRF、MSpO2、LSpO2这部分指标有统计学意义 (P<0.05);将以上指标以及临床可能有意义的性别、PLR共同纳入多因素 Logistic 回归分析,结果显示,重度肥胖患者发生OSAHS的独立危险因素包括BMI、IRF(P<0.05)(见表2)。
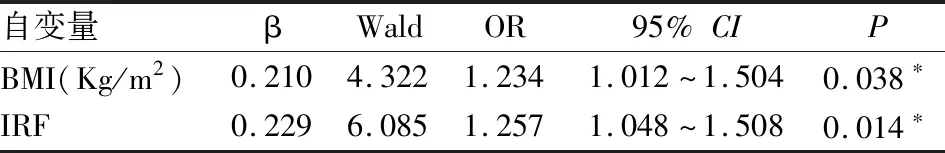
表2 多因素Logistic回归分析肥胖患者OSAHS发生的危险因素
四、ROC分析
通过多因素Logistic回归分析发现的独立影响因素为BMI以及IRF,建立ROC曲线,结果显示用BMI作为诊断指标时曲线下面积(AUC)为0.792,最佳截断值为38.37,在此截断值下,灵敏度为73.3%、特异度为80.0%;用IRF作为诊断指标时AUC为0.810,最佳截断值为9.50,在此截断值下,灵敏度达80.0%、特异度为80.0%;而两指标联合诊断AUC为0.897,且在最佳截断值下灵敏度及特异度分别为71.7%和100.0%,约登指数(0.717)明显升高,表明联合指标诊断价值较单一指标更高(见表3及图2)。
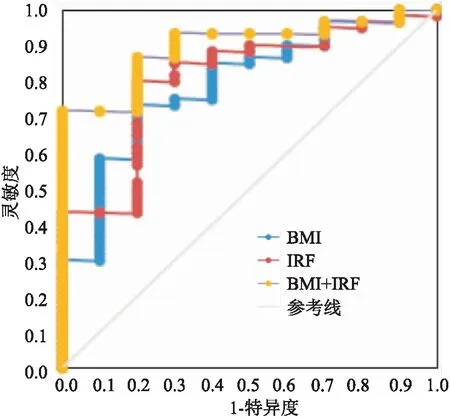
图2 BMI、IRF预测OSAHS的ROC曲线
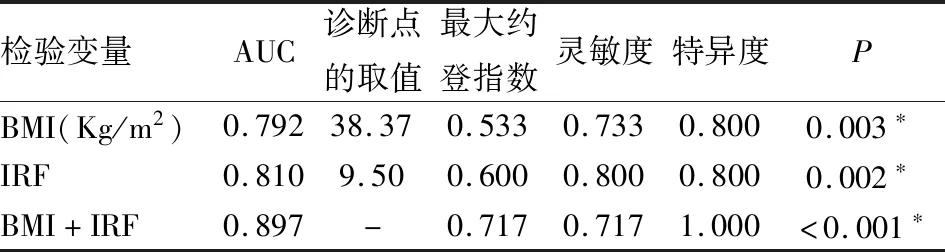
表3 各指标对肥胖患者OSAHS诊断的效果评价
五、相关性分析
对研究变量与AHI等睡眠参数之间行Spearman相关分析,结果显示BMI、IRF、RET、NLR与AHI均呈正相关(P<0.05),而BMI、NLR与MSpO2、LSpO2呈负相关(P<0.05),IRF和RET与MSpO2呈负相关(P<0.05)(见表4)。
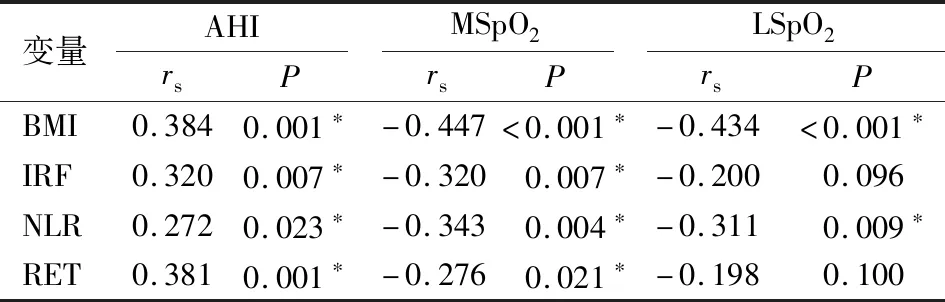
表4 研究变量与睡眠参数的相关性分析
讨 论
OSAHS是一种常见的睡眠障碍疾病,其特征是上呼吸道部分或完全阻塞的反复发作,呼吸气流停止或显著减少,造成间歇性低氧血症,引发入睡困难、白天嗜睡及夜间打鼾等症状,长期可导致患者认知功能下降[6]。而肥胖是OSAHS的一项独立危险因素,本次研究数据显示,中重度OSAHS患者组平均BMI显著高于非OSAHS组,同时发现BMI可作为OSAHS的独立危险因素,且随着BMI的升高,AHI指数也明显增大。肥胖会使上气道周围组织发生脂肪沉积,由于管腔缩小和上气道塌陷,导致睡眠呼吸暂停或者通气不足;同时夜间频繁憋醒,正常睡眠结构被干扰,也会引起脂肪代谢障碍,因此,肥胖与OSAHS互为因果。
OSAHS的发病与多种机制有关,包括交感神经系统过度活跃、间歇性缺氧加重氧(IHR)诱发的过度氧化应激、血管内皮功能障碍、代谢紊乱和炎症反应的选择性激活[7]。间歇性低氧(IH)会可促进缺氧诱导因子-1(HIF-1)的产生和核因子-肿瘤坏死因子B通路的激活,从而引发全身炎症反应[8]。另一方面,McCracken等提出肥胖也是一种慢性低度炎症状态[3],Boutens[9]等人研究表明,肥胖与脂肪细胞增大及细胞缺氧有关,后者同样可激活脂肪组织巨噬细胞中的HIF-1,进而促进糖酵解的发生和促炎M1基因的转录从而引发炎症。考虑到缺氧及炎症和肥胖以及OSAHS之间强烈关联,在肥胖患者中识别和评估相关生物标志物可能有助于预测或诊断OSAHS。
中性粒细胞在感染性炎症中参与病原体的清除,在无菌性炎症中发挥重要的组织修复和免疫调节作用,而淋巴细胞参与免疫系统的长期反应[10]。一般来说,在炎症反应过程中,外周血中的中性粒细胞水平升高,淋巴细胞水平下降。NLR则结合了两种不同的免疫途径,是炎症的综合指标,最近已被应用于评价心血管、恶性肿瘤和炎症性疾病的预后[11]。Uygur等[12]研究显示OSAHS的严重程度与NLR值有明确的相关性,OSAHS患者的NLR值明显高于非OSAHS组,且随着AHI的增加,NLR也增加。本次结果与以上研究基本一致,同时我们发现NLR与MSpO2、LSpO2呈现显著的负相关性,这表明NLR可能与机体缺氧程度密切相关,对OSAHS患者病情的严重程度具有一定的评估意义。
另一方面,我们的数据显示网织红细胞系列指标与肥胖患者合并OSAHS密切相关,目前国内外鲜有对于此方面的研究。网织红细胞是介于晚幼红细胞与成熟红细胞之间的过渡细胞,是反映骨髓造血功能的指标。IRF指未成熟网织红细胞占总网织红细胞的百分比,未成熟网织红细胞的RNA含量与常规网织红细胞不同,较网织红细胞计数更早反映骨髓细胞生成状态。在健康人的动态平衡条件下,外周血循环网织红细胞的数量保持相对稳定,然而,在缺氧和溶血等应激状态下,骨髓通过严格调控机制增加红细胞生成率,导致外周循环中网织红细胞计数增加[13]。本次研究中发现重度OSAHS组RET及IRF显著高于非OSAHS组,与AHI呈正相关,与MSaO2呈负相关。IH是OSAHS的基本生理特征,患者血细胞的改变可能是由于低氧环境下产生的HIF可使促红细胞生成素(EPO)产生增加,以提高基础红细胞生成率,同时低氧可使转录辅助因子退变样蛋白4b(VGLL4b)等氧敏感基因表达增加,血红蛋白在红系分化末期产生,而VGLL4b可介导HIF-1α诱导血红素生物合成,获得血红素等血红蛋白合成原料,从而启动红系细胞向网织红细胞的终末分化[14]。在外周血中网织红细胞计数增加的同时,可能还会诱导(谁诱导)未成熟网织红细胞的增加来适当平衡机体红细胞生成速率,从而出现RET与IRF同步升高的现象[15]。我们发现IRF可作为OSAHS的独立预测指标,对严重肥胖患者是否合并OSAHS具有良好的诊断价值。
本研究存在一些不足之处。本研究属于回顾性研究,缺乏其他已建立的如EPO和CRP等缺氧及炎症相关标志物作为比较参考。本研究的样本量较小,非OSAHS组人数偏低,重度组OSAHS较多,这可能与就诊人群均为病态肥胖患者导致合并代谢性疾病可能性较大有关,今后需要更多受试者且结合减重代谢手术术后指标变化来进一步研究。
综上所述,BMI、NLR、RET以及IRF与肥胖合并OSAHS患者病情严重程度密切相关。相比于PSG的复杂昂贵和ESS等睡眠量表的强主观
性,血液学指标简单易得,且能够真实客观地反映机体缺氧程度及炎症状态。且本研究首次将BMI以及血液学指标IRF两者联合用于初步筛查肥胖患者是否合并OSAHS,诊断效果较单一指标效果更佳。因此,联合指标可用于患者减重代谢手术术前OSAHS的常规筛查,以及评估术前OSAHS的病情严重程度和术后随访改善情况,以指导手术前后使用无创呼吸机等辅助治疗,从而降低术中术后手术并发症的发生率,为病人带来更大获益。
