补骨脂素药理作用及肝毒性机制的研究进展
2021-01-05马亚中申宝德杭凌宇袁海龙
杨 阔,高 茸,马亚中,申宝德,杭凌宇,袁海龙*
补骨脂素药理作用及肝毒性机制的研究进展
杨 阔1, 2,高 茸2,马亚中2,申宝德2,杭凌宇1, 2,袁海龙2*
1. 江西中医药大学药学院,江西 南昌 330004 2. 中国人民解放军空军特色医学中心药学部,北京 100142
补骨脂素是源于补骨脂的香豆素成分,具有抗骨质疏松、神经保护、抗肿瘤、雌激素样、抗炎等多重药理作用,有着良好的临床应用潜力。随着对补骨脂用药安全问题的不断关注,近年来关于补骨脂素的肝脏毒性研究也逐渐增多。通过查阅近20年国内外相关文献,对补骨脂素的药理作用和肝毒性研究概况进行整理和总结,为补骨脂素的进一步研究和临床应用提供参考。
补骨脂;补骨脂素;药理作用;肝毒性;作用机制;抗骨质疏松;神经保护;抗肿瘤;雌激素样;抗炎
补骨脂是豆科植物补骨脂L.的干燥成熟果实,具有补肾助阳、纳气平喘、温脾止泻等功效,是青娥丸、壮骨关节丸等经典方剂的重要组成药物[1]。补骨脂素是源于补骨脂中的呋喃香豆素类化合物,也广泛存在于北沙参、防风和独活等中药中[2-4],具有抗肿瘤、神经保护、抗炎、抗氧化等药理活性,可用于治疗类风湿性关节炎、白血病、阿尔茨海默病等疾病。补骨脂和含补骨脂的成方制剂用药过程中产生的肝毒性引发了学者对于补骨脂中毒性成分的关注。补骨脂素含量是补骨脂药材质量控制的限定标准,也是补骨脂水煎液体内吸收的主要活性成分,目前已被证实补骨脂素在长期、大剂量给药情况下可引起大鼠、斑马鱼等动物严重肝损伤。本文对近20年来补骨脂素的药理作用和肝毒性探究进行系统综述,以期为补骨脂素后续研究和临床用药安全提供参考。
1 补骨脂素的药理作用及机制
1.1 抗骨质疏松
骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)是具有增殖和多向分化能力的多潜能干细胞,受相关细胞激素、生长因子和细胞因子调控,可诱导分化为成骨细胞、脂肪细胞、软骨细胞和其他组织细胞[5]。当BMSCs成脂分化能力大于成骨分化时,体内骨形成量降低,形成骨吸收大于骨形成的代谢失衡状态,进一步诱发骨质疏松[6]。补骨脂素能够通过影响骨代谢相关通路,在促进成骨细胞增殖、分化和抑制破骨细胞增殖方面进行骨稳态调控。其中,作用于骨形成相关信号途径有BMP-Smads、Wnt/β-catenin、核因子κB(nuclear factor kappa-B,NF-κB)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、Hedgehog和雌激素信号通路;抑制骨吸收相关信号通路包括丝苏氨酸蛋白激酶(serine-threonine protein kinase,AKT)、激活蛋白-1(activator protein-1,AP-1)、OPG/RANKL/RANK和雌激素通路。除直接作用外,补骨脂素还可通过作用于白细胞介素-1β(interleukin-1β,IL-1β)信号通路来抑制炎症反应引起的骨病变,见表1。
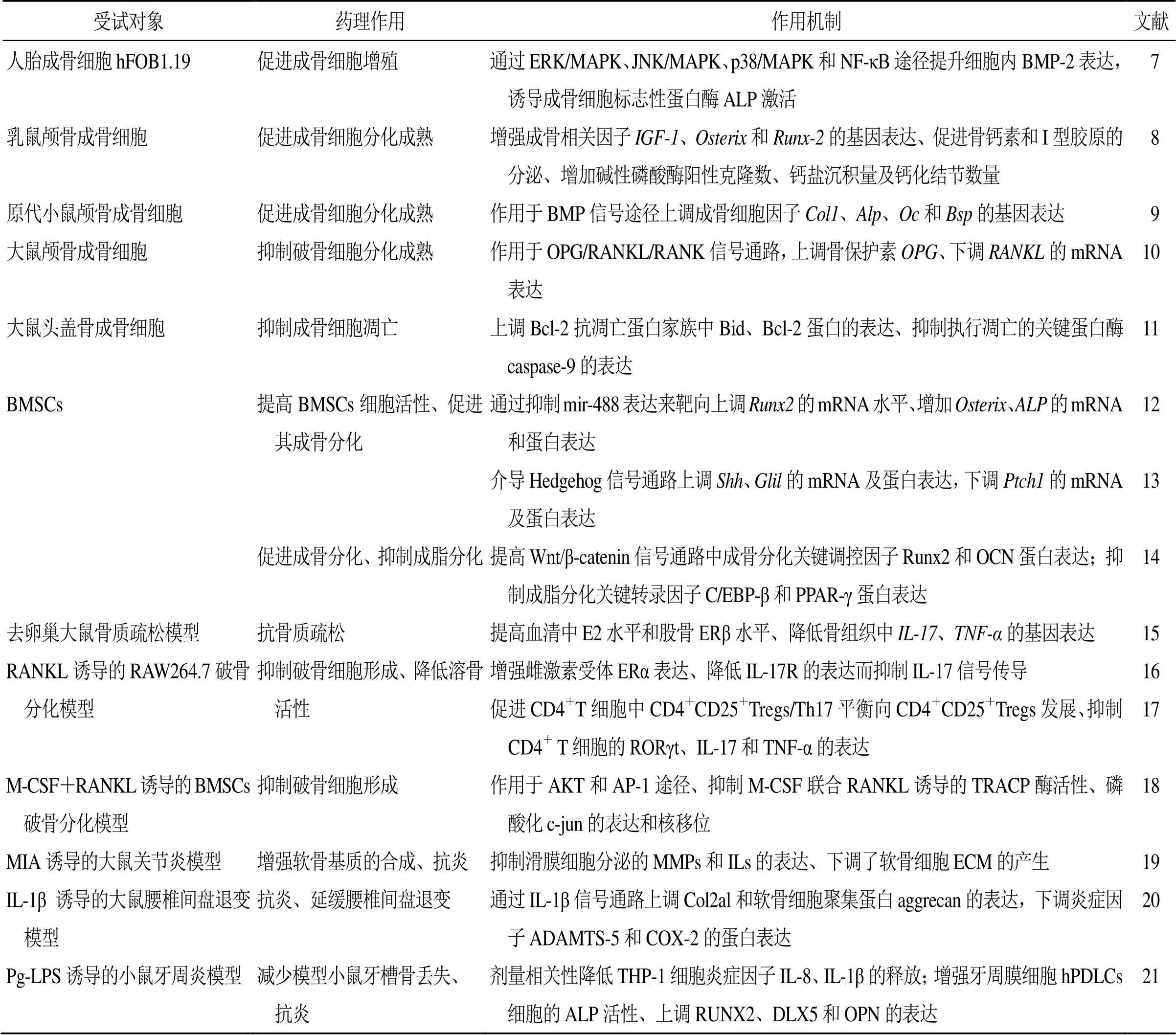
表1 补骨脂素抗骨质疏松的作用及机制
M-CSF-重组人巨噬细胞集落刺激因子 MIA-碘乙酸钠 LPS-脂多糖 BMP-2-重组人骨形态发生蛋白-2 ALP-碱性磷酸酶 Bcl-2-B细胞淋巴瘤-2 Shh-音刺猬因子 Gli1-转录因子锌指蛋白1 PPAR-γ-过氧化物酶增殖受体γ ERβ-雌激素受体β TRACP-抗酒石酸酸性磷酸酶 MMPs-基质金属蛋白酶 ECM-细胞外基质 Col2al-Ⅱ型胶原α1 COX-2-环氧化物酶2 DLX5-远端缺失同源盒5 OPN-骨桥蛋白
M-CSF-recombinant human macrophage colony stimulating factor MIA-sodium iodoacetate LPS-lipopolysaccharide BMP-2-recombinant human bone morphogenetic protein-2 ALP-alkaline phosphatase Bcl-2-B-cell lymphoma-2 Shh-sonic hedgehog Gli1-glioma-associated oncogene homolog1 PPAR-γ-peroxisome proliferator-activated receptor γ ERβ-estrogen receptor TRACP-tartaric acid phosphatase MMPs-matrix metalloproteinases ECM-extracellular matrix Col2al-collagen type ⅡAlpha 1 COX-2-cyclooxygenase-2 DLX5-distal-less homeobox 5 OPN-osteopontin
1.2 神经保护
阿尔茨海默病是一种神经退行性疾病,发病机制暂不明确,主要病理表现为β淀粉样蛋白(β-amyloid protein,Aβ)沉积引发老年斑、Tau蛋白过度磷酸化引发神经纤维缠结。补骨脂素对阿尔茨海默病引发的神经损伤有很好的保护作用,可从抑制Aβ的形成、抗炎、抑制神经细胞凋亡和抗氧化应激等方面发挥治疗作用。补骨脂素能够通过ERβ介导磷酸化的细胞外调节蛋白激酶(p-ERK)信号通路下调β淀粉样前体蛋白、β分泌酶的蛋白表达,减少Aβ的形成和异常沉积[22];以竞争的方式剂量相关性抑制乙酰胆碱酶活性,破坏酶与Aβ肽的相互作用,抑制阿尔茨海默病形成[23];抑制炎症因子、、和的mRNA表达,减缓Aβ1-42诱导的神经炎症损伤;通过MAPK信号通路调控凋亡调节因子Bcl-2/Bax的表达,抑制线粒体中cytochrome C的转出,降低caspase-3、caspase-9表达水平,抑制神经细胞凋亡[24];提高去卵巢痴呆大鼠脑组织海马区超氧化物歧化酶(superoxide dismutase,SOD)氧化酶活性,降低丙二醛(malonaldeehyde,MDA)含量,减少氧化应激引起的神经元损伤,提高认知能力[25]。
1.3 抗肿瘤
补骨脂素具有良好的抗肿瘤作用,能够体外抑制乳腺癌、前列腺癌、肺癌、胃癌、肝癌、白血病等肿瘤细胞,作用机制与抑制肿瘤细胞增殖、抑制肿瘤细胞转移、诱导肿瘤细胞凋亡、抑制肿瘤血管内皮生成、逆转多药耐药多个环节密切相关。近年来,脂质-聚合物杂化纳米颗粒作为药物载体与补骨脂素的结合应用,也从靶向给药治疗和逆转多药耐药方面提高了补骨脂素的抗肿瘤效果[26-28]。补骨脂素的抗肿瘤作用及机制见表2。

表2 补骨脂素的抗肿瘤作用及机制
SMA-平滑肌肌动蛋白
SMA-smooth muscle actin
1.4 抗炎
补骨脂素具有抗炎作用,在类风湿性关节炎、牙周炎、气道炎症和神经炎症模型中均得到验证,抗炎作用与抑制炎症因子的合成、分泌密切相关。张引红等[46]利用类风湿性关节炎小鼠模型探究发现,补骨脂素可显著减少病变处炎性细胞的浸润,减轻足踝的肿胀程度,抑制CD4+细胞向Th1细胞分化,减少IL-6、IL-1β、TNF-α等炎症因子释放。Du等[47]也证实了补骨脂素可通过降低肺部前白细胞介素-1β(pro-interleukin-1β,pro-IL-1β)和转化生长因子β1(transforming growth factor-β1,TGF-β1)的表达,抑制博莱霉素(bleomycin,BLM)刺激引起的小鼠肺实质性炎症,降低炎症性级联反应或呼吸功能障碍。体外细胞实验发现[48],补骨脂素可显著抑制Th2细胞分化关键转录因子GATA结合蛋白3的表达,降低Th2型炎症因子、和的mRNA水平,改善肺组织的炎性浸润和黏液分泌,缓解哮喘大鼠的高反应性和气道炎症。此外,补骨脂素对人牙周膜细胞[49]、RAW264.7细胞[50]、THP-1细胞[21]中炎症因子分泌也有很好的抑制作用。
1.5 雌激素样作用
植物雌激素是存在于植物体中的杂环多酚类化合物,同内源性雌激素一样具有双向调节作用,可根据体内内源性雌激素水平、ER类型和数量发挥协同或拮抗作用[51]。补骨脂素可通过介导ERα或ERβ,作用于拥有雌激素受体的靶器官,如骨骼、生殖系统等,从而发挥雌激素样作用。赵丕文等[52]在培养基中雌激素耗竭的情况下观察到,补骨脂素能够促进ER阳性细胞Ishikawa和T47D细胞增殖,上调T47D细胞中ERα和ERβ的表达,且其诱导效应可被雌激素受体拮抗剂阻断,表明补骨脂素具有类雌激素样作用。此外,补骨脂素还能够提高去卵巢大鼠体内雌激素E2和ERβ水平,从而发挥抗绝经后骨质疏松的治疗作用[15]。
1.6 抗色素沉着
酪氨酸酶是黑色素合成过程中的关键限速酶,可催化底物酪氨酸羟基化形成多巴,多巴进一步氧化后形成黑色素。补骨脂素主要通过抑制酪氨酸酶的活性影响黑色素合成。文献报道,补骨脂素能够作用于p38/MAPK、JNK/MAPK和ERK/MAPK信号通路下调小眼畸形相关转录因子的蛋白表达,抑制酪氨酸酶启动子活性;下调酪氨酸酶、酪氨酸酶相关蛋白-1、酪氨酸酶相关蛋白-2的水平,影响黑色素合成,减缓色素沉着[53-55]。
1.7 抗皮肤光老化
皮肤是人体抵抗紫外线损伤的第1道屏障,长期紫外线照射会引起皮肤角质形成HaCaT细胞、皮肤成纤维ESF-1细胞等的损伤及系列病理变化,造成皮肤光老化。补骨脂素可在抑制HaCaT细胞凋亡、抗氧化、抗炎症反应、促进胶原蛋白形成和抑制胶原蛋白异常降解等方面抵抗皮肤光老化形成,作用机制涉及下调细胞凋亡因子p53、Bcl-2及caspase-3的蛋白表达,降低细胞内活性氧(reactive oxygen species,ROS)水平,抑制中波紫外线诱导的HaCaT细胞凋亡[56];上调抗氧化酶SOD、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和过氧化氢酶活性,下调mRNA水平,减少由活性氧自由基和炎症因子引发的HaCaT细胞损伤[57];上调ESF-1细胞中Ⅰ型胶原蛋白、Ⅲ型胶原蛋白的mRNA水平,促进胶原蛋白合成;上调基质金属蛋白酶抑制剂-1、2的mRNA表达,下调基质金属蛋白酶1的mRNA表达来抑制细胞外基质中胶原蛋白的异常降解,延缓皮肤衰老[58]。
1.8 抗氧化
补骨脂素具有抗氧化能力,可通过增强抗氧化酶SOD、GSH的活性,减少氧自由基含量,降低MDA等过氧化物引起的细胞损伤,减缓氧化应激反应参与的阿尔茨海默病、皮肤光老化、抑郁症等疾病进程。Seo等[59]在H2O2诱导的细胞凋亡模型中发现,补骨脂素能够上调抗氧化酶血红素氧合酶1的mRNA表达,增强GSH-Px和SOD活性,降低细胞内ROS含量,减少氧化应激反应引发的胰腺β细胞凋亡。
1.9 抗纤维化
纤维化是由多种因素引起的ECM代谢异常、成纤维细胞过度增殖分化,致使纤维结缔组织在炎症或受损组织中过度积聚,从而引发器官形态结构改变和功能障碍的一种病理变化[60]。补骨脂素可从抑制炎症进程和纤维化改变方面在肺、肾组织中发挥抗纤维化作用。在BLM诱发的小鼠肺纤维化模型中,补骨脂素能够通过降低BLM诱导的Ⅰ型和Ⅲ型胶原蛋白表达,减少小鼠肺内胶原合成和异常沉积;降低平滑肌肌动蛋白的mRNA表达,抑制成纤维细胞增殖;下调、和的mRNA水平,减少间质组织内炎性细胞浸润[47]。Seo等[61]研究发现,补骨脂素可下调高糖处理的小鼠肾小球系膜MES-13细胞中纤维结合蛋白和凋亡标志基因内皮细胞型纤溶酶原激活物抑制因子(plasminogen activator inhibitor-1,)的mRNA表达水平,保护高糖诱导的系膜细胞损伤。
1.10 其他
研究表明,补骨脂素可体外诱导大鼠胸主动脉血管舒张[62]。瞿晶田等[63]研究发现,补骨脂素能够上调内皮细胞中一氧化氮合酶的蛋白表达,通过作用于内皮细胞依赖的NO途径发挥舒张血管的药理作用;抑制TNF-α诱导的人脐静脉内皮细胞中内皮因子的释放,减缓因内皮因子聚集引起的凝血状态的产生,降低血栓的形成[64]。
此外,补骨脂素还具有减缓肝细胞炎症损伤和抗抑郁的药理作用。补骨脂素对乙酰胆碱酶抑制剂诱导的肝Hep-G2细胞损伤具有保护作用[65]。文献报道,补骨脂素可通过抑制NF-κB活性减少IL-6、TNF-α、IL-8和人单核细胞趋化蛋白1等炎症因子分泌,减缓LO2细胞炎症损伤;下调的mRNA表达,抑制脂肪细胞进一步变性,从而保护棕榈酸诱导的LO2细胞损伤[66]。补骨脂素抗抑郁作用的发挥与其抑制机体氧化应激反应相关。Kong等[67]于2001年首次提出补骨脂素对大鼠脑中线粒体单胺氧化酶活性具有抑制作用,提示其具有治疗情感障碍的潜能。利用抑郁小鼠模型探究发现[68],补骨脂素可通过改善5-羟色胺能和HPA轴系统的异常发挥抗抑郁作用。作用机制涉及逆转被迫游泳实验引起的小鼠额叶皮质和海马组织中5-羟色胺和5-羟基吲哚乙酸的mRNA水平变化;降低被迫游泳实验诱导的小鼠血清促肾上腺皮质激素释放因子和皮质酮浓度的升高,使HPA轴活动正常化。
综上所述,补骨脂素作为补骨脂中的活性成分,具有多样的药理作用。现代药理研究中补骨脂素的抗骨质疏松、抗肿瘤、抗炎和雌激素样等作用与补骨脂的促进骨生长、抗肿瘤、消炎、调节激素水平等药理作用具有一致性,与中药复方中补骨脂治疗妊娠腰痛(通气散)、脚膝肿胀(补骨脂散)等的功效相似。从单味中药和中药复方功效出发,探究中药主成分的潜在药理作用,可为中药药效物质基础和后续开发利用提供思维导向。如破故纸丸中补骨脂可温肾助阳、固精缩尿而治肾气虚冷、小便无度,二神丸中补骨脂可温脾纳气而治脾胃虚弱,全不进食,因此后续可对补骨脂素是否具有治疗尿频、遗精以及消化不良等药理作用进行探究。
2 肝脏毒性机制
肝脏是机体的主要代谢器官也是重要的解毒器官,药物吸收入血后在体内经肝脏进行代谢转化,产生的代谢产物或原型药物本身会对肝脏造成直接或间接的损害。毒理学研究显示,补骨脂素用药引起机体的不良反应涉及生殖系统、免疫系统、神经系统和肝、肾等实质性脏器,尤其对肝脏损伤最为严重[69-70]。补骨脂素引发的肝毒性存在显著种属差异和性别差异,且肝损伤程度具有剂量、时间相关性。动物实验发现,补骨脂素引起的肝损伤具有可逆性,停止给药一段时间后机体可自行恢复[71]。补骨脂素致肝损伤机制并非单一,目前已被证实肝毒性与引起机体胆汁淤积、干扰肝再生、氧化应激反应与线粒体功能障碍、内质网应激反应、抑制肝药酶活性、氨基酸代谢异常相关,补骨脂素肝损伤相关机制见图1。
2.1 胆汁淤积
胆汁酸主要在肝脏中进行合成、代谢,并通过肝细胞基膜和肝细胞膜上的转运体进行运输。肝内胆汁淤积现象是由多种因素引起胆汁酸合成、分泌和转运等过程紊乱导致的,进一步发展通常会导致肝纤维化、肝硬化,甚至肝衰竭。其中,胆汁酸的转运是由肝细胞基底外侧和胆管的转运蛋白如胆盐输出泵(bile salt export pump,BSEP)、多药耐药相关蛋白2(multidrug resistance associated protein 2,MRP2)等共同协作完成。Wang等[72]分别ig ICR小鼠和Wistar大鼠160、40 mg/kg补骨脂素溶液28 d后,小鼠未见肝损伤,但大鼠血清中丙氨酸氨基转移酶、天门冬氨酸氨基转移酶、γ谷酰基转肽酶、总胆汁酸和总胆红素水平升高;病理切片观察到部分肝局灶性坏死,肿大的肝细胞中含有大量胆汁色素和脂质,其中雌性大鼠肝损伤更为严重。提示补骨脂素肝毒性存在种属差异,且更易造成雌性大鼠的肝脏胆汁淤积性损伤。作用机制涉及下调胆汁酸转运体和的mRNA表达,抑制胆汁酸排泄;降低胆汁酸主要代谢酶的mRNA表达,抑制胆汁酸葡萄糖化和硫酸化。

↑表示上调 ↓表示下调
2.2 干扰肝再生
肝脏受损后会激活自身细胞进行补偿性增长以弥补丢失的组织[73]。补骨脂素可通过阻滞细胞周期来抑制细胞的补偿性增殖,降低肝脏自愈能力。雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是多种细胞内和细胞外信号的传感器,能够调节细胞增殖、代谢和细胞周期进程。Zhou等[74]通过2/3肝切除急性肝损伤模型和体外细胞实验发现,补骨脂素能够上调cyclin E1、p27的蛋白表达,降低cyclin D1的蛋白表达,诱导细胞G1/S期阻滞;激活AMPK,剂量相关性地降低AKT和p70S6K的蛋白表达,抑制哺乳动物mTOR信号通路来影响LO2细胞增殖。梁佩诗等[75]通过四氯化碳致小鼠肝损伤模型研究发现,补骨脂素还可以通过上调p27、p21和p53的蛋白表达引起肝细胞G1/S期阻滞。
2.3 氧化应激与线粒体功能障碍
氧化应激是一种体内ROS形成超过细胞抗氧化能力的不平衡状态。转录因子NF-E2相关因子2(nuclear factor erythyroid 2-related factor 2,Nrf2)/ Kelch样环氧氯丙烷相关蛋白-1(Keap1)系统是氧化应激的防御者,当受到外界刺激时,Nrf2与Keap1解离进入细胞核,刺激SOD、谷胱甘肽转移酶等相关抗氧化基因和Ⅱ相解毒酶的转录[76]。文献报道,补骨脂素能够增加斑马鱼幼虫体内的mRNA水平,下调的mRNA表达,显著降低的mRNA水平;剂量相关性抑制SOD活性,引起ROS以及脂质过氧化终产物MDA水平升高[69]。提示补骨脂素诱导斑马鱼肝损伤的分子机制可能是通过产生大量ROS或抑制机体抗氧化系统清除能力,激发氧化应激状态,产生大量自由基和脂质过氧化物,从而引起生物膜损害产生肝损伤。
线粒体是细胞内能量代谢的主要场所,在ATP合成和细胞凋亡等进程中发挥重要作用。补骨脂素能够破坏大鼠肝细胞和LO2细胞线粒体膜完整性,引起ATP合成障碍[74];降低HepG2细胞中ATP含量,增强膜间LDH渗漏性,激活caspase-8和caspase-3,上调CHOP和Bax表达;上调斑马鱼幼虫体内促凋亡蛋白、、、和的基因表达,下调凋亡抑制因子Bcl-2表达,通过线粒体依赖途径诱导细胞凋亡[69]。
2.4 内质网应激反应
内质网能够通过控制蛋白质的合成、折叠和修饰以及钙离子运输来维持细胞内的稳态。未折叠蛋白反应(unfolded protein response,UPR)在恢复内质网稳态过程中发挥重要作用,但持续的内质网应激反应又可通过UPR途径诱导细胞凋亡。UPR通路由双链RNA激活激酶样ER激酶(doublestranded RNA-activated protein kinase like ER kinase,PERK)、肌醇需求酶1(inositol-requiring enzyme 1α,IRE1α)和激活转录因子6(activating transcription factor 6,ATF6)3种传感器蛋白组成。补骨脂素可通过激活内质网应激和UPR通路诱导HepG2细胞凋亡。Yu等[77]研究发现,补骨脂素显著增加了内质网应激相关标记物如、、、和的mRNA表达和转录水平;上调磷酸化和、的mRNA表达,表明补骨脂素激活了内质网应激反应并通过UPR通路诱导细胞凋亡。
2.5 抑制肝药酶活性
细胞色素P450(CYP450)主要分布于肝微粒体中,是药物在肝脏中进行氧化代谢的主要酶系,其中CYP1A2、CYP2C9、CYP2C19、CYP2D6、CYP2E1和CYP3A4 6种亚系参与了90%的药物代谢。部分毒性药物可通过抑制CYP450酶活性来减慢原型药物的代谢转化速率,引起体内毒性药物的蓄积,诱发更为严重的毒性损伤[78]。补骨脂素在肝脏中主要经CYP450酶进行代谢,研究表明,补骨脂素可体外抑制HepaRG细胞和原代人肝细胞中CYP3A4、CYP1A2和CYP2E1酶活性[70,79];性别相关性抑制大小鼠肝中和的mRNA表达[80]。提示补骨脂素可能通过抑制CYP450酶对其降解速率,提高肝脏中补骨脂素的分布量,引发机体肝损伤。
2.6 氨基酸代谢异常
Zhang等[81]采用1H-NMR代谢组学技术结合常规血清生化进行补骨脂素致肝损伤的作用机制探究,结果发现,补骨脂素可引起生物体内氨基酸代谢紊乱,并在血清和肝脏中分别筛选得到7、9种肝损伤潜在生物标志物。对差异代谢物进行通路分析得出,补骨脂素可能是通过干扰缬氨酸、亮氨酸和异亮氨酸在血清和肝脏中的生物合成引起的机体肝损伤。Yu等[71]进一步探究发现,长期给予低剂量补骨脂素会引起雌性大鼠血清中丙氨酸代谢、谷氨酸代谢、尿素循环、葡萄糖-丙氨酸循环、氨循环、甘氨酸和丝氨酸代谢途径的紊乱,提示补骨脂素可能在抑制游离氨基酸合成蛋白质的同时阻止了其作为底物进入糖异生。
3 结语
补骨脂素具有抗骨质疏松、抗肿瘤、抗氧化和神经保护等药理作用[82],在疾病治疗过程中,通常是由多种途径相互影响、共同发挥治疗的作用。因此全面了解补骨脂素药理作用机制,可为其进一步的药理研究和制剂研发提供参考。
伴随补骨脂及其复方制剂用药过程中引起的肝脏毒性报道日益增多,补骨脂肝脏毒性的物质基础也受到学者的广泛关注。现已发现,补骨脂中补骨脂素、异补骨脂素和补骨脂酚具有肝毒性[83]。补骨脂素可通过影响肝再生、胆汁酸平衡、氧化应激和线粒体功能障碍等途径引起肝毒性。补骨脂诱导的肝毒性也表现在机体胆汁淤积、氧化应激反应和肝再生受到影响等方面,提示补骨脂素是补骨脂产生肝毒性的物质基础。建议在优化补骨脂炮制减毒方法的过程中重点关注补骨脂素等兼具药效和毒效的成分含量变化情况,以确保在降低不良反应的同时又能最大程度地发挥其药理作用。
此外,补骨脂素既具有抗氧化的药理作用又可引起机体过氧化应激反应;既能缓解肝脏慢性炎症,抑制炎症推进导致肝纤维化的发生,又能引发机体肝损伤,目前暂未有学者对此现象进行探究。补骨脂素的量-效-毒关系和其对肝脏的保护和损伤双重作用机制等问题仍是其药理毒理研究中待解决的关键问题。
利益冲突 所有作者均声明不存在利益冲突
[1] 鲁亚奇, 张晓, 王金金, 等. 补骨脂化学成分及药理作用研究进展 [J]. 中国实验方剂学杂志, 2019, 25(3): 180-189.
[2] 周璐丽, 曾建国. 独活化学成分及药理活性研究进展 [J]. 中国现代中药, 2019, 21(12): 1739-1748.
[3] 柏桂顺, 王成功, 李江勇, 等. 中药防风活性成分及生理作用研究进展 [J]. 中国民间疗法, 2020, 28(12): 116- 117.
[4] 李彩峰, 伊乐泰, 李旻辉. 北沙参化学成分及影响因素研究进展 [J]. 中药材, 2019, 42(7): 1697-1701.
[5] Mohammadian M, Shamsasenjan K, Lotfi Nezhad P,. Mesenchymal stem cells: New aspect in cell-based regenerative therapy [J]., 2013, 3(2): 433-437.
[6] Brown J P, Dempster D W, Ding B Y,. Bone remodeling in postmenopausal women who discontinued denosumab treatment: Off-treatment biopsy study [J]., 2011, 26(11): 2737-2744.
[7] Li F M, Li Q H, Huang X Q,. Psoralen stimulates osteoblast proliferation through the activation of nuclear factor-κB-mitogen-activated protein kinase signaling [J]., 2017, 14(3): 2385-2391.
[8] 翟远坤, 潘亚磊, 牛银波, 等. 补骨脂素与异补骨脂素对乳鼠颅骨成骨细胞分化成熟影响的比较研究 [J]. 中国药理学通报, 2012, 28(3): 355-360.
[9] Tang D Z, Yang F, Yang Z,. Psoralen stimulates osteoblast differentiation through activation of BMP signaling [J]., 2011, 405(2): 256-261.
[10] 王建华, 郭敏, 郑丽, 等. 补骨脂素干预大鼠成骨细胞骨保护素/核因子κB受体激活因子配体mRNA的表达 [J]. 中国组织工程研究与临床康复, 2010, 14(37): 6927- 6930.
[11] 李颖, 黄宏兴, 白波, 等. 补骨脂素对成骨细胞Caspase-3、8、9蛋白和Bcl-2、Bax、Bid蛋白的调控机制研究 [J]. 中药新药与临床药理, 2017, 28(3): 336- 341.
[12] Huang Y Q, Hou Q K, Su H T,. miR‑488 negatively regulates osteogenic differentiation of bone marrow mesenchymal stem cells induced by psoralen by targeting Runx2 [J]., 2019, 20(4): 3746-3754.
[13] 韩宇, 郭晏华, 于艳. 补骨脂素介导Hedgehog信号通路促进骨髓MSC成骨分化作用研究 [J]. 辽宁中医杂志, 2019, 46(6): 1133-1137.
[14] 张洪跃, 周潘宇, 汪洋, 等. 补骨脂素对大鼠骨髓间充质干细胞成骨及成脂分化的影响 [J]. 现代生物医学进展, 2017, 17(15): 2813-2816.
[15] 杨琳, 曾英, 李劲平, 等. 补骨脂素对去势雌鼠E2、ERβ、TNF-α、IL-17的影响 [J]. 中国骨质疏松杂志, 2016, 22(4): 387-392.
[16] 章文娟, 谢保平, 李伟娟, 等. 补骨脂素抑制破骨细胞形成及其机制的实验研究 [J]. 第三军医大学学报, 2017, 39(7): 641-645.
[17] 李劲平, 谢保平, 章文娟, 等. 补骨脂素通过调控CD4+T细胞分化抑制RAW264.7向破骨细胞分化和骨吸收 [J]. 中国中药杂志, 2018, 43(6): 1228-1234.
[18] Chai L J, Zhou K, Wang S X,. Psoralen and bakuchiol ameliorate M-CSF plus RANKL-induced osteoclast differentiation and bone resorption via inhibition of AKT and AP-1 pathways[J]., 2018, 48(5): 2123-2133.
[19] Wang C L, Al-Ani M K, Sha Y Q,. Psoralen protects chondrocytes, exhibits anti-inflammatory effects on synoviocytes, and attenuates monosodium iodoacetate- induced osteoarthritis [J]., 2019, 15(1): 229- 238.
[20] Yang L, Sun X, Geng X. Effects of psoralen on chondrocyte degeneration in lumbar intervertebral disc of rats [J]., 2015, 28(2): 667-670.
[21] Li X T, Yu C B, Hu Y,. New application of psoralen and angelicin on periodontitis with anti-bacterial, anti-inflammatory, and osteogenesis effects [J]., 2018, 8: 178.
[22] 高海南, 刘斌, 刘国良, 等. 补骨脂素对Aβ损伤PC12细胞的保护作用研究 [J]. 中药材, 2019, 42(1): 174- 177.
[23] Somani G, Kulkarni C, Shinde P,.acetylcholinesterase inhibition by psoralen using molecular docking and enzymatic studies [J]., 2015, 7(1): 32-36.
[24] 王苏雷, 徐运. 补骨脂素调控MAPK信号通路抑制Aβ1-42诱导的神经细胞凋亡及神经炎症 [A] //第十七次全国神经病学学术会议论文集[C]. 厦门: 中华医学会, 2014: 614.
[25] 潘永梅, 王建华, 方敬, 等. 补骨脂素对去卵巢痴呆大鼠脑组织海马区的病理形态学影响 [J]. 中国当代医药, 2016, 23(26): 9-11.
[26] Yuan Y L, Chiba P, Cai T G,. Fabrication of psoralen-loaded lipid-polymer hybrid nanoparticles and their reversal effect on drug resistance of cancer cells [J]., 2018, 40(2): 1055-1063.
[27] Huang Q, Cai T, Li Q,. Preparation of psoralen polymer-lipid hybrid nanoparticles and their reversal of multidrug resistance in MCF-7/ADR cells [J]., 2018, 25(1): 1056-1066.
[28] Yuan Y L, Cai T G, Callaghan R,. Psoralen-loaded lipid-polymer hybrid nanoparticles enhance doxorubicin efficacy in multidrug-resistant HepG2 cells [J]., 2019, 14: 2207-2218.
[29] 李少鹏, 蔡建通, 翁铭芳, 等. 补骨脂素对前列腺癌LNCaP-AI细胞增殖和周期调控及雌激素受体β表达的影响 [J]. 中华细胞与干细胞杂志: 电子版, 2018, 8(1): 1-5.
[30] 赵万忠, 程凯, 王晓红, 等. 补骨脂素对乳腺癌耐药细胞株周期和细胞凋亡的影响 [J]. 中华临床医师杂志: 电子版, 2016, 10(14): 2111-2115.
[31] 翁铭芳. 补骨脂素对前列腺癌PC3细胞株增殖的抑制作用及其机制研究 [D]. 福州: 福建医科大学, 2018.
[32] 刘继新, 高庆剑, 陆铖, 等. 同分异构体补骨脂素和异补骨脂素对HepG2细胞及细胞色素P450酶的影响 [J]. 中国临床药理学杂志, 2014, 30(5): 438-441.
[33] 陈书尚, 翁铭芳, 王水良, 等. 补骨脂素对前列腺癌LNCap-AD细胞增殖的影响及其分子机制研究 [J]. 中华细胞与干细胞杂志: 电子版, 2017, 7(4): 219-223.
[34] Wang X H, Xu C F, Hua Y T,. Psoralen induced cell cycle arrest by modulating Wnt/β-catenin pathway in breast cancer cells [J]., 2018, 8(1): 14001.
[35] 沙新海, 邢广琳, 黄强. 补骨脂素对乳腺癌干细胞的毒性作用及TopoⅡα基因mRNA和蛋白表达水平的影响 [J]. 临床和实验医学杂志, 2019, 18(22): 2397-2400.
[36] 花义同, 王晓红, 许乘凤, 等. 补骨脂素逆转谷胱甘肽- S-转移酶π介导的乳腺癌干细胞耐药性 [J]. 中国组织工程研究, 2017, 21(13): 2003-2008.
[37] Wang X H, Xu C F, Hua Y T,. Exosomes play an important role in the process of psoralen reverse multidrug resistance of breast cancer [J]., 2016, 35(1): 186.
[38] Jiang J R, Wang X H, Cheng K,. Psoralen reverses the P-glycoprotein-mediated multidrug resistance in human breast cancer MCF-7/ADR cells [J]., 2016, 13(6): 4745-4750.
[39] Hsieh M J, Chen M K, Yu Y Y,. Psoralen reverses docetaxel-induced multidrug resistance in A549/D16 human lung cancer cells lines [J]., 2014, 21(7): 970-977.
[40] Jin L, Ma X M, Wang T T,. Psoralen suppresses cisplatin-mediated resistance and induces apoptosis of gastric adenocarcinoma by disruption of the miR196a- HOXB7-HER2 axis [J]., 2020, 12: 2803-2827.
[41] Jiang Z Y, Xiong J. Induction of apoptosis in human hepatocarcinoma SMMC-7721 cellsby psoralen from[J]., 2014, 70(2): 1075-1081.
[42] Wang X M, Peng P K, Pan Z Q,. Psoralen inhibits malignant proliferation and induces apoptosis through triggering endoplasmic reticulum stress in human SMMC7721 hepatoma cells [J]., 2019, 52: 34.
[43] 闫伟伟, 章永红, 刘军楼, 等. 补骨脂素对胃癌细胞株BGC-803增殖和凋亡的影响及其机制 [J]. 吉林中医药, 2015, 35(10): 1064-1067.
[44] Wang X H, Cheng K, Han Y,. Effects of psoralen as an anti-tumor agent in human breast cancer MCF-7/ADR cells [J]., 2016, 39(5): 815-822.
[45] 余绍蕾, 白莉, 蔡宇. 补骨脂素对肿瘤血管内皮细胞抑制作用的实验研究 [J]. 数理医药学杂志, 2013, 26(4): 458-459.
[46] 张引红, 李美宁, 王春芳, 等. 补骨脂素对类风湿性关节炎小鼠模型的免疫调节作用 [J]. 中国实验动物学报, 2017, 25(2): 207-210.
[47] Du M Y, Duan J X, Zhang C Y,. Psoralen attenuates bleomycin-induced pulmonary fibrosis in mice through inhibiting myofibroblast activation and collagen deposition [J]., 2020, 44(1): 98-107.
[48] Jin H L, Wang L M, Xu C Q,. Effects of psoraleae fructus and its major component psoralen on Th2 response in allergic asthma [J]., 2014, 42(3): 665-678.
[49] 李笑甜, 周薇, 宋忠臣. 补骨脂素和异补骨脂素对人牙周膜细胞的抗炎作用 [J]. 上海交通大学学报: 医学版, 2018, 38(2): 128-132.
[50] 柴丽娟, 王安红, 徐金虎, 等. 补骨脂4种组分对LPS诱导的RAW 264.7细胞炎症因子的影响 [J]. 中药新药与临床药理, 2013, 24(4): 360-363.
[51] Liu T, Li N, Yan Y Q,. Recent advances in the anti-aging effects of phytoestrogens on collagen, water content, and oxidative stress [J]., 2020, 34(3): 435-447.
[52] 赵丕文, 牛建昭, 王继峰, 等. 补骨脂素的植物雌激素作用及其机制探讨 [J]. 中国中药杂志, 2008, 33(1): 59- 63.
[53] 崔悦, 单孟瑶, 张丽宏, 等. 补骨脂素对A375细胞黑素合成及ER/MAPK信号通路调控机制探讨 [J]. 中国实验方剂学杂志, 2018, 24(19): 153-158.
[54] 王月莹, 刘斌, 雷双媛, 等. 补骨脂素对A375细胞黑素合成的影响及p38-MAPK信号通路调控机制的研究 [J]. 中药材, 2018, 41(10): 2408-2412.
[55] 王帅, 耿放, 张明磊, 等. 补骨脂素对A375细胞黑素合成及相关细胞信号通路调控的研究 [J]. 中药新药与临床药理, 2014, 25(6): 704-708.
[56] 傅云, 廖建, 王业秋, 等. 补骨脂素对UVB诱导HaCaT细胞凋亡及相关细胞因子表达的影响 [J]. 四川中医, 2019, 37(9): 30-34.
[57] 李建民, 杨柳, 王业秋, 等. 补骨脂素对中波紫外线导致人皮肤HaCaT细胞光老化的保护作用 [J]. 现代生物医学进展, 2017, 17(2): 214-219.
[58] 胡中花, 祁永华, 熊辉, 等. 补骨脂素对人皮肤成纤维细胞衰老相关基因的调控作用 [J]. 中药新药与临床药理, 2015, 26(6): 751-754.
[59] Seo E, Lee E K, Lee C S,.L. seed extract ameliorates streptozotocin-induced diabetes in mice by inhibition of oxidative stress [J]., 2014, 2014: 897296.
[60] Weiskirchen R, Weiskirchen S, Tacke F. Organ and tissue fibrosis: Molecular signals, cellular mechanisms and translational implications [J]., 2019, 65: 2-15.
[61] Seo E, Kang H, Oh Y,.L. seed extract attenuates diabetic nephropathy by inhibiting renal fibrosis and apoptosis in streptozotocin-induced diabetic mice [J]., 2017, 9(8): 828.
[62] Kassahun Gebremeskel A, Wijerathne T D, Kim J H,.extract induces vasodilation in rat arteries through both endothelium-dependent and - iindependent mechanisms involving inhibition of TRPC3channel activity and elaboration of prostaglandin [J]., 2017, 55(1): 2136-2144.
[63] 瞿晶田, 王家龙, 柴士伟, 等. 补骨脂素和补骨脂酚舒张血管的作用机制研究 [J]. 中国药房, 2019, 30(24): 3364-3368.
[64] 钟佩茹, 高秀梅, 陈彤, 等. 补骨脂素对人脐静脉内皮细胞活力及TNF-α诱导组织因子产生的影响 [J]. 辽宁中医杂志, 2012, 39(11): 2247-2249.
[65] Cho H, Jun J Y, Song E K,. Bakuchiol: a hepatoprotective compound ofon tacrine-induced cytotoxicity in Hep G2 cells [J]., 2001, 67(8): 750-751.
[66] 周俪姗, 鄢素琪, 熊小丽, 等. 补骨脂素和异补骨脂素下调NF-κB活性改善LO2细胞脂代谢紊乱的机制研究 [J]. 中国中药杂志, 2019, 44(10): 2118-2123.
[67] Kong L D, Tan R X, Woo A Y H,. Inhibition of rat brain monoamine oxidase activities by psoralen and isopsoralen: Implications for the treatment of affective disorders [J]., 2001, 88(2): 75-80.
[68] Xu Q, Pan Y, Yi L T,. Antidepressant-like effects of psoralen isolated from the seeds ofin the mouse forced swimming test [J]., 2008, 31(6): 1109-1114.
[69] Xia Q, Wei L Y, Zhang Y,. Psoralen induces developmental toxicity in zebrafish embryos/larvae through oxidative stress, apoptosis, and energy metabolism disorder [J]., 2018, 9: 1457.
[70] Wang X, Lou Y J, Wang M X,. Furocoumarins affect hepatic cytochrome P450 and renal organictransporters in mice [J]., 2012, 209(1): 67-77.
[71] Yu Y L, Wang P L, Yu R L,. Long-term exposure of psoralen and isopsoralen induced hepatotoxicity and serum metabolites profiles changes in female rats [J]., 2019, 9(11): E263.
[72] Wang Y, Zhang H, Jiang J M,. Hepatotoxicity induced by psoralen and isopsoralen from: Wistar rats are more vulnerable than ICR mice [J]., 2019, 125: 133-140.
[73] 乔露瑶, 张晓伟. “异常肝再生”的发生机制及其在肝纤维化治疗中的作用[J/OL]. 药学学报, [2020-01-16]. https://doi.org/10.16438/j.0513-4870.2020-0282.html.
[74] Zhou W, Chen X, Zhao G L,. Psoralen induced liver injury by attenuating liver regenerative capability [J]., 2018, 9: 1179.
[75] 梁佩诗, 周旺, 江振洲, 等. 补骨脂素通过延缓肝再生加重四氯化碳所致肝毒性的机制研究 [J]. 中国中药杂志, 2020, 45(12): 2916-2923.
[76] Lee M T, Lin W C, Yu B,. Antioxidant capacity of phytochemicals and their potential effects on oxidative status in animals - A review [J]., 2017, 30(3): 299-308.
[77] Yu Y L, Yu R L, Men W J,. Psoralen induces hepatic toxicity through PERK and ATF6related ER stress pathways in HepG2 cells [J]., 2020, 30(1): 39-47.
[78] 侯健, 孙娥, 宋捷, 等. 肝脏药物代谢酶CYP450与中药肝毒性的关系 [J]. 中国中药杂志, 2016, 41(15): 2774-2780.
[79] Liu Y T, Flynn T J. CYP3A4 inhibition byand its major components in human recombinant enzyme, differentiated human hepatoma HuH-7 and HepaRG cells [J]., 2015, 2: 530- 534.
[80] 王昭昕, 翟玉霞, 于英莉, 等. 补骨脂素对大小鼠肝CYP450酶4种亚型表达的影响 [J]. 中国药理学与毒理学杂志, 2019, 33(9): 733.
[81] Zhang Y, Wang Q, Wang Z X,. A study of NMR- based hepatic and serum metabolomics in a liver injury sprague-dawley rat model induced by psoralen [J]., 2018, 31(9): 852-860.
[82] 陈楠楠, 张晨, 向阳, 等. 补骨脂素加长波紫外线光化学疗法诱导人白血病细胞凋亡时对线粒体膜电位的影响 [J]. 中草药, 2009, 40(2): 252-254.
[83] 白茹玉, 张盼阳, 毕亚男, 等. 补骨脂素和异补骨脂素的急性毒性和相互作用 [J]. 药物评价研究, 2018, 41(6): 1068-1072.
Research progress on mechanism of pharmacological effects and hepatotoxicity of psoralen
YANG Kuo1, 2, GAO Rong2, MA Ya-zhong2, SHEN Bao-de2, HANG Ling-yu1, 2, YUAN Hai-long2
1. College of Pharmacy, Jiangxi University of Traditional Chinese Medicine, Nanchang 330004, China 2. Department of Pharmacy, Air Force Medical Center, PLA, Beijing 100142, China
Psoralen is a coumarin component derived from. It has multiple pharmacological effects, such as anti-osteoporosis, neuroprotective, anti-tumor, estrogen-like, and anti-inflammatory, which has a good application potential in clinic. With the increasing attention paid to the safety of psoralen, studies on liver toxicity caused by psoralen have been graduallyincreasing in recent years. The pharmacological effects and hepatotoxicity of psoralen in the past 20 years were reviewed in this paper, in order to provide reference for the further research and clinical application of psoralen.
L.; psoralen; pharmacological effect; liver toxicity; mechanism of action; anti-osteoporosis; neuroprotective; anti-tumor; estrogen-like; anti-inflammatory
R282.71
A
0253 - 2670(2021)01 - 0289 - 10
10.7501/j.issn.0253-2670.2021.01.034
2020-08-12
国家新药创制重大专项(2016ZX09101073);军队后勤重点项目(BKJ15J005)
杨 阔,硕士研究生,研究方向为中药制剂。Tel: (010)66928506 E-mail: 15270805390@163.com
袁海龙,博士,研究员,博士生导师,研究方向为中药制剂。Tel: (010)66928505 E-mail: yhlpharm@126.com
[责任编辑 崔艳丽]
