人参根和根茎中新的聚乙炔类化学成分
2021-01-05杨秀伟王洪平张友波王英平张连学
杨秀伟,王洪平,张友波,徐 嵬,王英平,张连学
• 化学成分 •
人参根和根茎中新的聚乙炔类化学成分
杨秀伟1,王洪平1,张友波1,徐 嵬1,王英平2,张连学2
1. 北京大学药学院 天然药物及仿生药物国家重点实验室,天然药物学系,北京 100191 2. 吉林农业大学中药材学院,吉林 长春 130118
研究人参根和根茎的聚乙炔类化学成分。采用硅胶、反相HPLC等柱色谱方法进行分离纯化,通过红外、紫外、质谱、核磁共振等谱学数据鉴定化合物的结构。从人参根和根茎的95%乙醇水提取物中分离得到17个聚乙炔类化合物,分别鉴定为人参炔K(1)、人参炔醇(2)、(9)-1-甲氧基-9-十七碳烯-4,6-二炔-3-酮(3)、竹节参炔A(4)、(3,9,10)-人参炔三醇(5)、10-甲氧基十七碳-1,16-二烯-4,6-二炔-3,9-二醇(6)、人参炔A(7)、10-甲氧基十七碳-1-烯-4,6-二炔-3,9-二醇(8)、西洋参炔醇7(9)、9,10-环氧-16-十七碳烯-4,6-二炔-3-醇(10)、人参环氧炔醇(11)、人参炔D(12)、西洋参炔醇4(13)、1-甲氧基-(9,10)-环氧十七碳-4,6-二炔-3-酮(14)、人参炔E(15)、人参炔二醇(16)和人参炔(17)。化合物6和10为新化合物,分别命名为人参炔三醇甲醚(panaxytriol methyl ether)和人参环氧烯炔醇(panaxenydol);化合物4、9和13为首次从人参根和根茎中分离得到。
人参;聚乙炔;10-甲氧基十七碳-1,16-二烯-4,6-二炔-3,9-二醇;人参炔三醇甲醚;9,10-环氧-16-十七碳烯-4,6-二炔- 3-醇;人参环氧烯炔醇
传统中药人参系五加科人参属植物人参C. A. Meyer的干燥根和根茎[1],系驰名中外的大补中药之一,始载于我国历史上第一部记载药物的著作《神农本草经》,列为上品。随着现代分离和分析技术的进步,发现人参的化学成分除了人参皂苷(ginsenosides)外[2-5],还有低极性的聚乙炔类(polyacetylenes)成分[6]。由于聚乙炔类化合物在化学上对光和热具有不稳定性,研究起步较晚,从20世纪60年代中期开始逐步受到重视,中国、日本、韩国等亚洲国家对人参中的聚乙炔醇研究较多。已有生物活性研究证明,人参中的聚乙炔类化合物有抗肿瘤活性[7-9]、神经保护和神经营养[10-12]、抗菌[13]、抗炎[14]、抑制前列腺素降解[15]、预防动脉粥样硬化[16-17]和抗凝[18]等作用。为了继续寻找人参根和根茎中具有生物活性的天然产物,本研究对其聚乙炔类化学成分进行了进一步的研究。从人参根和根茎的95%乙醇水提取物中分离得到17个聚乙炔类化合物,通过IR、UV、MS、1D和2D NMR等谱学手段鉴定了其结构,分别为人参炔K(ginsenoyne K,1)、人参炔醇(panaxynol,2)、(9)-1-甲氧基-9-十七碳烯-4,6-二炔-3-酮 [(9)-1-methoxy- 9-heptadecaen-4,6-diyne-3-one,3]、竹节参炔A(panaxjapyne A,4)、(3,9,10)-人参炔三醇 [(3,9,10)-panaxytriol,5]、10-甲氧基十七碳-1,16-二烯-4,6-二炔-3,9-二醇(10-methoxyheptadeca-1,16- diene-4,6-diyne-3,9-diol,6)、人参炔A(ginsenoyne A,7)、10-甲氧基十七碳-1-烯-4,6-二炔-3,9-二醇(10-methoxyheptadeca-1-ene-4,6-diyne-3,9-diol,8)、西洋参炔醇7(panaquinquecol 7,9)、9,10-环氧-16-十七碳烯-4,6-二炔-3-醇(9,10-epoxy-16- heptadecaene-4,6-diyn-3-ol,10)、人参环氧炔醇(panaxydol,11)、人参炔D(ginsenoyne D,12)、西洋参炔醇4(panaquinquecol 4,13)、1-甲氧基- (9,10)-环氧十七碳-4,6-二炔-3-酮 [1-methoxy- (9,10)-epoxyheptadecan-4,6-diyn-3-one,14]、人参炔E(ginsenoyne E,15)、人参炔二醇(panaxydiol,16)和人参炔(panaxyne,17),化学结构见图1。其中,化合物6和10为新化合物,分别命名为人参炔三醇甲醚(panaxytriol methyl ether)和人参环氧烯炔醇(panaxenydol);化合物4、9和13为首次从人参根和根茎中分离得到。
1 仪器与材料
Autopol III旋光仪(Rudolph Research Analytical,Flanders,NJ,美国);Thermo Nicolet Nexues-470 FT-IR红外光谱仪(Thermo Nicolet,Inc.,Madison,WI,美国),KBr压片;Varian Cary 300型紫外光谱仪(Varian Inc.,Palo Alto,CA,美国);Bruker AV III 400型核磁共振波谱仪(Bruker BioSpin AG Facilities,Fällanden,瑞士),TMS为内标,氘代三氯甲烷为溶剂;Finnigan TRACE 2000 GC-MS(EI-MS;Thermo Finnigan,San Jose,CA,美国);MDS SCIEX API QSTAR型质谱仪(ESI-TOF-MS;Applied Biosystems/MDS Sciex.,Foster,CA,美国);创新通恒LC 3000型半制备高效液相色谱仪,配置P3050型二元泵,UV3000型UV检测器,CXTH-3000工作站;Phenomenex Prodigy ODS柱(250 mm×21.2 mm,10 μm;Phenomenex,Torrance,CA,美国)。
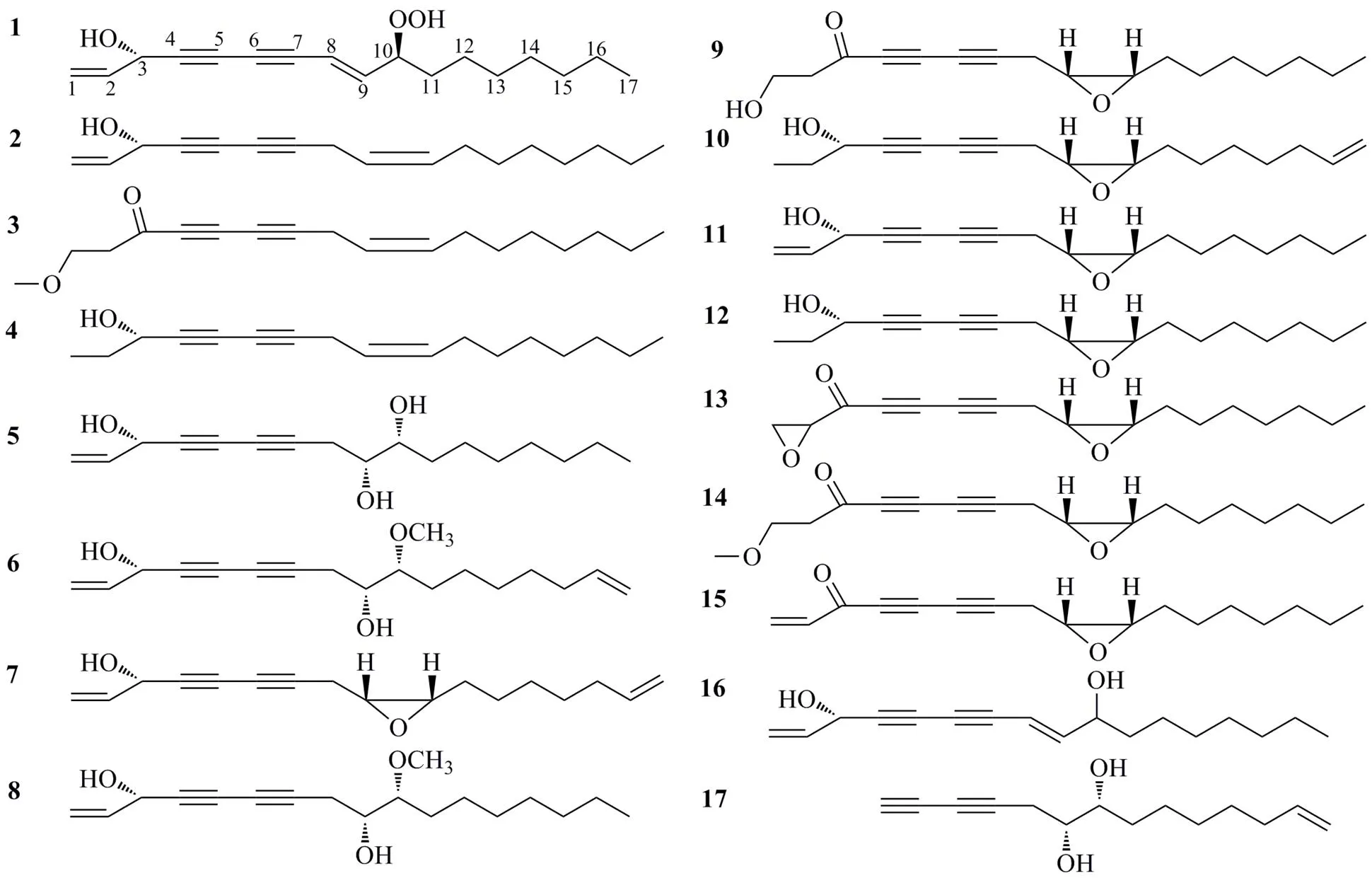
图1 人参根和根茎中聚乙炔类化合物的结构
柱色谱硅胶(200~300目)和GF254薄层色谱(TLC)硅胶为青岛海洋化工厂产品;分析纯环己烷、醋酸乙酯(EtOAc)、乙醇(EtOH)均为北京化工厂产品;色谱纯乙腈为天津西华特种试剂厂产品,水为娃哈哈纯净水,用时经Milli-Q Advantage A10制水机(Millipore,Billerica,美国)处理。
人参药材于2012年9月采自吉林省长白县“人参规范化种植基地”,经北京大学药学院杨秀伟教授鉴定为人参C. A. Meyer的干燥根和根茎,凭证标本(No.201209JLRS)存放在北京大学药学院天然药物及仿生药物国家重点实验室。
2 提取与分离
人参根和根茎粗粉(3 kg),用8倍量的95%乙醇水溶液回流提取6次,第1次2 h,以后每次1 h;合并提取液、浓缩,得干膏450 g(收率为15.0%)。将此干膏混悬于H2O(1.5 L),用环己烷萃取6次,每次环己烷用量为1.5 L;合并环己烷萃取液,减压浓缩,得环己烷萃取物32.0 g(收率为1.07%)和水溶性部分412 g(收率为13.73%)。将上述环己烷萃取物用适量环己烷溶解,经硅胶柱色谱,分别以环己烷、环己烷-醋酸乙酯(20∶1→10∶1→5∶1→2∶1→1∶1)梯度洗脱,TLC检测合并相同组份,共得到12个流分Fr. 1(1.0 g)、Fr. 2(0.8 g)、Fr. 3(13.0 g)、Fr. 4(1.6 g)、Fr. 5(0.9 g)、Fr. 6(1.6 g)、Fr. 7(5.8 g)、Fr. 8(0.5 g)、Fr. 9(1.4 g)、Fr. 10(1.8 g)、Fr. 11(1.6 g)和Fr. 12(0.6 g)。
Fr. 4(1.6 g)经制备型高效液相色谱,乙腈-水(80∶20)洗脱,体积流量为6 mL/min,得到化合物1(R=23.457 min,15.9 mg)、2(R=50.499 min,500.0 mg)、3(R=57.422 min,10.3 mg)和4(R=61.202 min,9.5 mg)。
Fr. 7(5.8 g)经制备型高效液相色谱,乙腈-水(65∶35)洗脱,体积流量为6 mL/min,得到流分Fr. 7-1(1.5 g)、Fr. 7-2(0.9 g)以及化合物5(R=25.327 min,2.2 mg)、6(R=32.021 min,7.8 mg)、11(R=68.040 min,980 mg)、12(R=87.375 min,96.5 mg)、13(R=97.091 min,12.6 mg)、14(R=113.763 min,40.9 mg)、15(R=142.418 min,51.1 mg)。Fr. 7-1(1.5 g)经制备型高效液相色谱,乙腈-水(55∶45)洗脱,体积流量为6 mL/min,得到化合物7(R=26.210 min,24.4 mg)和8(R=28.332 min,43.1 mg)。Fr. 7-2(0.9 g)经制备型高效液相色谱,乙腈-水(55∶45)洗脱,体积流量为6 mL/min,得到化合物9(R=85.583 min,2.3 mg)和10(R=100.068 min,14.4 mg)。
Fr. 8(0.5 g)经制备型高效液相色谱,乙腈-水(80∶20)洗脱,体积流量为6 mL/min,得到化合物16(R=22.848 min,14.0 mg)。
Fr. 12(0.6 g)经制备型高效液相色谱,乙腈-水(80∶20)洗脱,体积流量为6 mL/min,得到化合物17(R=18.962 min,17.9 mg)。
3 结构鉴定
3.1 新化合物的结构鉴定
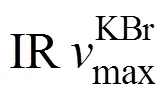

图2 化合物6和10的主要1H-1H COSY和HMBC相关性
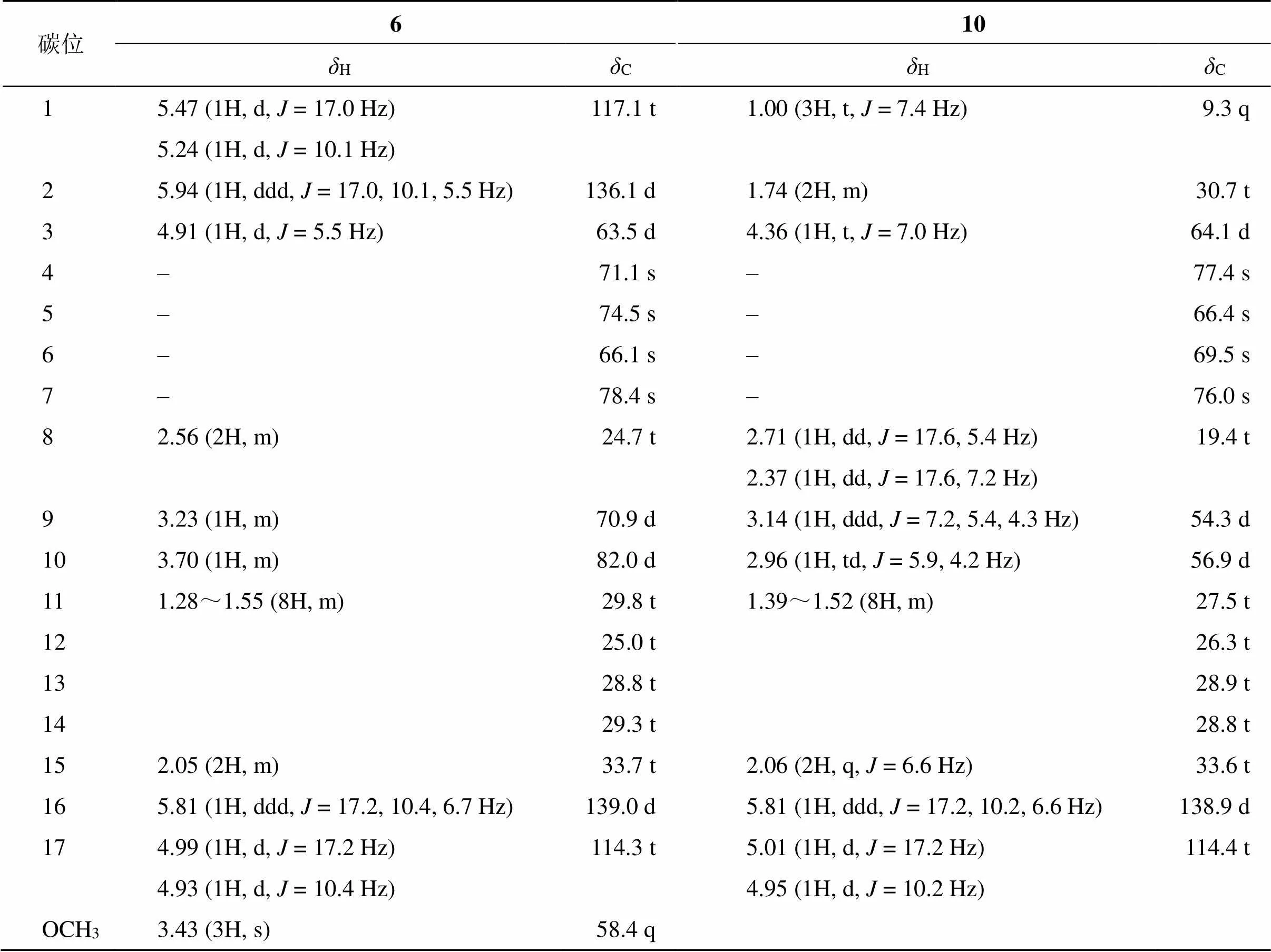
表1 化合物6和10的氢/碳核磁共振波谱数据(400/100 MHz, CDCl3)
3.2 已知化合物的结构鉴定
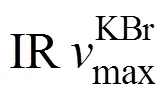
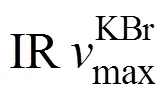
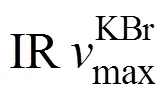
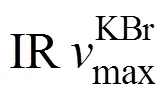
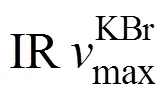
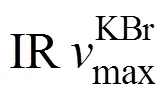
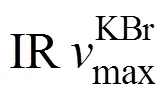
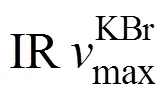
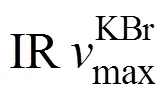
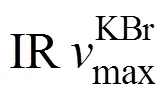
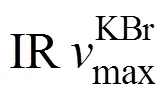
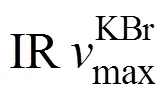
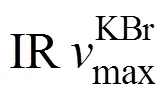
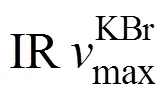
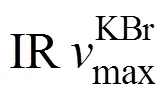
4 讨论
人参中主要生物活性成分为三萜类化合物[4-5],包括原人参二醇型达玛烷皂苷、原人参三醇型达玛烷皂苷和齐墩果烷型皂苷。本研究从人参根和根茎中得到17个聚乙炔类化合物,包括2个新的化合物6和10,以及3个首次从人参中分离得到的聚乙炔类化合物4、9和13,丰富了人参化学成分的多样性,对于人参的合理开发与应用具有一定的指导意义。本研究得到的聚乙炔类化合物绝大多数主链为17个碳,但化合物17为14个碳,比较特殊。最近,从人参中分离得到对乙酰胆碱酯酶具有抑制活性的高人参炔醇(homopanaxynol)和高人参环氧炔醇(homopanaxydol)[31];从野山参中又分离得到1个新的聚炔类化合物,命名为人参炔氧苷A(panaxyneoside A)[32];研究了人参中某些聚炔类化合物结构与过氧化物酶体增殖剂激活受体γ(PPARγ)活化的构效关系[33]。前期本课题组从传统中药白术中得到结构多样性的聚乙炔类化合物,对脂多糖诱导的巨噬细胞炎症反应具有良好的抑制作用[32],人参中这些聚乙炔类化合物的生物活性和构效关系尚需深入研究。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典[S]. 一部. 2020: 8.
[2] Han L F, Sakah K J, Liu L L,. Saponins from roots of[J]., 2014, 6(2): 159-163.
[3] Chen X P, Lin Y P, Hu Y Z,. Phytochemistry, metabolism, and metabolomics of ginseng [J]., 2015, 7(2): 98-108.
[4] 杨秀伟. 人参中三萜类化学成分的研究 [J]. 中国现代中药, 2016, 18(1): 7-15.
[5] 杨秀伟, 富力. 人参中三萜类化学成分的生物学活性和药理学作用 [J]. 中国现代中药, 2016, 18(1): 36-55.
[6] 艾铁民. 中国药用植物志(第七卷) [M]. 北京: 北京大学医学出版社, 2018: 350-355.
[7] Sohn J, Lee C H, Chung D J,. Effect of petroleum ether extract ofroots on proliferation and cell cycle progression of human renal cell carcinoma cells [J]., 1998, 30(1): 47-51.
[8] Moon J, Yu S J, Kim H S,. Induction of G(1) cell cycle arrest and p27(KIP1) increase by panaxydol isolated from[J]., 2000, 59(9):1109-1116.
[9] Guo L C, Song L, Wang Z J,. Panaxydol inhibits the proliferation and induces the differentiation of human hepatocarcinoma cell line HepG2 [J]., 2009, 181(1): 138-143.
[10] 王泽剑, 陆阳, 陈红专. 人参炔醇对大鼠脑片不同类型损伤的影响 [J]. 上海第二医科大学学报, 2003, 23(6): 485-488.
[11] 段贤春, 夏伦祝, 汪永忠, 等. 人参炔醇对氧糖剥夺神经细胞损伤的保护作用 [J]. 中国实验方剂学杂志, 2011, 17(16): 180-183.
[12] 王泽剑, 陈红专, 陆阳. 人参炔醇对神经细胞的营养和保护作用 [J]. 中国药学杂志, 2005, 40(14): 1073-1076.
[13] 林琦, 赵霞, 刘鹏, 等. 三七脂溶性化学成分的研究 [J]. 中草药, 2002, 33(6): 490-492.
[14] Ryu J H, Jang S R, Lee S Y,. Inhibitors of nitric oxide synthesis from ginseng in activated macrophages [J]., 1998, 22: 181-187.
[15] Fujimoto Y, Sakuma S, Komatsu S,. Inhibition of 15-hydroxyprostaglandin dehydrogenase activity in rabbit gastric antral mucosa by panaxynol isolated from oriental medicines [J]., 1998, 50(9): 1075-1078.
[16] Kwon B M, Ro S H, Kim M K,. Polyacetylene analogs, isolated from hairy roots of, inhibit Acyl-CoA: Cholesterol acyltransferase [J]., 1997, 63(6): 552-553.
[17] Alanko J, Kurahashi Y, Yoshimoto T,. Panaxynol, a polyacetylene compound isolated from oriental medicines, inhibits mammalian lipoxygenases [J]., 1994, 48(10): 1979-1981.
[18] Park H J, Rhee M H, Park K M,. Effect of non-saponin fraction fromon cGMP and thromboxane A2 in human platelet aggregation [J]., 1995, 49(3): 157-162.
[19] Ahn B Z, Kim S I. Relation between structure and cytotoxic activity of panaxydol analogs against L1210 cells [J].(Weinheim), 1988, 321(2): 61-63.
[20] Fujimoto Y, Satoh M, Takeuchi N,. Cytotoxic acetylenes from[J]., 1991, 39(2): 521-523.
[21] Yang M C, Seo D S, Choi S U,. Polyacetylenes from the roots of cultivated-wild ginseng and their cytotoxicity[J]., 2008, 31(2): 154-159.
[22] Fujimoto Y, Satoh M, Takeuchi N,. Cytotoxic acetylenes from[J]., 1991, 39(2): 521-523.
[23] Hirakura K, Morita M, Nakajima K,. Polyacetylenes from the roots of[J]., 1991, 30(10): 3327-3333.
[24] Hirakura K, Morita M, Nakajima K,. The constituents of. Part 3. Three acetylenic compounds from roots of[J]., 1992, 31(3): 899-903.
[25] Xu G H, Choo S J, Ryoo I J,. Polyacetylenes from the tissue cultured adventitious roots ofC. A. Meyer [J]., 2008, 14(3): 177-181.
[26] Chan H H, Sun H D, Reddy M V,. Potent alpha-glucosidase inhibitors from the roots ofC. A. Meyer var.[J]., 2010, 71(11/12): 1360-1364.
[27] Fujimoto Y, Wang H C, Satoh M,. Polyacetylenes from[J]., 1994, 35(5): 1255-1257.
[28] Fujimoto Y, Wang H C, Kirisawa M,. Acetylenes from[J]., 1992, 31(10): 3499-3501.
[29] Lee S W, Kim K, Rho M C,. New Polyacetylenes, DGAT inhibitors from the roots of[J]., 2004, 70(3): 197-200.
[30] Shim S C, Chang S K, Hur C W,. A polyacetylenic compound fromroots [J]., 1987, 26(10): 2849-2850.
[31] Murata K, Iida D, Ueno Y,. Novel polyacetylene derivatives and their inhibitory activities on acetylcholinesterase obtained fromroots [J]., 2017, 71(1): 114-122.
[32] 牛雪妮, 罗文, 吕重宁, 等. 野山参中1个新的聚炔类化合物 [J]. 中草药, 2021, 52(1): 23-27.
[33] Resetar M, Liu X, Herdlinger S,. Polyacetylenes fromandrelationship between structure and PPARγ activation [J]., 2020, 83(4): 918-926.
[34] Yao C M, Yang X W. Bioactivity-guided isolation of polyacetylenes with inhibitory activity against NO production in LPS-activated RAW264.7 macrophages from the rhizomes of[J]., 2014, 151(2): 791-799.
New polyacetylenes from roots and rhizomes of
YANG Xiu-wei1, WANG Hong-ping1, ZHANG You-bo1, XU Wei1, WANG Ying-ping2, ZHANG Lian-xue2
1. State Key Laboratory of Natural and Biomimetic Drugs, Department of Natural Medicines, School of Pharmaceutical Sciences, Peking University, Beijing 100191, China 2. College of Chinese Medicinal Materials, Jilin Agricultural University, Changchun 130118, China
To study polyacetylenes in the roots and rhizomes of.Polyacetylenes were separated and purified by repeated column chromatographies on normal and reversed phase silica gels, respectively. Their chemical structures were determined by spectral data analyses of IR, UV, MS and NMR.Seventeen compounds were isolated from 95% ethanolic alcohol aqueous extract of the roots and rhizomes ofand identified as ginsenoyne K (1), panaxynol (2), (9)-1-methoxy-9-heptadecaen-4,6-diyne-3-one (3), panaxjapyne A (4), (3,9,10)-panaxytriol (5), 10-methoxyheptadeca- 1,16-diene-4,6-diyne-3,9-diol (6), ginsenoyne A (7), 10-methoxyheptadeca-1-ene-4,6-diyne-3,9-diol (8), panaquinquecol 7 (9), 9,10-epoxy-16-heptadecaene-4,6-diyn-3-ol (10), panaxydol (11), ginsenoyne D (12), panaquinquecol 4 (13), 1-methoxy-(9,10)- epoxyheptadecan-4,6-diyn-3-one (14), ginsenoyne E (15), panaxydiol (16) and panaxyne (17), respectively.Compounds 6 and 10 are the new ones, which were given the trivial name as panaxytriol methyl ether and panaxenydol, respectively. Compounds 4, 9 and 13 are isolated from the roots and rhizomes offor the first time.
C. A. Meyer; polyacetylenes; 10-methoxyheptadeca-1,16-diene-4,6-diyne-3,9-diol; panaxytriol methyl ether; 9,10-epoxy-16-heptadecaene-4,6-diyn-3-ol; panaxenydol
R284.1
A
0253 - 2670(2021)01 - 0014 - 09
10.7501/j.issn.0253-2670.2021.01.003
2020-11-10
国家自然科学基金资助项目(81973446);国家自然科学基金资助项目(81891011)
杨秀伟(1958—),男,博士,教授,博士生导师,主要从事天然药物化学和药物的ADMET/Act.研究平台建设。Tel: (010)82801569 E-mail: xwyang@bjmu.edu.cn
[责任编辑 王文倩]
