胃癌、肠癌患者凝血参数的应用价值*
2021-01-05陈艳郭俊英高嫣妮陈德东陈燕
陈艳 郭俊英 高嫣妮 陈德东 陈燕
恶性肿瘤是严重威胁我国城镇居民生命健康的主要问题之一,我国前五恶性肿瘤死亡顺位依次为肺癌(26.99%)、肝癌(13.94%)、胃癌(12.45%)、食管癌(8.04%)和结直肠癌(8.00%)等[1]。恶性肿瘤的发生、发展与我国经济的发展和居民饮食结构密切相关,在经济相对落后地区,以胃癌、食管癌、肝癌为主的消化道肿瘤居高,在经济相对发达地区,结直肠癌居高[2]。在我国,部分消化道肿瘤如食管癌、胃癌、肝癌等恶性肿瘤的发病和死亡约占全球的50%,消化道肿瘤已成为严重的公共健康卫生问题。
法国学者Trousseau在18世纪60年代率先提出了恶性肿瘤患者体内存在高凝状态,血栓形成是恶性实体肿瘤最常见的合并症之一,自此,凝血系统以及纤溶系统和肿瘤发生发展关系得到人们的广泛研究[3]。导致肿瘤患者易栓状态的主要因素是肿瘤细胞对血管内皮的破坏,肿瘤患者化疗、感染、手术、输血、激素应用、行动减少或依赖轮椅出行导致血流减缓等均可引起血栓的发生。一方面,肿瘤细胞对组织的侵袭破坏导致血栓形成,另一方面,血栓的形成加剧肿瘤本身的生长、发展和转移,肿瘤性血栓形成成为导致肿瘤患者非肿瘤本身因素死亡的主要原因之一。
当前,针对胃癌、肠癌临床分期特征、化疗及手术与凝血及纤溶指标的相关性分析研究不多,为此笔者通过分析胃癌、肠癌患者血浆中D-二聚体(D-dimer,D-D)、纤维蛋白降解产物(fibrinogen degradation product,FDP)及纤维蛋白单体(fibrin monomer,FM),探究肿瘤患者的凝血状态与临床病理分型、淋巴结受累之间的关系,同时研究在肿瘤患者化疗及手术前后对凝血指标变化的影响,指导临床进行合理的干预和病情监测,现报道如下。
1 资料与方法
1.1 一般资料 收集福建医科大学附属肿瘤医院2016年5月-2019年4月胃癌患者104例(胃癌组),肠癌患者105例(肠癌组);随机选取来自肿瘤医院体检中心健康者40例(健康对照组)。胃癌、肠癌纳入标准:(1)病理学确诊为胃癌、肠癌;(2)初治,以往未进行手术、化疗、放疗治疗。胃癌、肠癌排出标准:(1)既往有其他肿瘤病史,或多种肿瘤并存;(2)有血栓及出血性疾病;(3)2个月内曾使用过影响凝血和/或止血药物;(4)恶性肿瘤已侵犯造血系统,且出现造血功能障碍;(5)合并心、肝、肾等多种脏器功能障碍;(6)近2个月内有活动性出血,或输血史;(7)伴急性炎症反应、糖尿病、妊娠、高血压综合征。此研究已获得院伦理委员会的审批和患者的知情同意。
1.2 标本采集 受试者静脉采血1.8 mL置于含109 mmol/L枸橼酸钠抗凝剂的真空管内,抗凝剂与全血按1︰9比例混匀,3 000 r/min离心15 min,在(20±5)℃的条件下于4 h内完成检测。
1.3 检测方法 采用法国Stago公司STA-R Evolution全自动血凝仪对D-D、FDP及FM含量进行检测,其中D-D、FM检测采用Stago公司原装配套试剂盒,FDP检测采用日本积水试剂盒,FDP、D-D、FM均采用免疫比浊法。各项指标参考值:D-D为0~0.5 μg/mL,FDP为0~5 μg/mL,FM为0~6 μg/mL。
1.4 统计学处理 采用统计学软件SPSS 22.0进行分析处理,计量资料用()表示,两组比较采用独立样本t检验或校正后的t’检验,化疗及手术前后比较采用配对t检验,三组及以上组间比较采用非参数Kruskal-Wallis检验,以P<0.05为差异有统计学意义。
2 结果
2.1 三组一般资料比较 胃癌组104例,男70例,女34例;年龄33~87岁,平均(60.6±9.9)岁;临床分期:Ⅰ~Ⅱ期20例,Ⅲ~Ⅳ期84例;淋巴结受累:N0 16例,N1 12例,N2 18例,N3 58例。肠癌组105例,男64例,女41例;年龄20~78岁,平均(57.0±8.6)岁;临床分期:Ⅰ~Ⅱ期28例,Ⅲ~Ⅳ期77例;淋巴结受累:N0 31例,N1 37例,N2 37例。健康对照组40例,男17例,女23例;年龄30~90岁,平均(49.6±8.1)岁;健康对照组均无糖尿病、高血压等疾病。
2.2 三组D-D、FDP及FM水平比较 胃癌组与健康对照组D-D、FDP、FM比较,差异均有统计学意义(P=0.000、0.000、0.010)。肠癌组与健康对照组D-D、FDP、FM比较,差异均有统计学意义(P=0.022、0.000、0.000)。胃癌组与肠癌组D-D、FM比较,差异均有统计学意义(P=0.026、0.032),两组FDP比较,差异无统计学意义(P=0.979)。见表1。
表1 三组D-D、FDP及FM水平比较[μg/mL,()]

表1 三组D-D、FDP及FM水平比较[μg/mL,()]
2.3 胃癌患者不同淋巴结受累情况D-D、FDP及FM水平比较 N0、N1、N2、N3胃癌患者D-D、FDP及FM水平比较,差异均有统计学意义(P<0.05);N0、N1、N2胃癌患者D-D、FDP及FM水平与N3胃癌患者比较,差异均有统计学意义(P=0.000)。见表2。
表2 不同淋巴结受累情况胃癌患者D-D、FDP及FM水平比较[μg/mL,()]
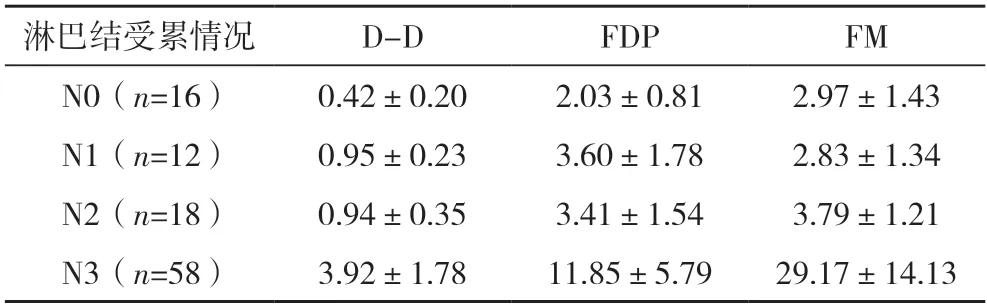
表2 不同淋巴结受累情况胃癌患者D-D、FDP及FM水平比较[μg/mL,()]
2.4 不同淋巴结受累情况肠癌患者D-D、FDP及FM水平比较 N0、N1、N2、N3肠癌患者D-D、FDP及FM水平比较,差异均有统计学意义(P<0.05);N0与N2、N1与N2肠癌患者D-D、FDP及FM水平比较,差异均有统计学意义(P<0.05)。见表3。
表3 不同淋巴结受累情况肠癌患者D-D、FDP及FM水平比较[μg/mL,()]

表3 不同淋巴结受累情况肠癌患者D-D、FDP及FM水平比较[μg/mL,()]
2.5 不同TNM分期胃癌患者D-D、FDP及FM水平比较 Ⅲ~Ⅳ期胃癌患者D-D、FDP及FM水平均明显高于Ⅰ~Ⅱ期胃癌患者,差异均有统计学意义(P<0.05),见表4。
表4 不同TNM分期胃癌患者D-D、FDP及FM水平比较[μg/mL,()]

表4 不同TNM分期胃癌患者D-D、FDP及FM水平比较[μg/mL,()]
2.6 不同TNM分期肠癌患者D-D、FDP及FM水平比较 Ⅲ~Ⅳ期肠癌患者D-D、FDP及FM水平均明显高于Ⅰ~Ⅱ期肠癌患者,差异均有统计学意义(P<0.05),见表5。
表5 不同TNM分期肠癌患者D-D、FDP及FM水平比较[μg/mL,()]

表5 不同TNM分期肠癌患者D-D、FDP及FM水平比较[μg/mL,()]
2.7 化疗前后凝血指标变化比较 在采取相同或类似化疗方案下,17例胃癌、肠癌患者化疗后D-D、FM水平均较化疗前升高,差异均有统计学意义(P<0.05);化疗后FDP水平较化疗前略升高,但差异无统计学意义(P>0.05)。见表6。
表6 17例胃癌、肠癌患者化疗前后D-D、FDP及FM水平比较[μg/mL,()]
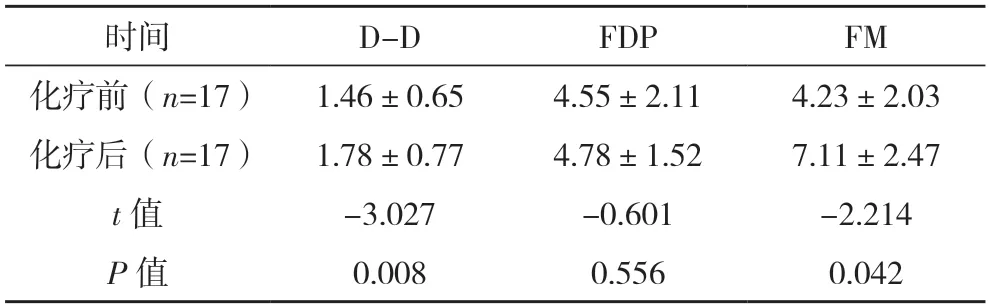
表6 17例胃癌、肠癌患者化疗前后D-D、FDP及FM水平比较[μg/mL,()]
2.8 手术前后凝血指标变化比较 在采取相同或类似手术方案下,14例胃癌、肠癌患者术后D-D、FDP、FM均较术前明显升高,差异均有统计学意义(P=0.000),见表7。
表7 14例胃癌、肠癌患者手术前后D-D、FDP及FM水平比较[μg/mL,()]

表7 14例胃癌、肠癌患者手术前后D-D、FDP及FM水平比较[μg/mL,()]
2.9 各凝血指标间相关性分析 将173例胃癌、肠癌患者D-D、FDP与FM阳性结果进行比较,其中存在理论依据占79.19%,不存在理论依据占20.81%,见表8。
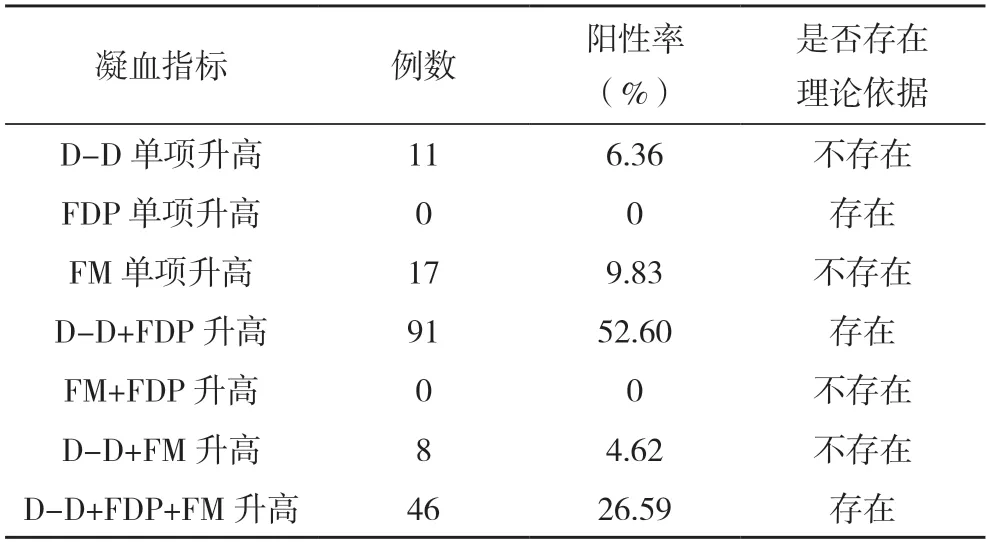
表8 173例胃癌、肠癌患者D-D、FDP与FM阳性结果分析
3 讨论
3.1 胃癌、肠癌患者的凝血改变 D-二聚体(D-D)是筛查与辅助诊断血栓性疾病常用项目,纤溶酶作用下降解交联纤维蛋白所生成的降解产物,血浆D-D水平升高标志患者凝血酶及纤溶酶活性增强,反应凝血系统及纤溶系统处于激活状态[4]。本次研究发现,胃癌组、肠癌组D-D水平均显著高于健康对照组(P<0.05),说明患者机体处于凝血及纤溶亢进状态。血浆D-D水平明显升高是由疾病导致的血管内皮细胞损伤或肿瘤细胞释放促凝物质激活凝血级联反应所致[5],D-D含量增高的程度与肿瘤细胞对机体损伤程度成正相关,并与肿瘤患者预后相关[6-7]。Diao等[8]认为D-D水平的升高与晚期肿瘤患者临床分期、淋巴结受累及是否转移情况密切相关,这与本次研究发现一致。
纤维蛋白降解产物(FDP)是FIB在纤溶酶的溶解下所形成各种降解碎片及复合物产物的总称,可用于评价机体纤溶系统活性,临床上常与D-D联合检测,以此共同反应凝血系统和纤溶系统状态[9]。本研究发现胃癌组、肠癌组FDP水平均显著高于健康对照组(P<0.05),这与文献[10-11]研究FDP在发生肝转移胃癌以及肝转移肠癌癌患者中明显高于未转移患者相一致。因此FDP的检测亦有助于了解胃癌、肠癌等恶性肿瘤发生、发展及预后的凝血及纤溶激活状态。
纤维蛋白单体(FM)是由凝血酶的作用下,FIB裂解其Aα 链和Bβ 链,产生可溶性的纤维蛋白单体(SFMs),SFMs与FIB结合形成可溶性纤维蛋白单体复合物(SFMCs),SFMCs在ΧⅢ因子的作用下交联聚合,生成血栓,FM反应的是凝血酶的活性,在血栓形成过程中优先于D-D生成[12]。Biggerstaff等[13]认为FM增强血小板与肿瘤细胞的粘附,并可能有助于肿瘤细胞的转移。本研究发现,胃癌组、肠癌组FM与D-D、FDP一样,均显著高于健康对照组(P<0.05)。FM的异常升高能更好地反映肿瘤患者早期的高凝状态,通过与D-D、FDP的联合检测,可有效指导临床的抗凝治疗,提高患者生存率。
3.2 化疗前后凝血改变 胃癌、肠癌主要以化疗为主。化疗后发现胃癌、肠癌患者D-D、FM水平较化疗前明显升高。化疗药物对肿瘤细胞杀伤使其破坏裂解并释放出促凝物质,引发体内凝血系统功能亢进[14],加剧肿瘤患者血液的高凝状态,促进凝血酶活性。此外,本研究结果表明,化疗后FDP较化疗前略升高,但差异无统计学意义(P>0.05)。FDP升高不显著原因可能是化疗药物抑制机体的纤溶功能[15],使其未完全激活,纤维蛋白无法完全降解,再加上项目检测的敏感性存在差异,故FDP的反应优势劣于D-D、FM。因此得出结论,化疗后的肿瘤患者机体处于不同程度高凝状态,且纤溶功能受化疗药物抑制,患者血栓形成的风险加剧。有国外学者提出抗肿瘤治疗与抗凝治疗相结合,对延长患者生存期有一定帮助[16]。故化疗后患者要严密监测患者凝血指标,并及时处理。
3.3 手术前后凝血改变 手术是根治胃癌、肠癌方式之一,但手术对机体损伤巨大,同时对凝血功能也有一定影响。本研究发现,胃癌、肠癌患者术后FDP、D-D及FM水平均较术前显著升高(P<0.05)。表明手术对机体造成的损伤使得机体不同程度发生凝血激活及纤溶亢进,因此手术前后均应密切关注患者的血栓与出血倾向,做好预防并及时采取有效措施。
3.4 各指标的相关性 笔者认为,人体内凝血及纤溶系统保持着动态平衡,当其中一系统被激活,另一系统亦同时激活,不存在先后顺序,故各指标间亦有一定关联性。例如,FM不会独立于D-D、FDP出现异常,人体内不会仅出现凝血激活而不出现纤溶激活,或凝血激活早于纤溶激活;而D-D也不该单独出现大幅升高,若患者出现纤溶激活,FDP亦该异常。立足于理论,排除部分试剂敏感性差异,笔者做了如上统计,发现在所有的阳性结果中仍可能存在超过五分之一无理论支撑的假阳性结果,故笔者认为应采用多项目动态联合检测以提高检测的准确性,在检验数据审核过程合理分析项目的相关性,做好临床沟通,使其更有效服务于临床。
