p-STAT3/p-AKT信号通路及其靶基因CyclinD1在基底细胞癌皮损中的表达及其临床意义
2020-12-31任双双
任双双,邓 玉
基底细胞癌(basal cell carcinoma,BCC)是起源于表皮及其附近基底细胞的皮肤肿瘤疾病,既往多见于男性,发病年龄60~70岁,但近年流行病学报道显示年轻女性BCC发病率也有增高趋势[1-2]。当前临床依据BCC的镜下表现将其分为非侵袭性基底细胞癌(non-invasive basal cell carcinoma,NIBCC)与侵袭性基底细胞癌(invasive basal cell carcinoma,IBCC),前者包括结节型、浅表型;后者则包括微结节型、浸润型、硬斑病型及混合型[3]。NIBCC发展缓慢、破坏程度小,转移风险低,呈良性;而IBCC病变范围虽较局限性,但可造成组织结构破坏,且易复发[4]。研究报道,BCC进展涉及多个癌基因及抑癌基因失活[5]。磷酸化转录信号转导子及激活子3(phosphorylated signal transducersand activators of transcription 3,p-STAT3)/磷酸化蛋白激酶B(phosphorylated protein kinase B,p-AKT)是经典的信号转导通路,细胞周期素D1(cyclinD1)则是其靶基因[6]。研究证实,p-STAT3、p-AKT、cyclinD1在肾细胞癌[7]、胃癌[8]、弥漫性大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)[9]等多种皮肤肿瘤病变处存在高表达现象,但其在BCC中的临床报道相对少见。基于此,本研究拟通过回顾性分析探究p-STAT3/p-AKT信号通路及其靶基因CyclinD1在基底细胞癌皮损中的表达及其临床意义。
1 材料与方法
1.1 研究对象 选取石蜡标本为2010年1月-2019年8月在山东省济南市人民医院皮肤科就诊且经组织病理及免疫组化确诊BCC患者,共60例,纳入BCC组。其中,男27例,女33例;年龄31~85岁;头面部皮损49例,躯干皮损7例,四肢皮损4例;均为单发;皮损面积0.2 cm×0.3 cm~6.0 cm×7.0 cm;NIBCC 43例(浅表性20例、结节溃疡型23例),IBCC 17例(浸润型9例、硬斑病型6例、混合型2例)。另选取26例正常皮肤组织作为对照组,均为同期在本院接受外科整形手术时切除的多余皮肤组织,男16例,女10例;年龄31~66岁。两组一般资料差异无统计学意义(P>0.05)。
1.2 纳入与排除标准 纳入标准:①接受皮肤肿物切除手术患者;②有明确术后诊断结果;③均为初发皮肤肿物,既往未针对皮肤肿物进行治疗;④均接受p-STAT3、p-AKT、CyclinD1蛋白及基因检测。排除标准:①病案资料缺失;②未留存病理组织,不能满足研究需求。
1.3 方法
1.3.1 仪器与试剂 p-STAT3、p-AKT及cyclinD1兔多克隆抗体购自基尔顿生物科技(上海)有限公司;SP Kit试剂盒、DAB显色剂均购自中科瑞泰(北京)生物科技有限公司;Trizol试剂盒、RT-PCR试剂盒、DL 2000DNA Marker购自上海恒远生物科技有限公司;3C15K高速冷冻离心机购自美国Sigma公司;多功能电泳仪、转印电泳槽购自北京六一仪器厂;ChampGelTM5500全自动凝胶成像仪及分析系统购自上海帝博思生物科技有限公司722分光光度计购自上海光学仪器厂;-80 ℃深低温冰箱购自日本SANYO公司;PCR仪购自德国Biomentra Ⅱ型;UV-3000紫外分光光度计购自日本岛津公司。
1.3.2 免疫组化(SP)法 取冰箱冻存的组织切片进行烤片,严格参照SP试剂盒操作依次二甲苯脱蜡,内源性过氧化物酶修复抗原,封闭,滴加一抗、二抗,滴加链霉素过氧化物酶室温孵育,DAB染色,苏木素复染、脱水、透明及封片;均严格参照SP试剂盒操作,磷酸缓冲盐溶液(phosphate buffer saline,PBS)代替一抗作为阴性对照。Image-ProPlus6.0彩色分析系统在200倍视野下随机选取5个视野,测量阳性细胞的平均光密度值,取均值为最终结果。阳性判定标准:采用半定量分析,Image-ProPlus6.0彩色分析系统在200倍视野下随机选取5个视野,计算阳性细胞百分比,将阳性细胞着色数按<5%、5%~25%、26%~50%、51%~75%、76%~100%分别对应0分、1分、2分、3分、4分、5分;将阳性着色强度按无色、淡黄色、棕黄色、棕褐色对应0分、1分、2分、3分;评分=着色细胞百分率得分×着色程度得分,0分为阴性(-)、1~4分为弱阳性(+)、5~8分为阳性(++)、9~12分为强阳性(+++)。
1.3.3 PCR法 Tzirol法抽提RNA,计算RNA浓度;参照试剂盒逆转录合成cDNA,反应条件:30 ℃,10 min、42 ℃,30 min、99 ℃,5 min、4 ℃,5 min,35个循环;PCR扩增反应后将PCR反应产物电泳,凝胶成像仪成像并保存;Scion Image 软件对电泳条带进行灰度扫描,以β-actin半定量分析p-STAT3 mRNA、p-AKTmRNA、cyclinD1 mRNA;所有步骤均严格参照试剂盒说明书。

表1 引物序列
1.3.4 Western印迹实验 参照试剂盒提取细胞总蛋白样品,Larry法定量后稀释呈相同浓度后加入5×样品缓冲液,沸水水浴5 min,-20 ℃冰箱保存,取20 μL蛋白上样、电泳;孵育p-STAT3/p-AKT/cyclinD1、抗β-actin单克隆抗体,加碱性磷酸酶标记的相应二抗,凝胶成像仪成像;Scion Image软件对蛋白产物条带进行灰度扫描,获得对应蛋白灰度值,以β-actin蛋白作为内参照,半定量分析p-STAT3/p-AKT/cyclinD1蛋白相对表达量。

2 结果
2.1 两组患者p-STAT3、p-AKT、cyclinD1免疫组化比较 p-STAT3、cyclinD1阳性主要表达于细胞核,p-AKT阳性表达则主要位于细胞浆;BCC细胞及浸润至真皮内的细胞核均可见p-STAT3、cyclinD1阳性表达,对照组表皮基底细胞则可见p-STAT3、cyclinD1弱阳性表达;BCC组细胞及浸润至真皮内的细胞浆均可见p-AKT阳性表达,对照组表皮基底细胞则可见p-AKT弱阳性表达;BCC组p-STAT3、p-AKT、cyclinD1平均光密度值均显著高于对照组,差异有统计学意义(P<0.05),图1、图2。
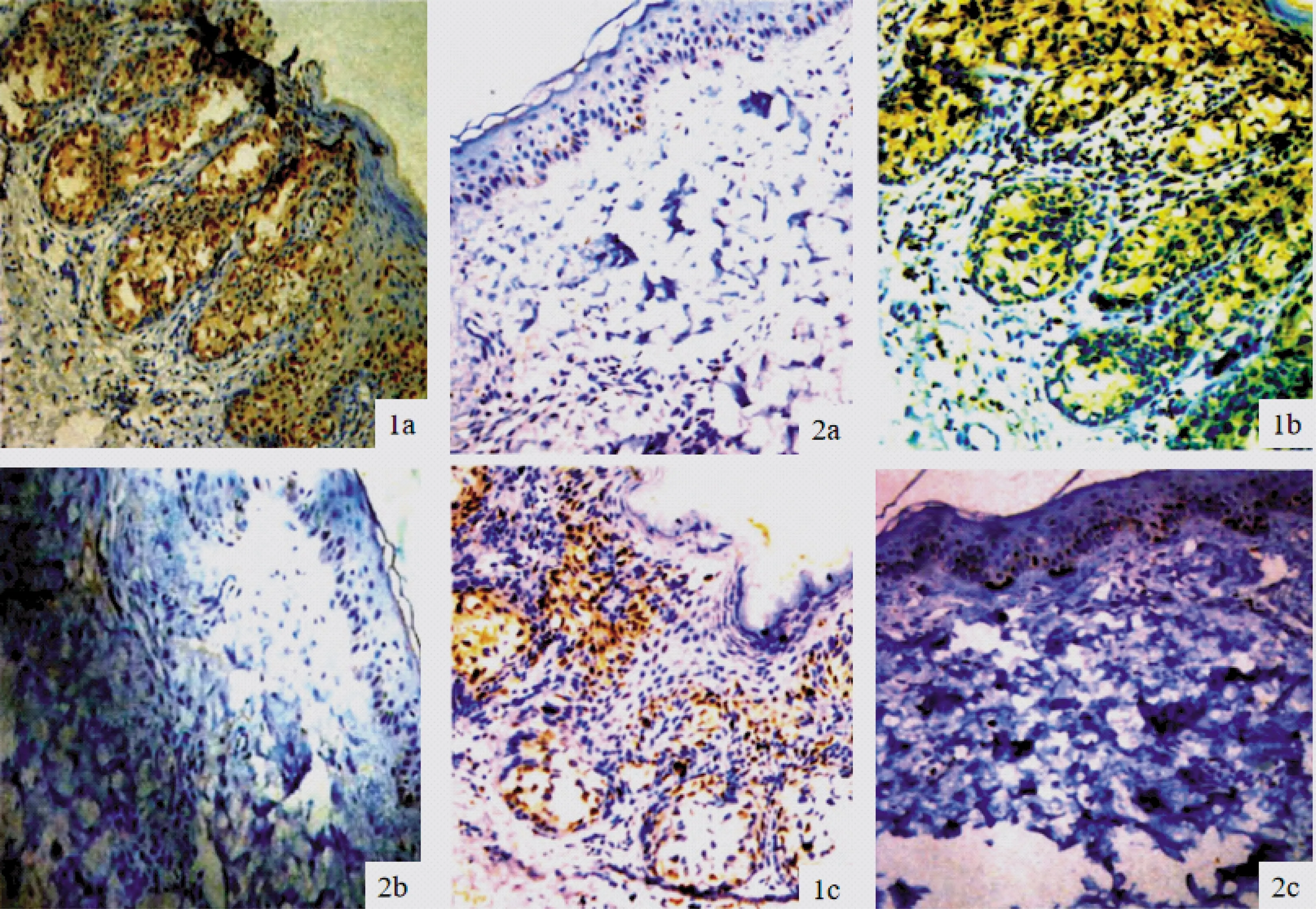
图1 p-STAT3、p-AKT、cyclinD1免疫组化图(×200倍)
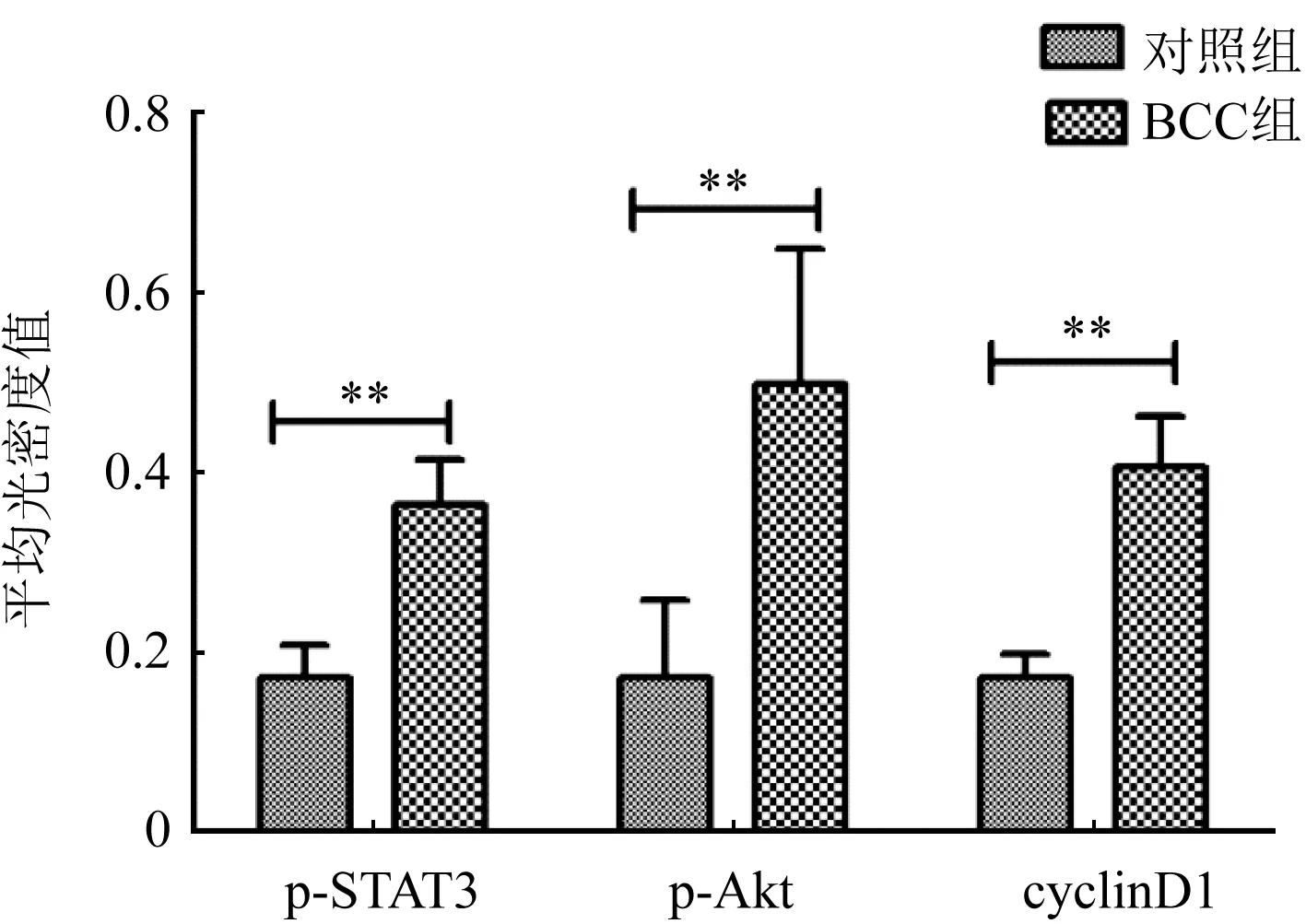
图2 p-STAT3、p-AKT、cyclinD1平均光密度值
2.2 两组患者p-STAT3 mRNA、p-AKTmRNA、cyclinD1 mRNA比较 BCC组p-STAT3 mRNA、p-AKTmRNA、cyclinD1 mRNA表达显著高于对照组,差异有统计学意义(P<0.05),图3。
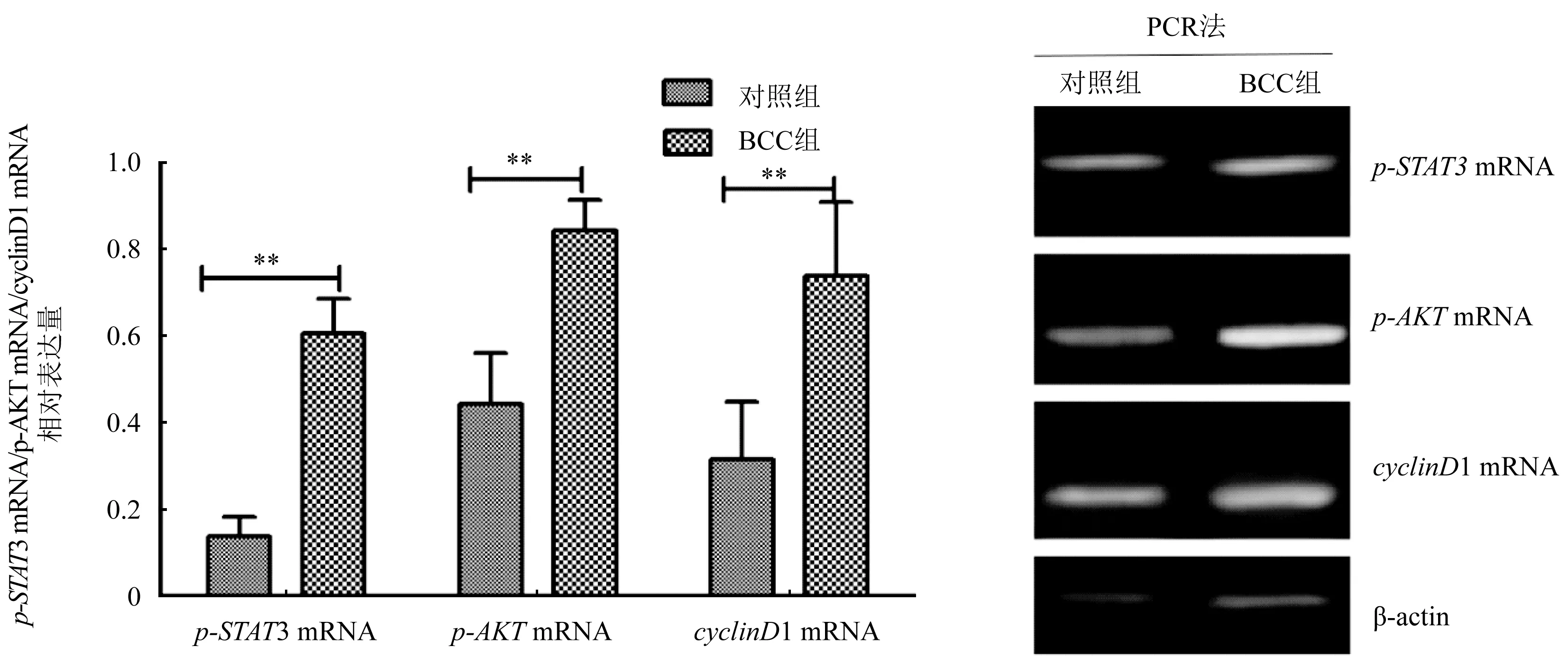
图3 p-STAT3 mRNA、p-AKT mRNA、cyclinD1 mRNA表达
2.3 两组患者p-STAT3蛋白、p-AKT蛋白、cyclinD1蛋白表达比较 BCC组p-STAT3蛋白、p-AKT蛋白、cyclinD1蛋白表达显著高于对照组,差异有统计学意义(P<0.05),图4。
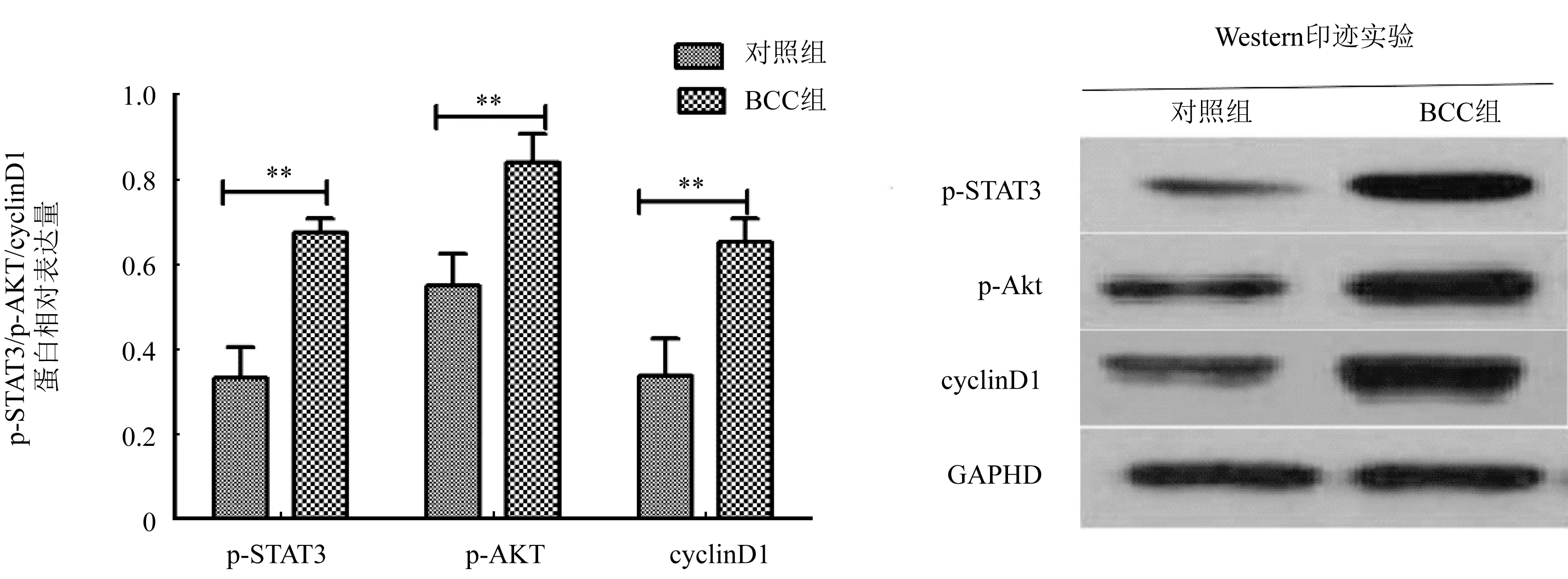
图4 p-STAT3蛋白、p-AKT蛋白、cyclinD1蛋白表达-Western印迹实验
2.4 BCC皮损中p-STAT3 mRNA、p-AKTmRNA、cyclinD1 mRNA表达的临床意义 不同性别、年龄、肿瘤直径的BCC患者皮损中p-STAT3 mRNA、p-AKTmRNA、cyclinD1 mRNA表达差异无统计学意义(P>0.05),但IBCC型BCC患者皮损中p-STAT3 mRNA、p-AKTmRNA、cyclinD1 mRNA表达显著高于NIBCC患者,差异有统计学意义(P<0.05),表2。
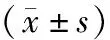
表2 BCC皮损中p-STAT3 mRNA、p-AKT mRNA、cyclinD1 mRNA的表达
2.5 BCC皮损中p-STAT3 mRNA、p-AKTmRNA、cyclinD1 mRNA表达与病理分型的关系 经Spearman相关性分析,BCC皮损中p-STAT3 mRNA、p-AKTmRNA、cyclinD1 mRNA表达与病理类型有显著相关性(r=0.723、0.612、0.375,均P<0.01。)
3 讨论
BCC发病率近年来有上升趋势,其虽发病缓慢、恶性程度、转移率及死亡率均较低,但极大危害公共健康[10]。当前BBC的病因仍未完善阐明,一般认为日光、紫外线、放射线、遗传因素等均可诱导BCC的发生。基于现代分子生物学探究BCC的生物学行为并探索有效的防治方案已成为临床研究热点。p-STAT3/p-AKT是经典的信号通路,与肿瘤的发生、发展密切相关。其中STAT3是作为细胞内潜在的核转录因子,也是信号转导与转录激活因子家族(STATs)成员之一,其所参与的信号转导通路途径持续激活后便可直接或间接促进细胞异常增殖,诱导抗凋亡最终导致细胞恶性转化[11]。而活化的STAT3(p-STAT3)又直接作用于细胞内特异的DNA结合位点,调控下游靶基因表达,参与肿瘤细胞形成、生长、凋亡抑制等过程。研究证实,p-STAT3在多种肿瘤组织与细胞系中均存在异常表达或活性增强现象。温立霞等[12]指出,STAT3可促进皮肤恶性黑色素瘤的发生、浸润及淋巴转移,并可能与其靶基因cyclinD1间存在一定协同作用关系。AKT则是人类潜在的癌基因,既往研究也证实在多数肿瘤疾病中均存在p-AKT基因扩增现象,如甲状腺癌、子宫内膜癌、前列腺癌等均有p-AKT持续异常高表达[13]。
cyclinD1是G1期主要调控蛋白,也是正调控因子cyclins蛋白家族的重要成员,可结合并激活CDK4或CDK6形成复合物,在细胞周期G1/S期转变中发挥关键作用。当STAT3被上游相关信号激活后磷酸化,并形成二聚体;也可与STAT3的其他成员形成异质二聚体,激活的STAT3复合物移位到细胞核中便可开始启动STAT3目的基因,cyclinD1便是p-STAT3靶基因之一[14]。cyclinD1过表达意味着细胞持续增殖、细胞失控性生长。研究报道,在cyclinD1过表达的细胞中,即使无生长因子存在,细胞也持续增殖,其是促癌变的基因,cyclinD1也已被确定为原癌基因[15]。既往已有研究证实,cyclinD1在乳腺癌、甲状腺癌等肿瘤疾病中存在基因扩张或蛋白高表达,并已被确定是原癌基因[16]。本研究显示,BCC皮损处p-STAT3、cyclinD1阳性主要表达于细胞核,p-AKT阳性表达则主要位于细胞浆;BCC细胞及浸润至真皮内的细胞核均可见p-STAT3、cyclinD1阳性表达,但正常人表皮基底细胞p-STAT3、cyclinD1则呈弱阳性表达;且BCC细胞及浸润至真皮内的细胞浆均可见p-AKT阳性表达,正常人表皮基底细胞则可见p-AKT弱阳性表达;BCC组p-STAT3、p-AKT、cyclinD1平均光密度值均显著高于对照组;且BCC组p-STAT3蛋白、p-AKT蛋白、cyclinD1蛋白表达及p-STAT3 mRNA、p-AKTmRNA、cyclinD1 mRNA表达显著高于对照组。这与但翠娟等[17]的报道结论相似,均提示p-STAT3、p-AKT、cyclinD1异常表达与表皮恶性肿瘤的发生存在关联。
IBCC型BCC患者皮损中p-STAT3 mRNA、p-AKTmRNA、cyclinD1 mRNA表达显著高于NIBCC患者,差异有统计学意义;p-STAT3 mRNA、p-AKTmRNA、cyclinD1 mRNA更高表达的BCC患者或具更高的恶性程度,治疗后复发风险更高,应引起临床重视。但本研究也存在一定局限性,为回顾性分析,在临床资料采集上存在一定局限性,无随访资料,拟在下阶段研究中采集更大样本量后进一步探究p-STAT3、p-AKT、cyclinD1在BCC皮损处的表达及其临床意义,尤其是与BCC远期预后的关系。
综上所述,p-STAT3、p-AKT、cyclinD1在BCC皮损处存在异常高表达现象,且IBCC型BCC患者皮损处p-STAT3 mRNA、p-AKTmRNA、cyclinD1 mRNA表达更高,p-STAT3 mRNA、p-AKTmRNA、cyclinD1 mRNA表达或与BCC复发有一定关联,仍有待下阶段研究中证实。
