低体重婴幼儿危重先心病合并肺部感染的外科治疗
2020-12-31李小兵黄建成李志杰张会军
吕 瑛,李小兵,黄建成,李志杰,张会军,王 军
(河北医科大学第一医院心外科,河北 石家庄 050031)
我国先天性心脏病手术每年约4万多例,其中复杂先天性心脏病占20%。外科手术是目前公认的最为有效的治疗手段。既往术前合并肺部感染的复杂重症先心病围手术期病死率极高,临床上婴幼儿危重先心病合并肺部感染是否具有手术指征一直是小儿心脏外科领域的关注焦点。我院心外科对110例低体重(≤5 kg)危重先心病患儿进行外科手术治疗,手术效果良好,现总结报告如下。
1 资料与方法
1.1一般资料 选取2015年1月—2019年6月我院心外科收治的低体重(≤5 kg)危重先心病患儿110例。男性41例,女性69例;年龄1~7个月,平均(4.18±1.86)个月;体质量2.5~5.0 kg,平均(4.25±0.41)kg。病种:法洛四联征6例,肺静脉异位引流2例,完全型心内膜垫缺损3例,主肺间隔缺损1例,动脉导管未闭2例,重度肺动脉瓣狭窄4例(3例合并动脉导管未闭,1例合并房间隔缺损),房间隔缺损合并动脉导管3例,室间隔缺损(ventricular septal defect,VSD)89例,VSD直径0.6~1.3 cm,平均(10.42±1.30)mm,其中VSD合并房间隔缺损42例(2例因二尖瓣裂隙伴脱垂合并重度二尖瓣关闭不全),VSD合并卵圆孔未闭34例,VSD合并动脉导管未闭2例,VSD合并动脉导管未闭、房间隔缺损10例,VSD合并主动脉缩窄1例。全组伴左上腔静脉5例。合并中重度肺动脉高压61例,压力40~93 mmHg(1 mmHg=0.133 kPa)。所有患儿根据手术前肺部情况分为感染组与非感染组,其中感染组64例,非感染组46例。感染组术前均合并难以控制的肺部感染(伴有不同程度呼吸窘迫、咳嗽咳痰、发热)表现。所有患儿术前行胸片、心电图、心脏超声检查,必要时行CT明确诊断,对术前合并肺部感染患儿,根据细菌学培养药敏选用敏感抗生素,呼吸功能不全及心功能不全的进行相应处理。感染组在感染控制不佳的情况下:表现为胸片(渗出、大片絮影)、血象(白细胞计数>10.0×109/L),痰培养及血培养阴性或阳性、体温(>38.5 ℃),采用亚急诊手术矫治解剖畸形。全组6例术前合并心功能不全,8例术前给予机械通气。所有患儿均在全身麻醉下根据自身的畸形特点选择矫治手术,其中根治性手术106例,姑息性手术4例。2组性别、年龄、体重指数、心胸比例、左心室射血分数差异无统计学意义(P>0.05),具有可比性,见表1。
表1 2组患儿术前一般情况比较
1.2围术期一般治疗
1.2.1术前 心电监护、动脉置管监测血气指标,以调整内环境。多巴胺、多巴酚丁胺、肾上腺素等改善心功能,呼吸衰竭行呼吸机辅助呼吸。对于抗感染,依据病原学检查结果,根据药敏选用抗生素,同时考虑病原菌耐药情况,经验型用药时,考虑应用覆盖常见菌的药物。本组1例术前痰培养为铜绿假单胞菌,1例为金黄色葡萄球菌。
1.2.2术中 患儿多伴有低氧血症、内环境紊乱及心肺功能衰竭,麻醉诱导需注意避免使用心肌血管抑制强的药物,手术中精细操作。
1.2.3术后 持续监测有创动脉压、中心静脉压、密切监测生命体征。加强心肺功能的维护。术后注意保暖、维持出入量、电解质及酸碱代谢平衡,营养支持治疗。术后早期呼吸机辅助通气并充分镇静,应用多巴胺和米力农,根据病情加用肾上腺素改善心功能。对于感染监测:术后常规监测体温、血常规、C反应蛋白、痰培养和(或)血培养,根据病情需要监测降钙素原。调整抗生素后48 h进行疗效评估。对于呼吸道管理,围术期注意肺部体征,根据血气分析调整呼吸机参数,加强肺部理疗,合理、有效的心肺保护,感染控制后尽早撤离呼吸机。
1.3统计学方法 应用SPSS21.0统计软件处理数据,计量资料采用独立样本t检验、重复测量方差分析和SNK-q检验;计数资料采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.12组术中与术后各指标与并发症比较 2组患儿术中主动脉阻断时间和体外循环时间、二次插管组间差异无统计学意义,但机械通气时间(≥48 h)例数、机械通气时间(≥48 h),正性肌力药物时间、ICU时间(≥72 h),感染组高于非感染组,差异有统计学意义(P<0.05),见表2,3。
表2 2组术中各指标比较
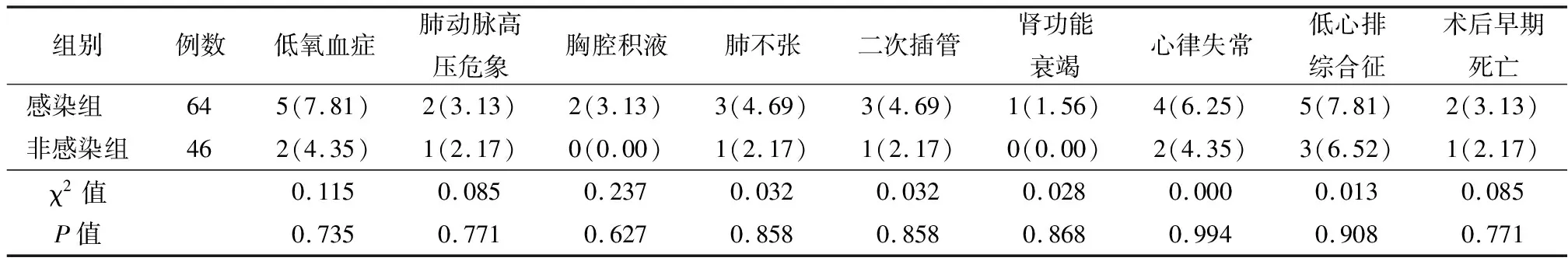
表3 2组患儿术中与术后并发症情况比较
2.2术后病原学比较 术后2组病原菌感染情况差异无统计学意义(P>0.05),见表4。
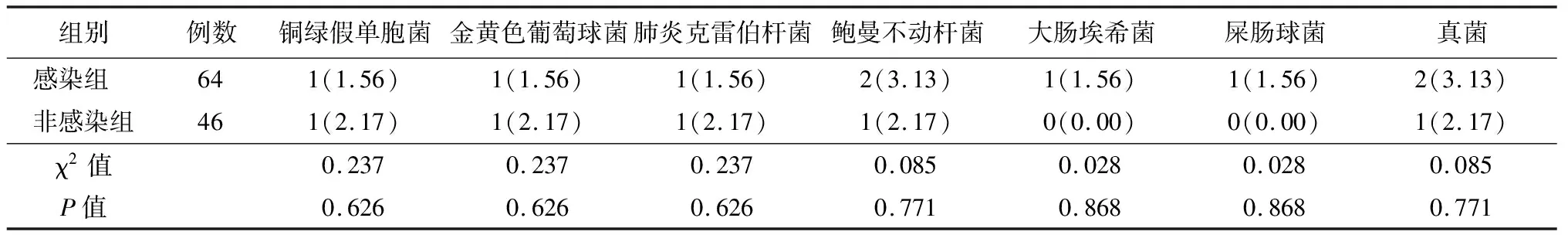
表4 2组患儿术后病原菌情况
2.32组围手术期白细胞、C反应蛋白、降钙素原比较 2组术后白细胞、C反应蛋白及降均先升高后降低至正常水平。2组在组间,时点间,组间·时间点交互作用差异均有统计学意义(P<0.05)(其中降钙素原2组各取30例作比较),见表5。
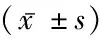
表5 2组围手术期白细胞、C反应蛋白、降钙素原比较
3 讨 论
先心病合并肺部感染是否具有手术指征一直是小儿心脏外科领域的争论焦点。目前,国际上及国内多个中心主张早期手术治疗危重症先心病合并肺炎,随着外科技术、体外循环技术以及抗感染治疗、呼吸治疗的快速发展,使得这一先进治疗理念和策略成为目前治疗的趋势[1-3]。这些以往被列为相对手术禁忌证的患儿进行积极合理的外科治疗是挽救生命的唯一方法[4-5]。
3.1手术时机的选择 目前,国内报道先天性心脏病合并肺炎的病死率可以达到11.9%~39.4%[6]。先心病合并肺部感染的患儿在内科治疗效果差可考虑行外科手术基于以下两种情况:一类表现为大量的左向右分流导致肺循环过度充血,患儿免疫功能低下,营养不良,常反复并发肺部感染以及心力衰竭,抗菌药物难以控制感染,内科常规治疗效果不佳。严重的肺动脉高压合并肺部感染,常导致这些患儿的早期死亡[7-8]。另一类则是心脏大血管的解剖畸形造成血流动力学异常,患儿常并发低氧血症、酸碱失衡,反复呼吸道感染、心力衰竭进行性恶化,内科治疗难以见效[9-10]。若患儿心脏畸形能够符合修补的解剖条件,应在合理的抗感染基础上积极进行手术干预,才能生存。但矛盾的是在感染时期进行外科手术,心肺转流引起的全身炎性反应将导致感染加重,增加术后并发症的发生率和病死率,因此,正确把握合并肺部感染先心病患儿的手术适应证,选择手术最佳时机和围术期管理水平尤其心肺功能保护是改善此类患儿早期干预效果的关键。本组病例110例,体重均在5 kg以下,体重低,病情复杂。其中64例术前合并肺部感染,6例合并心功能不全,8例术前给予机械通气。均在积极抗感染治疗效果不佳的基础上,采用亚急诊手术矫治解剖畸形。全组病例行根治性手术106例,姑息性手术4例,通过对手术时机的掌握、复杂重症先心病患儿处理的相关经验和技术有效的积累, 临床上治疗效果良好。
3.2围手术期呼吸道管理 对于合并肺部感染的先心病至关重要。我们体会在临床工作中围术期加强肺保护是减少术后肺部并发症的关键[11]。针对各种病因和危险因素,防止各种肺部并发症,包括:肺部感染、肺不张、肺水肿、支气管痉挛、呼吸衰竭等。应注意几点:①术前了解肺部疾病的性质、严重程度,预测手术疗效和术后肺部并发症,加强营养。术前应注意保持呼吸道清洁通畅,应用输液、雾化吸入湿化气道、胸背部叩击,药敏试验均有利于选择合理的抗生素治疗。②重症婴幼儿心脏手术操作相对复杂,体外循环时间较长,心肌损伤较重,术中尤应注意心肺功能保护。据报道体外循环心脏直视手术中的肺脏损伤是常见且多变的并发症之一,从一过性低氧血症到灌注肺和肺水肿,轻重不一。其研究机制涉及补体激活、氧自由基释放、白细胞反应、细胞因子、炎性因子等,而血管外肺水增多是核心表现之一[12]。术中应选择理想的麻醉方法和药物,保证气道通畅,维护循环稳定,避免血压过高或过低。③术后加强呼吸道护理。据研究心脏术后低氧血症发生率高达12.2%~27.1%,是术后肺部并发症、麻醉创伤和全身炎症反应等多因素作用的结果,其中术后肺部并发症为最主要的原因,而最常表现为肺不张。尤其对于应用呼吸机辅助通气的患儿,应在合理应用有效抗生素抗感染治疗的基础上,积极预防痰栓,维持液体出入量平衡,采取减轻腹胀的措施,尽早脱离呼吸机。本组研究显示:感染组患儿(其中8例术前予以呼吸机辅助呼吸)在积极抗感染的情况下效果不佳给予亚急性手术,术后带呼吸机相对较长,床旁胸片均存在不同程度片状高密度影及血常规、C反应蛋白及降钙素原均提示重症感染。另外,结果表明,感染组白细胞、C反应蛋白及降钙素原术前与术后第1天、术后第5天均较非感染组高,两组中白细胞、C反应蛋白及降钙素原均在术后第1天升高最为明显,术后第5天较术后第1天有明显改善,术后第5天非感染组基本恢复正常。考虑除感染因素外,还与体外循环所致炎症反应、手术应激等的影响密切有关。尤其降钙素原作为炎症指标与感染炎症程度相关,其对细菌性感染疾病敏感性与特异性较高,但对其增高程度区分细菌种类及其他病原感染尚未阐明。另外,文献报道:呼吸机通气≥48 h, 术后ICU≥72 h,术后二次插管,术后低心排综合征是术后医院感染的危险因素,本研究结果除术后二次插管因素外与报道相一致。因此,要有效控制心脏术后感染发生,掌握心脏术后ICU医院感染的病原菌流行状态和相关的危险因素是治疗的前提[13]。本组研究显示:心脏术后病原菌监测14例,原因考虑低体重先心病患儿本身病情重,心脏术后呼吸机辅助通气支持比例高,同时留置深静脉导管,有创动脉压等,使得呼吸机相关性肺炎和导管相关性血流感染危险性增加,发生心脏术后医院感染。因此,心脏术后要根据科室的病原菌特点和药敏结果针对选择抗生素,减少经验用药和广谱抗生素的使用,减少和延缓细菌耐药的发生。同时给予积极的干预措施,采用集束化治疗[14],有效地减少感染的发生。
3.3围手术期并发症处理 心脏术后肺动脉高压、肺部并发症的合理处理和低心排综合征是影响外科治疗效果的关键因素。对于手术复杂,体外循环时间长的婴幼儿,术后要积极改善心功能[15-16]。低月龄低体重婴幼儿各系统发育欠成熟,加之体外循环时间长、深低温停循环等,术后炎症反应重,心肌水肿明显,加之术前合并肺部感染、心功能不全,应注意提高围术期呼吸循环的稳定性。本组110例患儿中合并中重度肺动脉高压61例,其中3例术后发生PH危象,术后1~2 d给予充分镇静,一氧化氮吸入,同时应用降低肺动脉压力药物治疗后肺动脉压力有明显下降,氧合指数增加,逐渐停用后成功撤除呼吸机。另外,本组病例术后肺部并发症常见,其中肺不张发生4例(右上肺不张3例,左肺不张1例),7例术后并发低氧血症(其中5例为室间隔缺损合并房间隔缺损和(或)动脉导管未闭伴重度肺动脉高压,1例为法洛四联征,1例为心内膜垫缺损),术后二次插管4例,临床根据药敏试验及临床症状抗感染、机械辅助排痰等肺保护措施治疗,同时调整心功能后好转。对于危重先心病,术后根据病情需要给予不同剂量的多巴胺、米力农、肾上腺素等提高心肌收缩力[17]。同时根据血气分析,调整酸碱和电解质平衡,积极纠正心律失常,根据动脉血乳酸水平反映组织灌注情况,改善心功能不全。值得一提的是临床体会此类患儿体外循环术后易发生顽固性低钙血症,加重低心排综合征,应积极纠正。本组病例8例术后出现短暂低心排出量综合征,6例心律失常,经调整心功能,调整内环境后好转。1例术后出现无尿等急性肾功能衰竭表现,经积极补充血容量、应用冻干重组人脑利钠肽等治疗术后34 h后尿量逐渐恢复。本研究的不足在于病例数较少,需进一步增加样本量观察近远期疗效。
总之,婴幼儿低体重危重先心病合并肺部感染的手术治疗是安全可行且有价值的,但必须正确掌握手术时机,注重术前基础状态的调整[18];积极有效的手术干预,术中加强脏器的保护;术后个体化的监护方案;积极改善心肺功能,密切监测感染,合理使用抗生素,及时有效进行疗效评估,注重营养支持治疗[19-20],将婴幼儿复杂重症先心病合并肺部感染病死率降至最低。
