阿帕替尼联合化疗治疗晚期乳腺癌的疗效及安全性
2020-12-30龚子永丁敏侯建新
龚子永,丁敏,侯建新
新乡市第一人民医院乳腺科,河南 新乡 453000
乳腺癌是一种恶性肿瘤,其发病率居全部女性恶性肿瘤首位,近年来其发病率在世界范围内呈明显上升趋势,已成为20~59岁女性常见死亡原因之一,随着近年来医学知识的普及和诊疗技术的革新,乳腺癌的检出率不断提升[1]。现阶段,早期乳腺癌患者接受及时且规范化的治疗后,其复发率呈降低趋势,但仍有部分患者出现复发及转移,转变为晚期乳腺癌。晚期乳腺癌属于不可治愈疾病之一,患者多为多线治疗失败、存在多种耐药性等,导致其治疗效果不理想,且尚未有统一的治疗方案[2]。因此,寻找一种合理有效的晚期乳腺癌治疗方案显得尤为重要。乳腺癌具有明显的促血管生成活性,肿瘤生长、代谢、转移等均需要血管持续生长,阿帕替尼是中国自主研发的小分子抗血管生成靶向药物,通过抑制肿瘤血管生成,进而抑制肿瘤细胞生长,促进肿瘤细胞凋亡,达到较好的抗肿瘤目的[3]。近年来多项研究证实,阿帕替尼在多种恶性肿瘤的治疗中具有较好的效果,且患者对其不良反应的耐受性较高,治疗安全性较好[4-6]。本研究探讨了阿帕替尼联合化疗治疗晚期乳腺癌的疗效及安全性,现报道如下。
1 资料与方法
1.1 一般资料
收集2013年5月至2016年5月新乡市第一人民医院收治的晚期乳腺癌患者的病历资料。纳入标准:①经组织病理学检查确诊为乳腺癌,符合《2008年NCCN乳腺癌临床实践指南(中国版)解读》[7]中Ⅳ期乳腺癌的诊断标准;②具有可测量病灶;③生存时间≥6个月,卡氏功能状态(Karnofsky performance status,KPS)评分≥60分;④化疗期间停用其他抗肿瘤药物;⑤重要脏器功能完整,且无化疗禁忌证;⑥临床资料、病历资料及随访资料均完整。排除标准:①合并严重的心、肝、肾等重要脏器损害;②合并骨髓功能异常、其他恶性肿瘤、感染等疾病;③具有精神病史、阿尔茨海默病、帕金森病等,思维意识模糊;④肿瘤病灶显示不清,无法评估疗效。依据纳入和排除标准,本研究共纳入70例患者。根据治疗方法的不同将患者分为联合组和化疗组,每组35例,化疗组患者采用紫杉醇联合卡铂治疗,联合组患者在化疗组的基础上给予阿帕替尼治疗。联合组患者的年龄为35~75岁,平均年龄为(56.32±10.87)岁;月经情况:绝经23例,未绝经12例;转移部位:肝脏13例,肺部18例,骨10例,淋巴结20例,脑11例;既往化疗次数:<4次16例,≥4次19例。化疗组患者的年龄为35~75岁,平均年龄为(58.72±10.59)岁;月经情况:绝经20例,未绝经15例;转移部位:肝脏15例,肺部16例,骨7例,淋巴结22例,脑10例;既往化疗次数:<4次14例,≥4次21例。两组患者的年龄、月经情况、转移部位及既往化疗次数比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 治疗方法
化疗组患者采用紫杉醇联合卡铂治疗,具体方案:第1天,使用紫杉醇前12 h,口服20 mg地塞米松,前30 min分别肌内注射50 mg苯海拉明和静脉注射300 mg西咪替丁,再静脉滴注135 mg/m2紫杉醇注射液,持续3 h;第2天,静脉滴注300 mg/m2卡铂。21天为1个周期,治疗3个周期后进行疗效评价。
联合组患者在化疗组的基础上给予阿帕替尼治疗,餐后0.5 h口服500 mg阿帕替尼,每天1次,若患者出现3~4级阿帕替尼相关不良反应,暂停用药或减量至250 mg/d。21天为1个周期,治疗3个周期后进行疗效评价。
1.3 观察指标
1.3.1 近期疗效 采用世界卫生组织(WHO)实体瘤疗效评价标准[8]对两组患者的疗效进行评价:完全缓解(complete response,CR),肿瘤病灶完全消失,至少维持4周;部分缓解(partial response,PR),肿瘤面积缩小≥50%,至少维持4周;疾病稳定(stable disease,SD),肿瘤面积缩小<50%或增加≤25%,至少维持4周;疾病进展(progressive disease,PD),肿瘤面积增加>25%或出现新病灶。总有效率=(CR+PR)例数/总例数×100%,疾病控制率=(CR+PR+SD)例数/总例数×100%。
1.3.2 生化指标 治疗前及治疗结束后4周,分别抽取两组患者的外周静脉血5 ml,3000 r/min离心10 min,取血清,置于-80℃保存。采用酶联免疫吸附试验检测血清血小板第4因子(platelet factor 4,PF4)、中期因子(midkine,MK)水平。
1.3.3 生活质量 治疗前及治疗结束后4周,采用欧洲癌症研究与治疗组织生命质量测定量表(European Organization for Research and Treatment of Cancer quality of life questionnaire core 30,EORTC QLQ-C30)[9]评价两组患者的生活质量,该量表包括1个健康项、5个功能项、9个症状项,每项包含多个小项,共计30项,每项为0~3分,分数越高表明生活质量越好。
1.3.4 不良反应 依据WHO抗癌药急性及亚急性毒性反应分级标准[10]评价两组患者治疗期间的药物不良反应,包括上消化道反应(恶心、呕吐)、中性粒细胞减少及蛋白尿。
1.3.5 生存情况 治疗结束后对两组患者进行3年随访,随访截止时间为2019年5月。前2年每3个月随访1次,最后1年每6个月随访1次,随访内容包括妇科检查、肿瘤标志物检查、影像学检查[B超、计算机断层扫描(CT)、磁共振成像(MRI)]、细胞学检查等。计算两组患者的生存率,生存时间为初始治疗至患者死亡或随访截止时间。
1.4 统计学方法
采用SPSS 17.0软件对数据进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验,等级资料的比较采用非参数Mann-WhitneyU检验;采用Kaplan-Meier法绘制生存曲线,组间比较采用Log-rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 近期疗效的比较
治疗后,联合组患者的总有效率和疾病控制率分别为37.14%(13/35)和68.57%(24/35),分别高于化疗组患者的14.29%(5/35)和42.86%(15/35),差异均有统计学意义(χ2=4.786、4.690,P<0.05)。(表1)
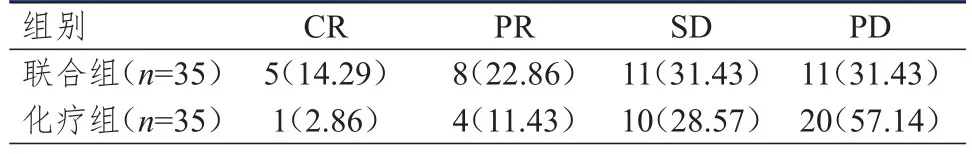
表1 两组患者的近期疗效[ n(%)]*
2.2 生化指标和生活质量的比较
治疗前,两组患者的血清PF4、MK水平和EORTC QLQ-C30评分比较,差异均无统计学意义(P>0.05)。治疗后,两组患者的血清PF4、MK水平均低于本组治疗前,EORTC QLQ-C30评分均高于本组治疗前,且联合组患者的血清PF4、MK水平均低于化疗组,EORTC QLQ-C30评分高于化疗组,差异均有统计学意义(P<0.05)。(表2)
表2 治疗前后两组患者生化指标和生活质量的比较(± s)

表2 治疗前后两组患者生化指标和生活质量的比较(± s)
注:a与本组治疗前比较,P<0.05;b与化疗组治疗后比较,P<0.05
指标 时间 联合组(n=35) 化疗组(n=35)PF4(ng/ml) 治疗前0.33±0.200.31±0.19治疗后0.20±0.09a b0.25±0.10a MK(pg/ml) 治疗前705.32±125.44708.83±120.69 EORTC QLQ-C30评分治疗后治疗前治疗后483.26±135.54a b 579.06±130.99a 75.36±5.1874.06±5.92 115.54±8.96a b102.36±10.42a
2.3 不良反应发生情况的比较
两组患者上消化道反应、中性粒细胞减少、蛋白尿的发生情况比较,差异均无统计学意义(Uc=0.459、0.354、0.241,P>0.05)。(表3)
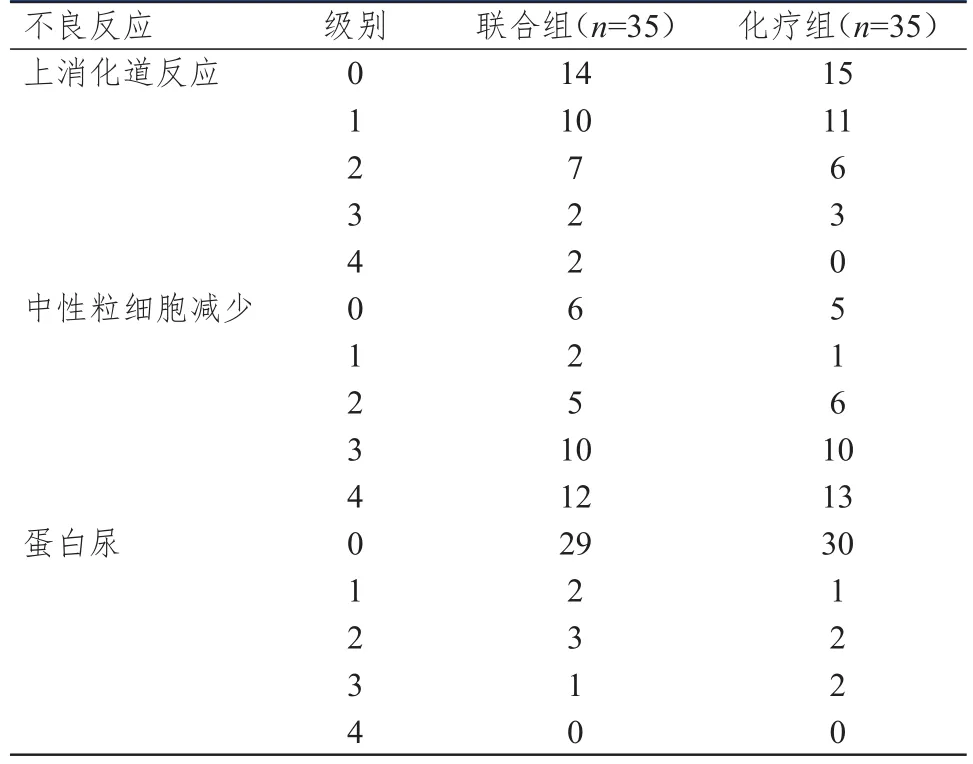
表3 两组患者的不良反应发生情况
2.4 生存情况的比较
随访3年,联合组患者的总生存率为65.71%(23/35),高于化疗组患者的45.71%(16/35),差异有统计学意义(χ2=5.380,P=0.020)。(图1)
3 讨论
乳腺癌是发生在乳腺腺上皮组织的恶性肿瘤,高发于绝经前后女性,其发病原因相对复杂,但早期治疗效果相对较好,而疾病晚期治愈的可能性相对较小,多以放疗、化疗和内分泌治疗为主,同时也会配合部分中、西医药物进行治疗[11]。随着肿瘤血管生成理论的提出和实践,证实肿瘤发生、发展及转移过程均需要通过新生血管获得营养,肿瘤新生血管结构还会扰乱正常组织的血管结构,导致药物无法顺利到达肿瘤组织,肿瘤组织代谢废物堆积,进而促进肿瘤进一步生长[12-13]。近年来有研究发现,采用小分子靶向药物抑制细胞内多种蛋白激酶后,能够有效抑制肿瘤新生血管及肿瘤微环境形成,进而抑制肿瘤的生长、复发及转移[14]。阿帕替尼是被证实在晚期胃癌标准化疗失败后仍安全有效的口服药物,其在胃癌的三线治疗中取得较大成功,其作为小分子抗血管生成靶向药物,能够高度选择性地阻断酪氨酸激酶,进而发挥较好的抗肿瘤效果[15]。
本研究对晚期乳腺癌患者采用阿帕替尼联合化疗治疗,结果发现,联合用药后能够有效提高药物治疗效果及患者的生存率,且联合用药未增加药物不良反应。这可能是因实体瘤长至1 mm3时就会出现新生血管,阿帕替尼作为小分子酪氨酸激酶抑制剂,能够选择性地抑制血管内皮生长因子(vascular endothelial growth factor,VEGF)的功能,阻断下游信号转导,进而抑制内皮细胞活动,减少肿瘤血管生成,通过抑制其营养获取,进而抑制肿瘤细胞生长,使抗肿瘤药物发挥其原有功效[16-17]。PF4是血小板衍生因子之一,能够有效抑制VEGF受体激活,进而发挥其抑制血管生成的作用[18]。MK是分泌性碱性肝素结合蛋白,是一种血管生长调控因子,可参与血管生成,其在多种恶性肿瘤中均呈高表达状态,与肿瘤的发生、发展具有一定关系[19]。本研究比较了治疗前后两组患者的血清PF4、MK水平,结果发现,治疗后联合组患者的血清PF4、MK水平均低于化疗组,与张华等[20]的研究结果一致。说明阿帕替尼能够通过抑制酪氨酸激酶的活性,有效抑制肿瘤细胞生长。本研究还分析了治疗前后两组患者的生活质量,结果发现,治疗后联合组患者的EORTC QLQ-C30评分高于化疗组,这是因为大部分晚期乳腺癌患者经长期治疗后出现明显的耐药性,导致生活质量下降,而联用阿帕替尼能够有效控制肿瘤进展,且不良反应具有较高的可控性,能够在一定程度上提高患者的生存率,故其对患者生活质量的提高具有积极意义。
综上所述,阿帕替尼联合化疗治疗晚期乳腺癌的疗效及安全性均较好,其可能通过抑制血清PF4、MK水平发挥治疗效果,进而提高患者的生活质量,改善患者预后。
