矿物质氧化物对燃煤烟气中砷/铅的吸附特性研究
2020-12-30余圣辉袁昌乐方庆艳
余圣辉, 张 成, 袁昌乐, 马 仑, 方庆艳, 陈 刚
(华中科技大学 煤燃烧国家重点实验室, 湖北 武汉 430074)
燃煤烟气中的砷和铅具有高毒、易挥发和生物富集特性,严重威胁着人类健康和生态环境[1-4]。煤中的砷和铅是半挥发性重金属,在煤粉燃烧过程中,大多数砷和铅转化为蒸气形态(As2O3[4,5]、PbO[6]),然后通过物理吸附或化学反应富集到烟气中的细颗粒物上[4,5],其中,超过90%的颗粒态砷、铅可以通过除尘装置脱除,但是富集在细颗粒物上和以气态形式存在的砷、铅会逸入大气,对生物体具有剧毒[7-11]。此外,砷、铅蒸气可能会阻塞孔并占据选择性催化还原装置(selective catalytic reduction, SCR)催化剂表面的活性位点并使催化剂失活[11,12]。随着环保要求的提高,砷、铅等痕量元素的减排工作也越来越受社会各界的重视。国家环保部于2012年公布《环境空气质量标准》(GB 3095—2012),规定砷的排放限值为0.006 μg/m3,铅的排放限值为0.5 μg/m3[13]。因此,控制燃煤电厂砷、铅的排放具有重要意义。
目前,对燃煤重金属的控制研究主要包括燃烧前预处理,燃烧过程控制和燃烧后脱除,在燃烧过程中,注入固体吸附剂是目前研究的热点[4]。研究者通过矿物质氧化物吸附剂吸附As2O3/PbO的方式来研究矿物质与砷和铅的反应关系。Zhang等[14]发现湿法磁选选出的含铁颗粒对砷有较好的吸收效果。Ma等[15]研究了Ca(OH)2、高岭土、Al2O3、SiO2的As2O3吸附性能,发现Ca(OH)2的效果明显大于其他三种矿物。张月等[16,17]研究了CaO、Fe2O3、Al2O3及Fe2O3/γ-Al2O3在空气气氛下气相砷的吸附特性,发现铁基吸附剂对气相砷有较好的吸附效果。此外,烟气组分对吸附剂吸附气相砷有影响。张月等[16]研究富氧燃烧条件下H2O、SO2、CO2对Fe2O3/γ-Al2O3吸附气相砷的影响,发现H2O对气相砷吸附有促进作用,而CO2对气相砷吸附有抑制作用,低浓度SO2促进气相砷吸附而高浓度时抑制吸附。Si/Al基吸附剂对铅蒸气的吸附性能较好,其中,高岭土具有出色的吸附效果[18],Si/Al基吸附剂可以提供大量的Al-O和Si-O键,以与气相铅结合形成稳定的氧化物[19-21]。此外,燃煤电厂飞灰主要含有Al2O3和SiO2,作为一种经济的气相铅吸附剂被研究[22,23]。在实际应用中,SiO2和Al2O3在高温下反应形成铝硅酸盐,吸附活性降低,燃煤烟气组分也会影响气相铅的吸附[24,25]。相对于在空气气氛下研究重金属的吸附,在模拟燃煤烟气气氛中测试吸附剂的吸附特性对实际应用更有指导意义。
配煤掺烧技术作为一种经济、高效、低排放技术被广泛应用于中国电厂,该技术通过筛选煤质混烧,进而控制燃煤烟气中污染物排放[26]。本课题前期研究发现,通过矿物质调配,将高钙煤与富含重金属煤种混烧,可以实现燃烧过程中控制重金属砷、硒等排放。而煤中矿物质种类多,不同矿物质氧化物吸附气相重金属的机理有待进一步研究。现有研究主要在实验室台架上测试吸附剂固化气相重金属特性并分析吸附样品仅可以对吸附剂的吸附效果作粗略的评价,不能从分子层次上做出重金属吸附的通适性机理解释。近年来,密度泛函理论(density functional theory, DFT)计算已被广泛用于研究重金属在吸附剂表面的吸附过程并可以揭示吸附反应机理[27-29]。通过分子模拟方法获得吸附能、热力学特性、态密度等参数,能够更好的指导吸附剂的制备和筛选。
本研究利用恒定的砷、铅源发生装置,在两段式固定床反应器中探究模拟烟气气氛下,研究煤中常量矿物质氧化物CaO、Fe2O3、MgO、Na2O、Al2O3、SiO2吸附气相砷的特性,以及典型Si/Al基吸附剂吸附气相铅的特性,并利用DFT计算As2O3、PbO的吸附并对吸附机理作分析,旨在为炉内控制砷、铅的排放做指导。
1 实验部分
1.1 实验材料
实验选取煤中常量矿物质的氧化物CaO、Fe2O3、MgO、Na2O(Na2CO3)、Al2O3、SiO2和高岭土(kaolin)作为吸附剂,吸附剂的纯氧化物含量均在98%以上,此外某燃煤电厂粉煤飞灰(FA)吸附PbO的特性被研究,吸附剂颗粒均为0.20-0.30 mm。模拟烟气中气相砷采用氢化物发生—氧化法制备,气相铅采用高温氧化法制备,砷源NaAsO2和铅源Pb(OAc)2·3H2O购自国药集团化学试剂有限公司。吸附剂的理化特性和重金属发生所需试剂信息在文献中有详细报道[25,30]。
1.2 吸附实验方法
砷吸附实验的装置在文献中有详细描述[25,31],铅吸附实验的装置示意图见图1。系统由铅发生装置和铅吸收装置两部分组成。实验过程中模拟烟气总流量控制为1.5 L/min,根据某电厂实际烟气组分的测量结果,设定实验模拟烟气中N2、O2、CO2、H2O的体积分数分别为77%、4.8%、13%、5.2%,模拟烟气中分别含有200 μg/g As2O3和PbO。重金属吸附过程中,当反应炉内温度达到目标吸附温度时,在可移动式反应器上方加入吸附剂颗粒,并使反应器在炉中预热1 min,接着开始吸附实验。每次吸附实验使用的吸附剂质量为0.5g,气相砷的吸附温度为300-900 ℃,间隔200 ℃,气相铅的吸附温度为700-1200 ℃,间隔100 ℃,吸附时间均为30 min,吸附完成后将样品冷却至室温进行收集分析,每组实验至少重复三次。
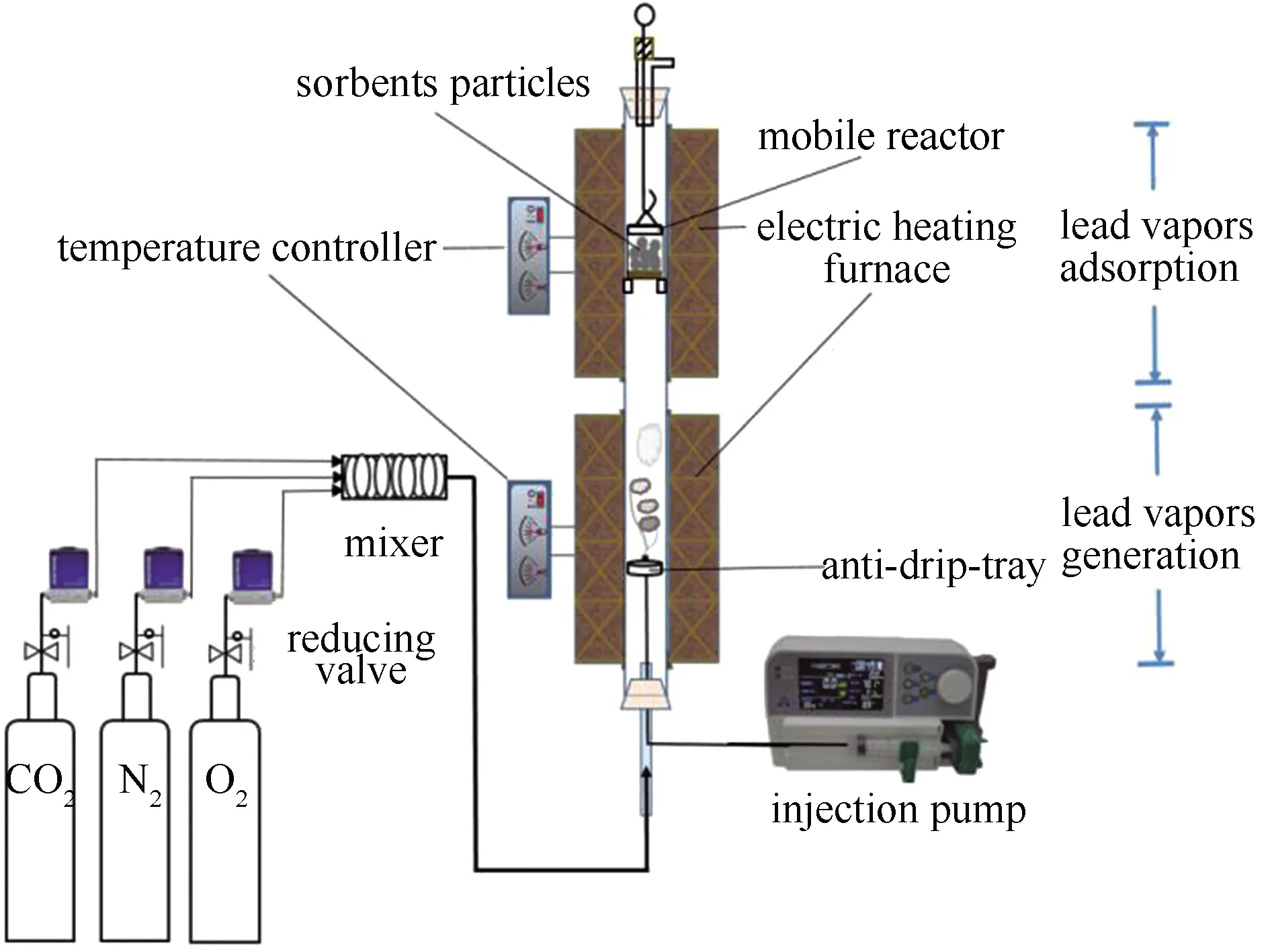
图1 铅吸附反应实验装置示意图
此前研究发现,矿物质交互作用明显促进重金属的吸附,如CaO和Fe2O3混合后气相砷吸附容量明显提高[30],这里设置Al2O3和SiO2混合吸附剂以进一步研究其吸附铅的特性,混合吸附剂质量比1∶1(50%SiO2/50%Al2O3),记作M。此外,为了理解实际烟气中颗粒物中矿物质氧化物吸附重金属,1300 ℃加热30 min的吸附剂作为对照组,文献[26]报道了吸附SeO2的相关研究,这里将探讨高温煅烧样品的PbO吸附特性,煅烧后的样品记作CaO-1300、MgO-1300、SiO2-1300、Al2O3-1300和混合吸附剂50%SiO2/50%Al2O3-1300(M-1300)。
1.3 样品分析
依次取40 mg吸附样品,样品中的吸附砷用8 mL 20%盐酸提取[25,30],提取温度为80 ℃,提取液定容、稀释后,采用原子荧光光度计(AFS-8220,吉天,中国)测定其中砷浓度;吸附的铅用8 mL HNO3和2 mL HF提取,采用电感耦合等离子体质谱仪(ICP-MS,ELAN DRC-e,珀金·埃尔默,美国)测定溶液中铅浓度。吸附剂的空隙特征由比表面积及孔隙分析仪(3H-2000PS,贝士德,中国)测试,每次取约0.2 g样品在室温6.7 Pa条件下脱气2 h,然后由-196.15 ℃ 液氮等温吸附,比表面积和平均孔径由Brunner-Emmer-Teller(BET)和Barret-Joyner-Halenda(BJH)方程计算;吸附剂的表面微观形貌由扫描电镜(SEM,蔡司,德国)分析;吸附产物中重金属化合物由X射线衍射仪(XRD,X’Pert3 Powder,帕纳科,荷兰)分析,20°-80°(CuKα 靶,40 kV,40 mA)扫描,扫描速率5(°)/min;吸附样品中重金属的价态由X射线电子能谱(XPS,AXIS-ULTRA dld-600w, 克拉托斯,日本)分析,并采用XPSPEAK4.1软件对结果进行Gauss拟合。
1.4 分子模拟计算
为了探究矿物质氧化物吸附As2O3和PbO的吸附能、吸附位点等特性,采用Material Studio 软件的DMol3模块来执行量子化学计算。计算运用密度泛函理论中的广义梯度近似(Generalized Gradient Approximations, GGA)和梯度修正函数(Perdew-Burke-Ernzerhof, PBE)计算电子的交换关联作用。计算选择了体系中原子的有效电子(Effective Core Potentials)在DNP机组上完成几何优化,自洽场的总能量收敛极限为1.0×10-5Ha。计算采用的小分子为:As2O3(键长:As-O=0.1950 nm、As-As=0.2359 nm;键角:As-O-As=74.435(°),O-As-O=87.201°)和PbO(键长为0.1979 nm),计算使用的各种分子构型见图2。
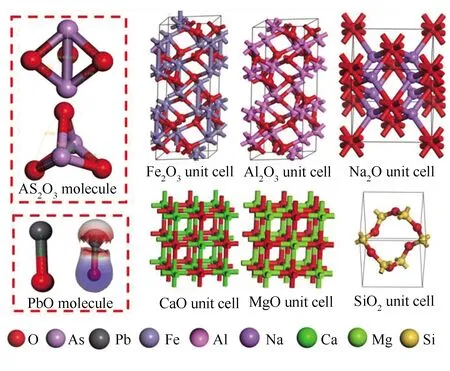
图2 计算使用的分子结构
为了简化计算,结合文献报道[27-29,32-34]选取氧化物晶胞并选取CaO(001)、Na2O(110)、MgO(100)、Fe2O3(001)、SiO2(001)、Al2O3(100)面为吸附面,相应地计算出吸附能、吸附产物电子态密度以及正、负电荷云图用来揭示吸附反应机理,并根据公式1计算吸附能。
Eads=Epro-(Eslab+Eadsorbate)
(1)
式中,Eads:吸附能(kJ/mol);Epro:吸附产物总能量(kJ/mol);Eslab:小分子能量(kJ/mol);Eadsorbate:吸附剂切面能量(kJ/mol)。
为了理解温度对气相铅吸附的影响机理,PbO在SiO2(001)面300-1800 K的吉布斯自由能被计算,计算根据公式(2)-(4)。
Ggas=Eele+ZPE+R×T-T×S
(2)
Gsolid=Eele+ZPE-T×S
(3)
ΔG=Gp-Ggas-Gsolid
(4)
式中,Eele:零位能量(kJ/mol);ZPE:零位能量校正(kJ/mol);R:气体通用常数(8.314 J/(mol·K));T:开尔文温度(K);S:熵(J/(mol·K-1));Ggas:气体的自由能(kJ/mol);Gsolid:固体的自由能(kJ/mol);ΔG:自由能的变化值(kJ/mol);Gp:产物的自由能(kJ/mol)。
此外为了揭示高温烟气中Si/Al基混合吸附剂对PbO吸附的促进机理,分别向Al2O3切面掺杂Si原子、向SiO2切面掺杂Al原子,并计算吸附能。
2 结果与讨论
2.1 矿物质氧化物的砷吸附性能及机理
2.1.1 矿物质氧化物的砷吸附容量
图3为不同矿物质氧化物吸附剂在模拟烟气气氛下的砷吸附量。由图3可知,CaO的气相砷吸附效果最好,在900 ℃时吸附容量达到最大值。在300-700 ℃时,气相砷的吸附容量:CaO>Fe2O3>Na2O>MgO>Al2O3>SiO2,SiO2几乎不吸附砷。在实验条件下,CaO、MgO、Al2O3和SiO2的砷吸附量随温度升高而增加。温度升高至900 ℃时,Fe2O3和Na2O的气相砷吸附容量迅速降低,这可能与吸附剂的熔融有关[25]。700 ℃的CaO吸附砷容量未明显增加,这与烟气中CO2与CaO的碳酸化反应有关[30,31]。
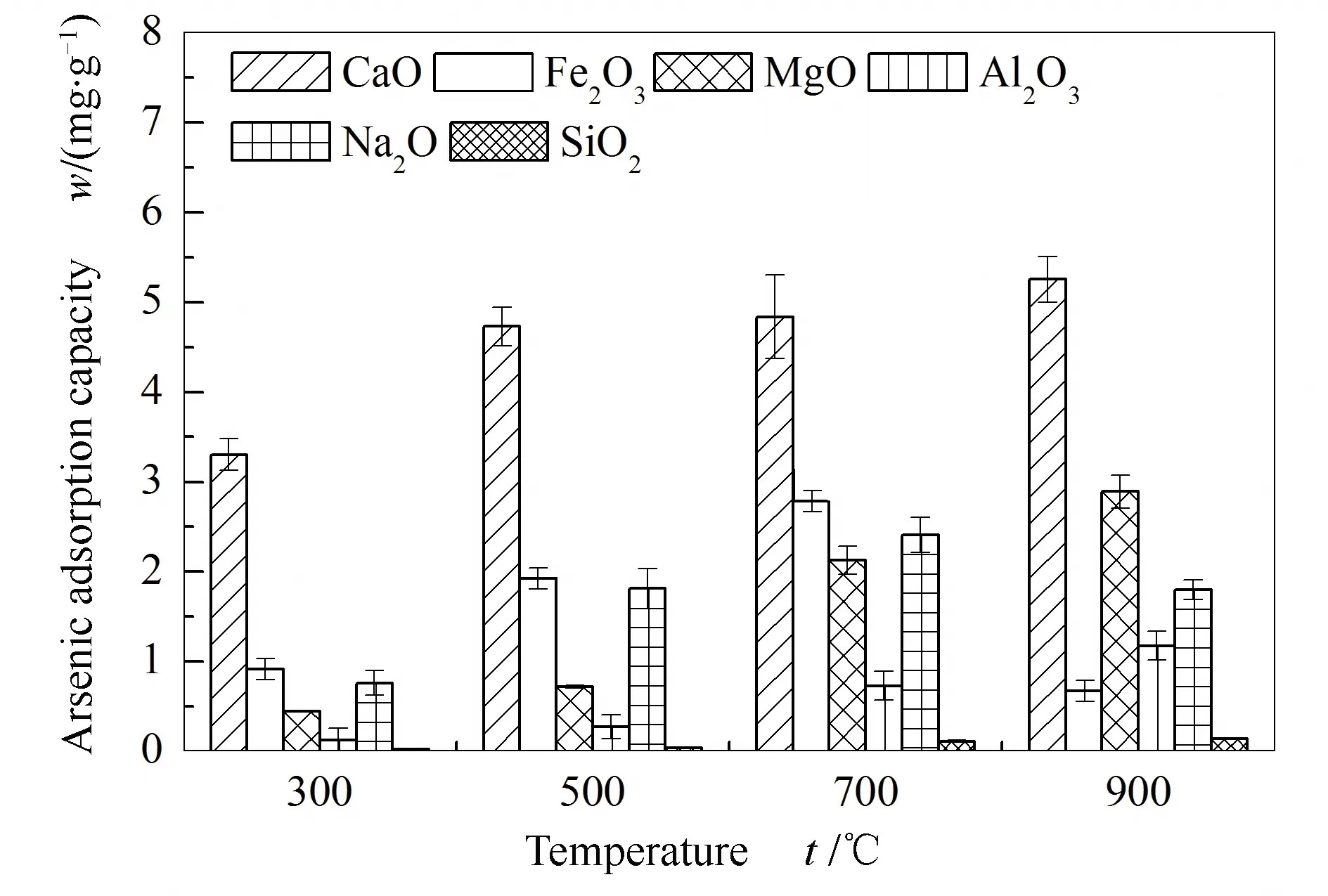
图3 300-900℃下矿物质氧化物的砷吸附容量
2.1.2 机理分析
为了清楚地了解矿物质氧化物吸附砷的性能,分析了吸附剂的结构特性和表面微观形貌。表1为矿物质氧化物的比表面积和孔隙结构性质的结果。结果表明,比表面积Fe2O3>CaO>MgO>Na2O>SiO2>Al2O3。对比图3和表1发现,氧化物吸附剂的砷吸附容量与吸附剂的比表面积之间不完全正相关,此外,Fe2O3吸附砷量随温度升高明显降低也无法通过比表面积解释。

表1 氧化物吸附剂的结构特性

图4 矿物质氧化物的微观形貌
通常认为,当吸附能大于30 kJ/mol 时,吸附反应为化学吸附[28]。表2对比分析了CaO、MgO、Na2O、Fe2O3、Al2O3、SiO2相应切面上As2O3分子的吸附能。由表2可知,各种氧化物吸附As2O3分子的吸附能均大于100 kJ/mol,即为化学吸附。仅从吸附能来看,Fe2O3>Na2O>CaO >Al2O3>MgO >SiO2,这与图3中气相砷吸附容量结果不同,这可能与实际吸附剂暴露的切面与计算选取的最佳切面不同。此外温度对气相砷的吸附影响显著,计算采用几何优化方法并未考虑温度对吸附的影响。模拟研究As2O3分子在吸附剂切面上的吸附,以获取气相砷吸附的活性位,吸附剂吸附砷前后的构型见图5。
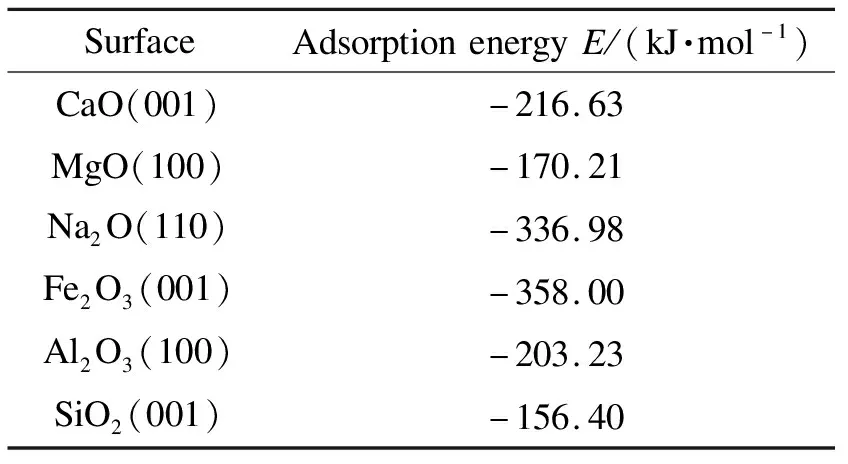
表2 吸附剂吸附砷的吸附能
由图5可知,CaO和Na2O吸附As2O3产物相似,均为As2O3分子中As-O和As-As键断开,断开一个As-O键的As原子和CaO/Na2O切面的O原子结合,生成新的As-O键,As-O键长分别为1.961、1.818 Å;MgO吸附As2O3产物中一个As-O键断开,断开一个As-O键的As原子和MgO切面的O原子结合,生成新的As-O键,键长分别为2.006 Å;Al2O3和SiO2吸附As2O3产物中,As2O3分子未断键,As2O3分子的一个As原子分别与Al2O3切面的一个O原子和SiO2切面的两个O原子结合,生成As-O键,其中,Al2O3的As-O键键长为2.113 Å,SiO2的As-O键键长为1.785、1.801 Å;Fe2O3吸附As2O3产物中As2O3分子的As-O和As-As键断开,断键产生的As与Fe原子结合,断键产生的O与邻位Fe结合,生成As-Fe键键长2.657 Å,生成O-Fe键键长2.005 Å。综上可知,Na2O、CaO、MgO、Al2O3、SiO2吸附剂表面O原子,Fe2O3表面的Fe原子是As2O3吸附位点。
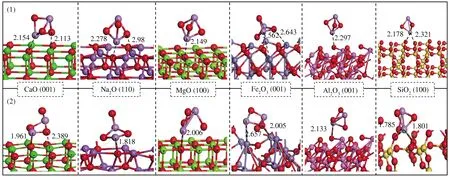
图5 吸附剂吸附As2O3反应前后的结构示意图
考虑到CaO、MgO、Na2O为碱金属,化学性质相近,Al2O3和SiO2被认为是煤中酸性矿物质成分,Fe2O3为过渡金属氧化物,选取CaO、Al2O3、Fe2O3为研究对象,采用XRD分析700 ℃样品中吸附砷的存在形式,结果见图6。
由图6可以看出,700 ℃时烟气中的CaO颗粒生成CaCO3和Ca(OH)2,说明气氛中的H2O、CO2均对CaO吸附气相砷影响显著,吸附的气相砷以Ca3(AsO4)2形式存在。700 ℃的Fe2O3颗粒表面生成了FeO、Fe3O4、Fe2(C2O4)3,吸附砷以FeAsO4形式存在。不同于CaO和Fe2O3吸附剂,H2O、CO2气氛对Al2O3吸附气相砷影响较小,吸附砷以AlAsO4形式存在。

图6 700 ℃吸附砷样品的XRD谱图
CaO在700 ℃吸附砷的XPS谱图见图7。由图7可知,吸附砷的3dXPS谱图主要有两个峰,分别是在43.15 eV的As3+和在44.00 eV的As5+[25]。文献[31]报道了相似的结果,气相砷的吸附可以归纳为公式(5)和(6)。
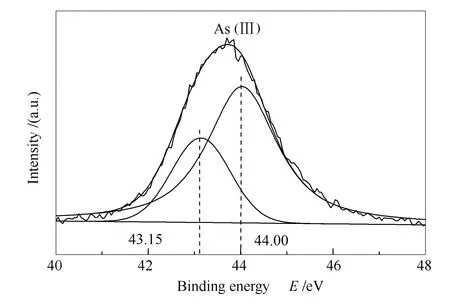
图7 CaO在700 ℃吸附砷的As 3d XPS谱图
CaO+As2O3→Ca(AsO2)2
(5)
3CaO+As2O3+O2→Ca3(AsO4)2
(6)
2.2 矿物质氧化物的铅吸附性能及机理
2.2.1 矿物质氧化物的铅吸附容量
图8为不同矿物质氧化物900 ℃的气相铅的吸附容量。由图8可知,SiO2的铅吸附容量最大,其次是Al2O3,其他矿物质氧化物的铅吸附容量低,说明矿物质氧化物中SiO2和Al2O3是气相铅吸附的主要材料。在700-1200 ℃时,不同Si-Al基吸附剂的气相铅吸附容量见图9。
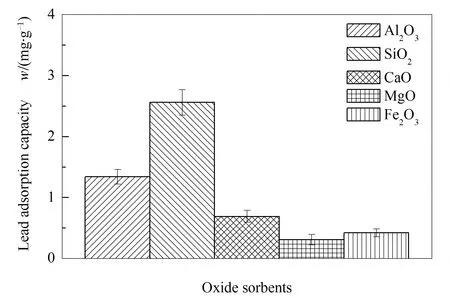
图8 900 ℃下矿物质氧化物的铅吸附容量
由图9可知,高岭土具有最大气相铅吸附容量,其次为粉煤飞灰和SiO2,随温度升高,吸附剂吸附气相铅容量先增加后减少,高岭土吸附铅在1000 ℃达到峰值,SiO2、Al2O3、粉煤飞灰在900 ℃达到峰值。
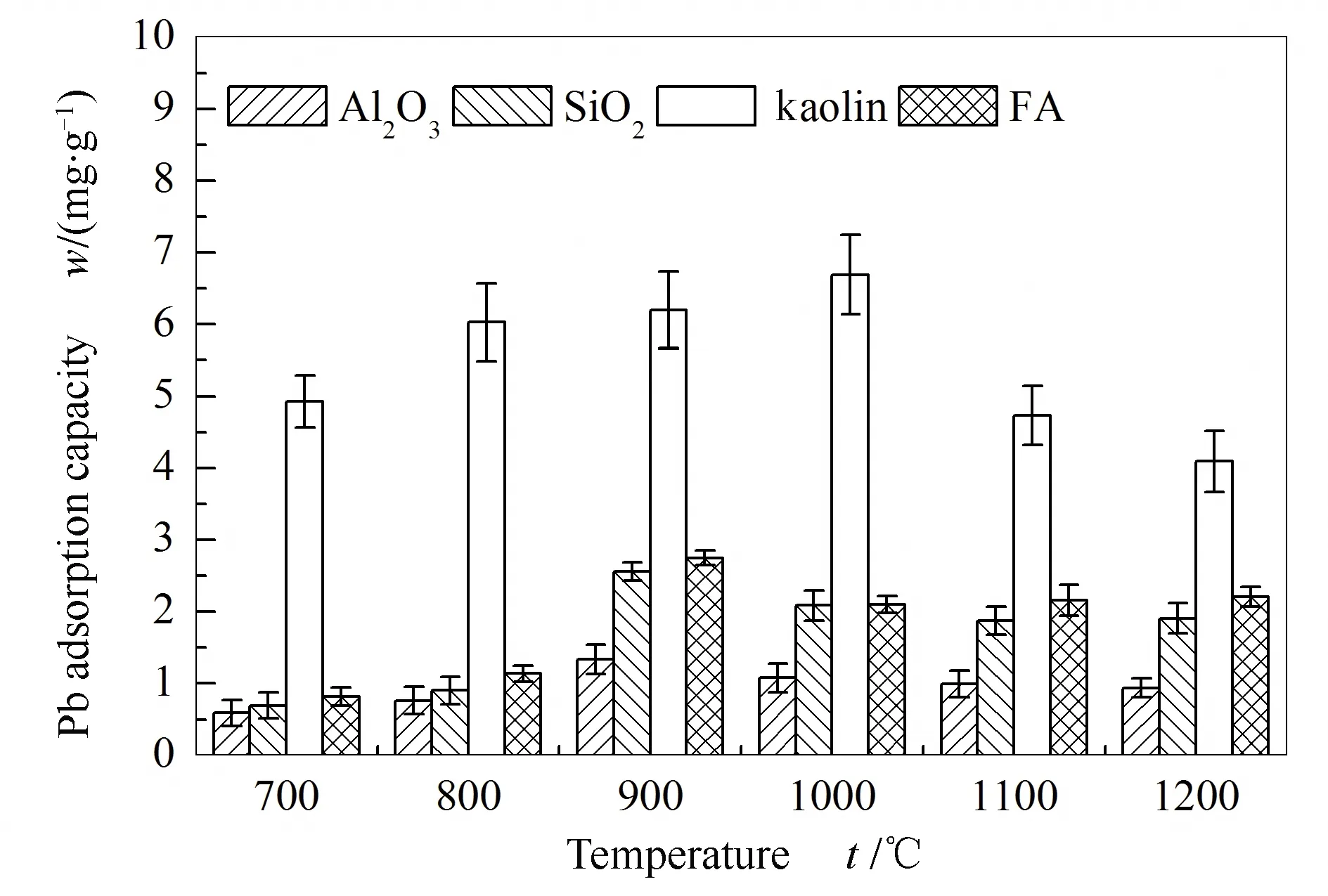
图9 700-1200 ℃下Si/Al基吸附剂的铅吸附容量
现有的文献报道主要集中于单一矿物质氧化物吸附重金属特性研究,然而在实际煤燃烧过程中,矿物质之间存在显著交互作用,并且矿物质交互作用影响飞灰颗粒物的矿物质存在形式和重金属吸附能力[30]。此外,在实际燃煤锅炉中,飞灰矿物质先经历炉膛高温阶段,再到烟气中吸附重金属。基于上述考虑,实验探究了典型Si-Al基吸附剂在900 ℃ 的吸附铅特性,结果见图10。
由图10可知,900 ℃的气相铅吸附容量:M>SiO2>Al2O3>CaO>MgO,这与图5一致,说明本次实验结果是可靠的。按质量分数50%SiO2/50%Al2O3制备的混合吸附剂的气相铅吸附容量明显高于单一吸附剂SiO2和Al2O3,这可能与SiO2和Al2O3之间存在交互作用有关,并且该交互作用促进气相铅的吸附。高温煅烧样品的铅吸附容量总体上低于未煅烧吸附剂,这可能与1300 ℃时大多数氧化物颗粒孔隙坍塌、颗粒熔融、晶体发生相变有关[25,26]。

图10 900 ℃下高温煅烧Si/Al基吸附剂的铅吸附容量
2.2.2 矿物质氧化物吸附铅的机理
图11为SiO2(001)和Al2O3(100)吸附PbO的稳定构型。由图11可知,吸附剂表面的Si、Al原子与PbO的O原子结合,生成新的Si-O、Al-O键,吸附能分别为-1080.93、-551.37 kJ/mol。结果表明,Si/Al基吸附剂表面的不饱和Si、Al原子是气相铅吸附的活性位点,气相铅的吸附为化学吸附。
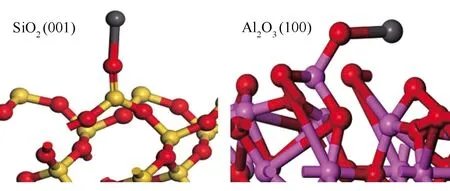
图11 SiO2(001)和Al2O3(100)吸附PbO的稳定构型
此外,Al2O3(100)面上掺杂Si原子后吸附PbO产物的稳定结构和电子密度见图12。
由图12可知,吸附剂表面不饱和Al和掺杂的Si为PbO吸附的活性位点,与图11中结果一致。Si原子掺杂有两种形式,分别为二配位Si和三配位Si,吸附能分别增加到-638.24、-1520.52 kJ/mol,高于SiO2(001)和Al2O3(100)吸附PbO的吸附能,说明向Al2O3切面掺杂Si原子,对PbO吸附具有促进作用,且三配位掺杂的Si更容易吸附PbO。
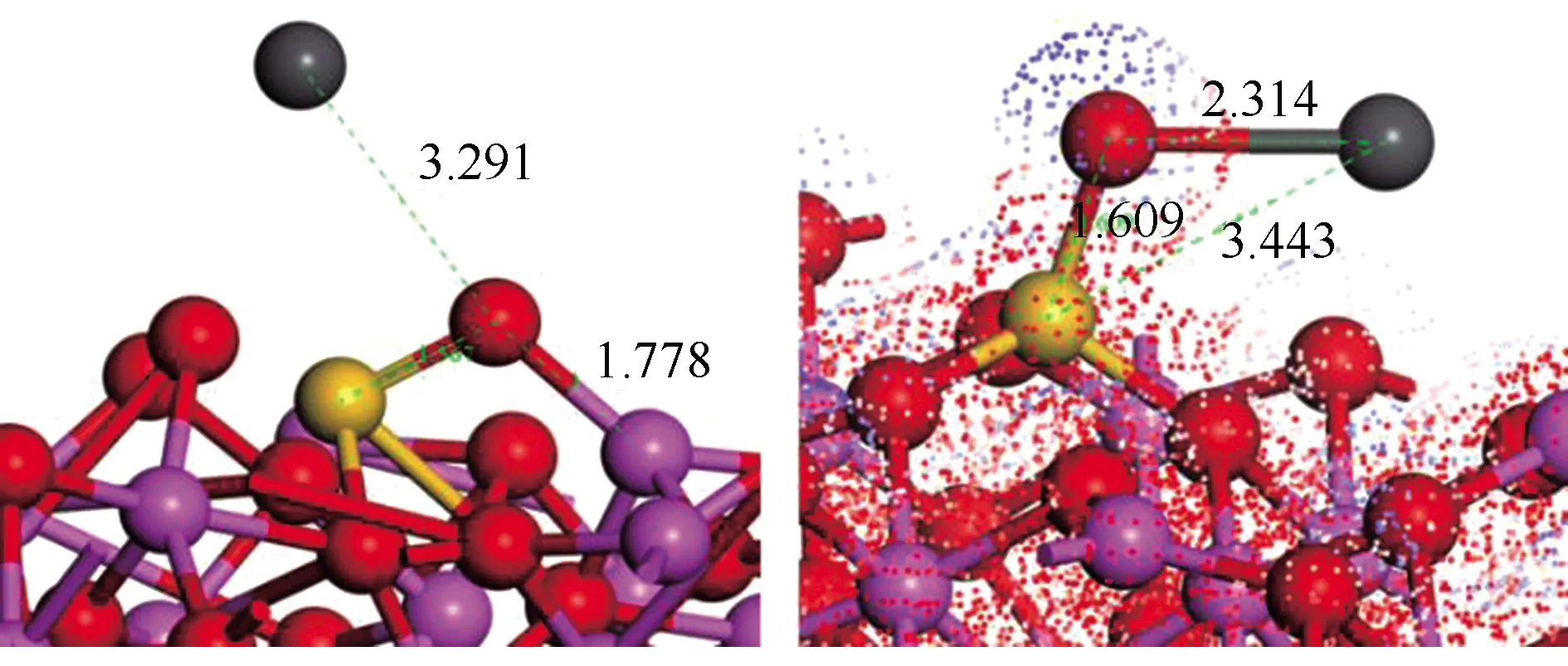
图12 Al2O3(100)面掺杂Si后吸附PbO的稳定构型
掺杂Si原子的Al2O3(100)面吸附PbO分子的电子轨道杂化情况见图13。由图13(a-1)-(a-3)可知,三配位掺杂Si后,掺杂的Si原子和邻位Al原子的p轨道与PbO分子上的O原子的p轨道在-5 eV附近出现杂化,说明掺杂后的二配位Si原子与相邻三配位Al原子均参与PbO的吸附,且Si原子的p轨道杂化峰强于Al原子,表明三配位掺杂Si对PbO的吸附能力强于邻位不饱和Al原子。图13(b-1)-(b-3)表明二配位掺杂Si原子后,掺杂Si和邻位Al均参与了PbO的吸附,而与三配位掺杂不同的是,二配位掺杂Si的p轨道杂化强度弱于Al,说明三配位掺杂比二配位掺杂更有利于PbO吸附,这与上述吸附能结果一致。

图13 Al2O3(100)面吸附PbO的态密度
值得注意的是,(a-4)和(a-5),(b-4)和(b-5)在-5 eV附近出现较弱的轨道杂化峰,结合图10,这是因为吸附反应结束时,Pb和表面O仍然处于游离态,计算完成时只有少许电子轨道重叠。
同理,向SiO2掺杂Al原子,由于SiO2晶胞原子数量较少,直接在对位四配位Si原子上置换两个Al原子,掺杂后各切面吸附PbO能量略有降低,分别为SiO2(100)面-549.59 kJ/mol、(010)面-476.90 kJ/mol、(001)面-495.84 kJ/mol,由掺杂分子能量和结构可以看出,掺杂Al原子与原Si原子均为稳定结构,掺杂后体系能量降低,体系更加稳定,因此向SiO2掺杂Al不能提高PbO的吸附效果。
不同温度下SiO2(001)面吸附PbO的自由能变化结果见表3。结果表明,温度从300 K升至1800 K,气相铅吸附的自由能由-173.36升至32.42 kJ/mol,当温度高于1300 K时,吸附反应的自由能为正值,不利于气相铅的吸附。
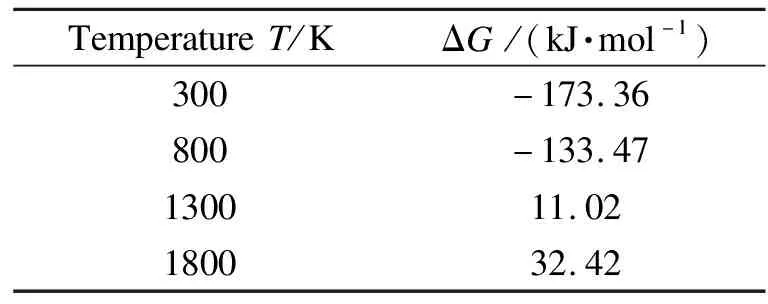
表3 不同温度下SiO2(001)吸附PbO的ΔG
图14为SiO2在1000 ℃条件下吸附PbO样品的XPS分析结果。Pb 4f结果具有双峰结构,分别为在139.15 eV位置的Pb 4f5/2和在143.95 eV位置的Pb 4f7/2,Pb为+2价对应Pb-O键。
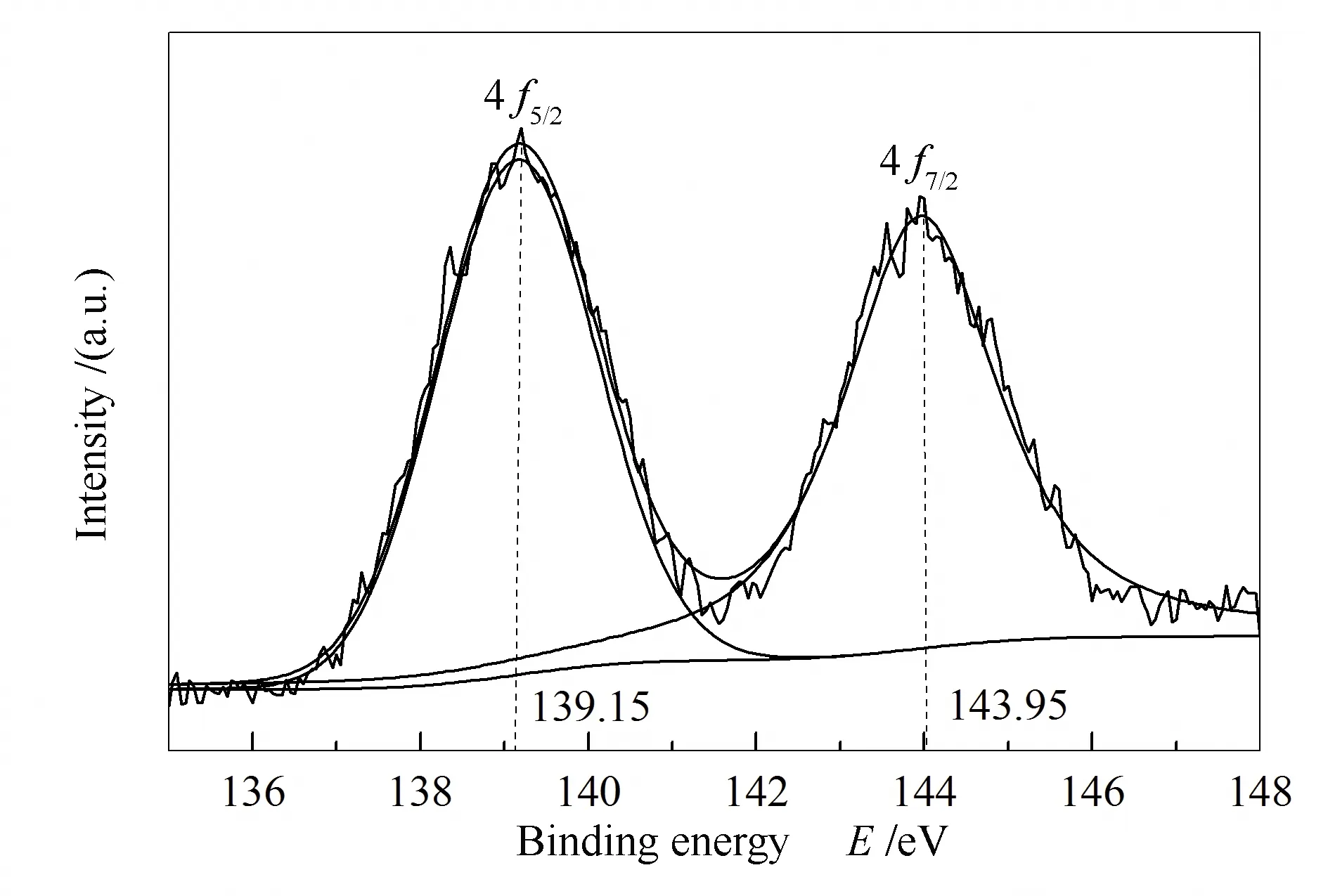
图14 SiO2在1000 ℃吸附PbO样品Pb 4f XPS谱图
综合分子模拟和实验结果可知,气相铅主要与Si/Al基吸附剂表面的不饱和Si、Al原子结合,生成稳定的铅酸盐化合物,产物中的铅以Pb2+形式存在。
3 结 论
在模拟的锅炉烟气气氛下,在300-700 ℃,气相砷的吸附容量:CaO>Fe2O3>Na2O>MgO>Al2O3>SiO2;CaO的砷吸附容量随温度升高而增加,在900 ℃时达5.25 mg/g;从计算获得的吸附能来看,Fe2O3>Na2O>CaO>Al2O3>MgO>SiO2,Fe2O3(001)面的吸附能为-358.00 kJ/mol,SiO2(001)面为-156.40 kJ/mol,均超过100 kJ/mol,为化学吸附;Na2O、CaO、MgO、Al2O3、SiO2吸附剂表面O原子,Fe2O3吸附剂表面Fe原子为气相砷吸附的活性位点;吸附的砷以Ca3(AsO4)2、FeAsO4、AlAsO4等形式存在。吸附能与吸附容量存在差异,这与吸附剂比表面积、实际吸附剂暴露的晶面情况以及吸附温度有关;吸附产物中的砷以As3+和As5+形式存在。
矿物质氧化物中SiO2和Al2O3吸附气相铅效果较好,700 ℃时铅吸附容量分别为2.56和1.34 mg/g;Si/Al基吸附剂中的高岭土对气相铅吸附效果最好,在1000 ℃达到峰值,为6.69 mg/g;飞灰的铅吸附效果仅次于高岭土,在900 ℃达到峰值,为2.74 mg/g;高温煅烧对吸附剂的气相铅吸附具有抑制作用,50%SiO2/50%Al2O3混合吸附剂的气相铅吸附容量显著提高,达2.59 mg/g,高于同种工况下SiO2的2.35 mg/g和Al2O3的1.46 mg/g;SiO2和Al2O3切面上暴露的不饱和Si/Al原子能够结合PbO分子的O原子,吸附能分别为-1080.93和-551.37 kJ/mol,为强化学吸附;温度由300 K升高到1800 K时,SiO2(001)面吸附PbO的自由能由-173.36升高到32.42 kJ/mol,高温不利于铅的吸附;向Al2O3掺杂Si促进气相铅吸附,其中,三配位掺杂的Si吸附能达-1520.52 kJ/mol,促进效果明显,而向SiO2掺杂Al对气相铅吸附没有促进效果;吸附产物中的铅以Pb2+形式存在。
猜你喜欢
杂志排行
燃料化学学报的其它文章
- Study on the environmental effects of heavy metals in coal gangue and coal combustion by ReCiPe2016 for life cycle impact assessment
- 复合聚并协同脱除燃煤颗粒物及颗粒态重金属的中试研究
- In-situ reaction between arsenic/selenium and minerals in fly ash at high temperature during blended coal combustion
- 典型钙/镁基吸附剂对二氧化硒吸附特性研究
- Speciation analysis of arsenic in coal and its combustion by-products in coal-fired power plants
- 燃煤烟气中As、Se、Pb的形态分布及S、Cl元素对其形态分布的影响
