基于网络药理学方法探讨莱菔子对胃肠动力的影响机制
2020-12-30龙超君白辰黄羚贺建祯刘邵阳崔丽军鲜馥阳汪伯川于河刘铁钢谷晓红
龙超君,白辰,黄羚,贺建祯,刘邵阳,崔丽军,鲜馥阳,汪伯川,于河,刘铁钢,谷晓红
基于网络药理学方法探讨莱菔子对胃肠动力的影响机制
龙超君,白辰,黄羚,贺建祯,刘邵阳,崔丽军,鲜馥阳,汪伯川,于河,刘铁钢,谷晓红
北京中医药大学中医学院,北京 100029
应用网络药理学方法探讨莱菔子对胃肠动力的影响及作用机制,指导莱菔子的临床应用。对炒莱菔子水煎液进行超高效液相色谱-四极杆飞行时间质谱(UPLC/Q-TOF-MS)分析,推断其化学成分;利用ChemSpider数据库获取莱菔子化合物属性,通过SwissTargetPrediction平台获取莱菔子潜在靶点;利用GeneCard、HPO数据库及PALM-IST、PolySearch2文献挖掘服务器获取胃肠动力相关基因;利用String数据库构建药物靶基因-胃肠动力基因网络,使用Cytoscape软件使网络可视化并进行网络拓扑分析,通过Metascape平台进行核心基因的功能和通路富集分析。筛选出与莱菔子相关的胃肠动力基因148个,与胃肠动力直接相关的莱菔子靶基因95个(含二者交集基因11个),基因功能和通路富集分析相关结果584条。莱菔子对胃肠动力具有多靶点、多通路的作用特点,其有效成分与5-羟色胺等神经活性物质具有一定的结构相似性,可能通过激活以cAMP/cGMP为第二信使的G蛋白偶联受体信号通路、Ca2+信号通路及其他阳离子通道,从而影响胃肠道平滑肌的收缩与舒张。
网络药理学;莱菔子;胃肠动力
莱菔子为十字花科植物萝卜L.的干燥成熟种子,味辛、甘,性平,归肺、脾、胃经,有消食除胀、降气化痰功效[1],是临床常用健胃消食药。明代兰茂《滇南本草》称莱菔子“下气宽中,消膨胀,消痰涎,消宿食,消面积滞,降痰,定吼喘,攻肠胃积滞”。张锡纯《医学衷中参西录》有“莱菔子炒熟为末,每饭后移时服钱许,借以消食顺气,转不伤气,因其能多进饮食,气分自得其养也”,指出莱菔子行气消食而不伤气。然而,莱菔子通过何种机制促进胃肠动力至今尚不明确。有研究认为,莱菔子可能通过其正己烷成分作用于M型受体、促进血浆胃动素(MTL)的分泌来促进胃肠动力,脂肪油可能是其发挥促进胃肠动力作用的主要成分[2]。
网络药理学融合系统生物学、药理学和信息技术,以构建“疾病-靶点-药物”网络为方法,从改善或恢复生物网络平衡角度认识药物与机体之间的作用关系,对生物系统网络进行整体分析,为中医药研究提供了新思路[3]。本研究利用网络药理学方法,构建莱菔子与胃肠动力相关的“疾病-基因-药物”网络,并对其进行基因功能与通路分析,针对莱菔子影响胃肠动力的作用机制提出合理假设。
1 资料与方法
1.1 莱菔子化合物信息收集与筛选
1.1.1 炒莱菔子水煎液化学成分分析
炒莱菔子样品(购自北京中医药大学国医堂)10 g,加100 mL纯水浸泡15 min,玻璃棒充分搅拌,于液体加热器第4档功率自动煎煮75 min,静置至常温,4 ℃冰箱保存,进样前用0.22 μm滤膜过滤。使用Agilent 1290超高效液相色谱仪、Agilent 6550 Q-TOF质谱仪,采用超高效液相色谱-四极杆飞行时间质谱法(UPLC/Q-TOF-MS)分析莱菔子水煎液。
色谱条件:Agilent Proshell 120 EC-C18色谱柱(3.0 mm×150 mm,2.7 μm),流动相A为0.1%甲酸-水、B为0.1%甲酸-甲醇,梯度洗脱(0~2 min,15%~45%B;2~8 min,45%~72%B;8~25 min,72%~95%B;25~30 min,95%~100%B),检测波长为210、255、260、278、282、323、326、330 nm,柱温35 ℃,流速0.6 mL/min,进样量2 μL。
质谱条件:Dual AJS ESI离子源,正离子和负离子模式分别检测,雾化器压力35 psig,干燥气温度200 ℃,干燥气流速14 L/min,鞘气温度350 ℃,鞘气流速11 L/min,碎裂电压380 V,毛细管电压3000 V,喷嘴电压1000 V,扫描范围50~1500 m/z,采集频率1.5 spectra/s,Transients 3987,碰撞能量0 V。
有对照品物质的峰,通过对比紫外吸收、保留时间及质谱裂解信息进行鉴定;无对照品的,通过每个谱峰的保留时间和一级质谱数据与文献中的已知化合物进行对比鉴定。
1.1.2 莱菔子化合物成分筛选
依托ChemSpider平台(http://www.chemspider. com/),根据Lipinski类药五原则对化合物进行筛选:分子量(MW)<500,氢键给体数目(Hdon)<5,氢键受体数目(Hacc)<10,脂水分配系数(LogP)<5,可旋转键的数量(FRB)≤10。得到的化合物下载其MOL结构以备后续靶点预测。
1.2 胃肠动力相关基因获取
采用数据库检索和文献挖掘方式获取胃肠动力相关靶点。利用HPO数据库[4]、GeneCards数据库[5]、奇恩生物表型诊断工具[6]、Polysearch2文献挖掘工具[7]及PALM-IST文献挖掘工具[8],以“Gastrointestinal mobility”“Abnormal gastrointestinal motility”“Gastrointestinal dysmobility”“Gastrointestinal peristalsis”为检索词,在默认检索条件下获取胃肠动力相关基因,取其并集,剔除重复结果后,利用Uniprot数据库[9]的Retrieve/ID Mapping功能,参数设置为从基因名(Genename)到Uniprot数据库(UniprotKB)批量检索,剔除未经注释(Unreviewed)或不属于人类的基因。
1.3 莱菔子作用于胃肠动力靶点预测与筛选
依托SwissTargetPrediction平台[10],输入各化合物的MOL结构,通过模拟计算比较莱菔子化学成分与已知配体的结构相似性,推断该化合物的受体(靶蛋白)。取各化合物靶基因中Probabilty>0.1的靶点作为莱菔子的候选作用靶点。将所有靶点通过Uniprot数据库检索,剔除未经注释及不属于人类的靶点。
利用String数据库[11],以0.9作为最低交互得分,选择数据库(Databases)、实验(Experiments)及文献挖掘(Textmining)为网络节点的联系来源,构建胃肠动力相关基因与莱菔子候选作用靶点网络,并利用Cytoscape3.7.0软件[12]构建“疾病-靶点-药物(化合物)”可视化网络,并利用Cytoscape的MCODE拓展功能筛选核心网络节点。将含有靶基因名称与基因类别的文本文档导入Cytoscape3.7.0,为该网络各节点赋予类别(莱菔子靶基因或胃肠动力靶基因)后,剔除疾病靶点-疾病靶点、药物靶点-药物靶点的联系,最终得到莱菔子作用于胃肠动力的核心靶点。
1.4 基因功能和通路富集分析
从“疾病-靶点-药物”网络中选取MCODE得分最高的第一聚类相关基因,利用Metascape平台[13]进行分析,对分析结果利用Cytoscape的MCODE功能进行筛选,获取基因功能和通路的核心环节。
2 结果
2.1 莱菔子活性成分及相关属性
经UPLC/Q-TOF-MS分析,从炒莱菔子水煎液中共推断出21种化合物。其中,18种化合物通过文献及数据库[14-16]比对得出,3种化合物通过与对照品比对鉴定得出,未发现新化合物。莱菔子水煎液总离子流图见图1。
根据Lipinski类药五原则对所得化合物进行筛选后,得到莱菔子活性成分12个,见表1。
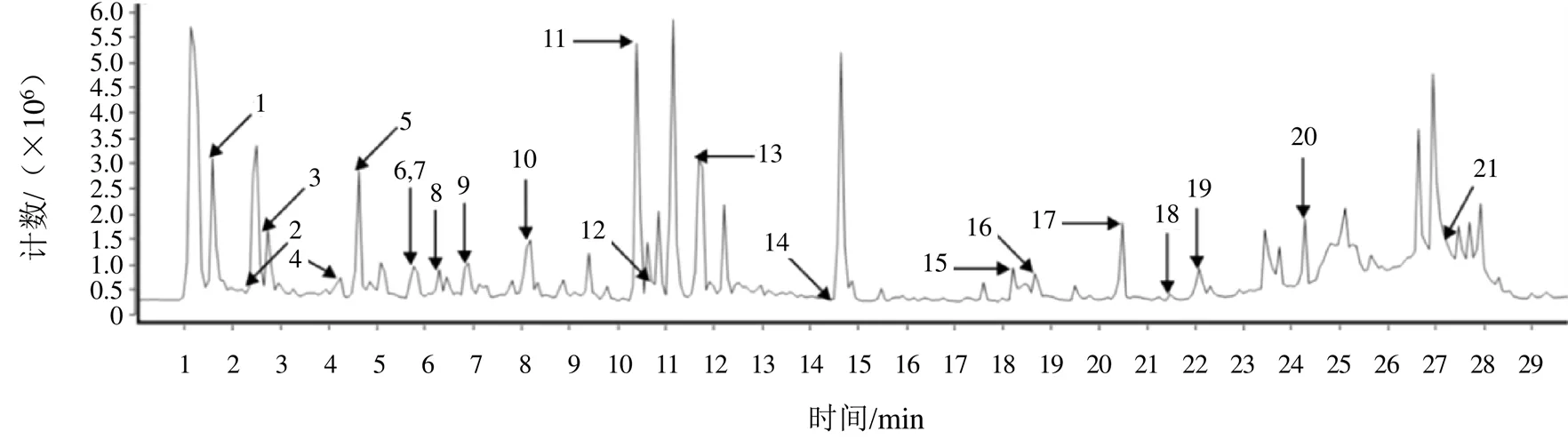
注:1. Raphanin Glucosinolate;2. (2,4-Dimethyl-1,3-thiazol-5-yl)methanol;3. 3-Amino-phenylpropionic acid;4. Sulforaphane;5. Methylnicotinate;6. 5-(Hydroxymethyl)-5-nonanaminium;7. [2-(2-Methoxy-2-oxoethyl)phenyl]acetate-β-D-glucose;8. Sinapine thiocyanate;9. 1-O-sinapoyl-β-D-glucose;10. Methyl [3-oxo-1-(4-oxo-3-4-(5-{[7-Methyl-3-oxo-5-phenyl-6-(phenylcarbamoyl)-5H-[1,3]thiazolo[3,2-a]pyrimidin-2(3H)-ylidene]methyl}-2-furyl)benzoic acid;11. Cyclo(D-leucyl-L-leucyl-L-leucyl-L-leucyl-L-leucyl-L-leucyl);12. 4-Acetyl-3-methoxy-5-methylbenzoate-β-D-glucose;13. 1,8,15,22-Tetraazacyclooctacosane-2,9,16,23-tetrone;14. 1-[5-(Ethylsulfonyl)-1,3,4-oxadiazol-2-yl]ethanaminium;15. N-Hexylpropanamide;16. 1-Butyl-3-[2-(1-cyclohexen-1-yl)ethyl]urea;17. heliamine;18. N-Hexyl-1-phenyl-1-nonanamine;19. 2-(Octyloxy)-N-[2-(octyloxy)ethyl]ethanamine;20. Phthalic anhydride;21. 2-[{2-(Dimethylamino)-5-[(methoxyacetyl)amino]benzyl}(2-ethylbutanoyl)amino]-N,N-dimethylethanaminium
表1 莱菔子活性成分及其属性
编号分子式名称HaccHdonFRBlogP 1C6H12N3O3S1-[5-(Ethylsulfonyl)-1,3,4-oxadiazol-2-yl]ethanaminium623-0.70 2C6H11NOS(2,4-Dimethyl-1,3-thiazol-5-yl)methanol2110.38 3C9H11NO23 Amino-phenylpropionic acid3330.91 4C6H11NOS2Sulforaphane2050.23 5C7H7NO2Methyl nicotinate4132.50 6C10H23NO5-(Hydroxymethyl)-5-nonanaminium2372.58 7C17H22O101-O-sinapoyl-β-D-glucose10570.44 8C24H44N4O41,8,15,22-Tetrazacyclooctacosane-2,9,16,23-tetrone840-1.30 9C9H19NON-Hexylpropanamide2162.14 10C13H24N2O1-Butyl-3-[2-(1-cyclohexen-1-yl)ethyl]urea3263.50 11C11H15NO2Heliamine3121.14 12C8H4O3Phthalic anhydride3001.60
2.2 莱菔子靶基因-胃肠动力相关基因网络
2.2.1 莱菔子作用于胃肠动力的潜在靶点
从HPO数据库获得胃肠动力相关基因115个,从GeneCards数据库获得相关基因82个、从奇恩生物表型诊断工具获得相关基因75个、从Polysearch2文献挖掘工具获得相关基因8个,从PALM-IST文献挖掘工具获得相关基因506个。将所有结果取并集后删除重复值,剔除在Uniprot数据库中未经注释或非人类物种的基因,最终获得胃肠动力相关基因338个。
将莱菔子活性成分MOL结构导入SwissTargetPrediction平台筛选后得到莱菔子靶基因171个。将338个胃肠动力相关基因与171个莱菔子影响胃肠动力的候选作用靶点相匹配,剔除非核心靶点,最终获得莱菔子对胃肠动力的作用靶点95个(见表2),与这95个莱菔子作用靶点相关的胃肠动力基因148个(含二者交集基因11个)。
表2 莱菔子影响胃肠动力的95个潜在作用靶点
UniProt ID靶点名称MCODE得分 UniProt ID靶点名称MCODE得分 P089085-羟色胺受体1A(HTR1A)*30.00 P28482丝裂原活化蛋白激酶1(MAPK1)*4.23 P282225-羟色胺受体1B(HTR1B)30.00 P08514整合素α-Ⅱb(ITGA2B)4.17 P282215-羟色胺受体1D(HTR1D)30.00 Q92769组蛋白去乙酰化酶2(HDAC2)4.03 Q9UBS5γ-氨基丁酸B型受体1(GABBR1)30.00 P00533表皮生长因子受体(EGFR)4.00 O75899γ-氨基丁酸B型受体2(GABBR2)30.00 O96017丝氨酸/苏氨酸蛋白激酶Chk2(CHEK2)4.00 P41143δ型阿片受体(OPRD1)30.00 P42345丝氨酸/苏氨酸蛋白激酶mTOR(MTOR)4.00 P41145κ型阿片受体(OPRK1)30.00 P25774组织蛋白酶S(CTSS)4.00 P35372μ型阿片受体(OPRM1)30.00 P43405酪氨酸蛋白激酶(SYK)3.78 P21554大麻素受体1(CNR1)*30.00 P45983丝裂原活化蛋白激酶8(MAPK8)3.75 P34972大麻素受体2(CNR2)*30.00 O15379组蛋白去乙酰化酶3(HDAC3)3.67 P14416D(2)多巴胺受体(DRD2)30.00 P10275雄激素受体(AR)3.44 P35462D(3)多巴胺受体(DRD3)30.00 P07384钙激活的中性蛋白酶1(CAPN1)3.43 P21917D(4)多巴胺受体(DRD4)30.00 O14757丝氨酸/苏氨酸蛋白激酶Chk1(CHEK1)3.43 P41146孤啡肽受体(OPRL1)30.00 P50750细胞周期蛋白依赖性激酶9(CDK9)3.43 Q99705黑色素浓集激素受体1(MCHR1)30.00 O75376核受体辅助抑制因子Ⅰ(NCOR1)3.26 P30542腺苷受体A1(ADORA1)30.00 Q9Y618核受体辅助抑制因子Ⅱ(NCOR2)3.26 P0DMS8腺苷受体A3(ADORA3)30.00 O00519脂肪酸酰胺水解酶1(FAAH)3.00 Q9H3N8组胺H4受体(HRH4)30.00 P04066α-1-岩藻糖苷酶(FUCA1)3.00 P282235-羟色胺受体2A(HTR2A)26.00 P27487二肽基肽酶Ⅳ(DPP4)3.00 P415955-羟色胺受体2B(HTR2B)*26.00 O43451肠麦芽糖酶-葡糖淀粉酶(MGAM)3.00 P283355-羟色胺受体2C(HTR2C)26.00 P00488凝血因子ⅩⅢa(F13A1)3.00 P42336PI3-激酶亚基α(PIK3CA)26.00 P01375肿瘤坏死因子-α(TNF)*3.00 P35348α-1A肾上腺素能受体(ADRA1A)26.00 P49841糖原合成酶激酶-3β(GSK3B)2.86 P41594代谢型谷氨酸受体5(GRM5)26.00 Q00535细胞周期蛋白依赖性激酶5(CDK5)2.86 P25103P物质受体(TACR1)*26.00 P04150糖皮质激素受体(NR3C1)2.76 O436142型食欲肽受体(HCRTR2)26.00 Q08881酪氨酸蛋白激酶(ITK)2.70 O43193胃动素受体(MLNR)26.00 Q13547组蛋白去乙酰化酶1(HDAC1)2.50 P21731血栓烷A2受体(TBXA2R)26.00 P06493细胞周期蛋白依赖性激酶1(CDK1)2.46 P35367组胺H1受体(HRH1)26.00 Q92731雌激素受体β(ESR2)2.40 Q8TDU6G蛋白偶联胆汁酸受体1(GPBAR1)15.00 P11413葡萄糖-6-磷酸1-脱氢酶(G6PD)2.00 P08588β-1肾上腺素能受体(ADRB1)15.00 P07858组织蛋白酶B(CTSB)2.00 P13945β-3肾上腺素能受体(ADRB3)15.00 P43403酪氨酸蛋白激酶(ZAP70)1.71 Q16602降钙素基因相关肽1型受体(CALCRL)15.00 P47712磷脂酶A2组ⅣA(PLA2G4A)1.67 P07550β-2肾上腺素受体(ADRB2)*15.00 P31645钠依赖性血清素转运蛋白(SLC6A4)1.67 Q05193动力蛋白-1(DNM1) 7.00 P14410肠道蔗糖酶-异麦芽糖酶(SI)1.40 Q16572溶质载体家族18成员3(SLC18A3) 7.00 P08253基质金属蛋白酶-2(MMP2)1.40 P07900热休克蛋白HSP 90-α(HSP90AA1) 6.61 P49840糖原合成酶激酶-3α(GSK3A)1.40 P17252蛋白激酶Cα型(PRKCA) 6.00 Q96RI1维甲酸X受体相互作用蛋白14(NR1H4)1.07 Q6QHF9多胺氧化酶(PAOX) 5.00 P21397单胺氧化酶A型(MAOA)0.67 P34913双功能环氧化物水解酶2(EPHX2) 5.00 Q9HC29炎症性肠病蛋白质1(NOD2)0.67 P19793视黄酸受体RXR-α(RXRA) 5.00 P51449类视黄醇相关的孤儿受体-γ(RORC)0.67 O14965极光激酶A(AURKA) 5.00 Q96IY4羧肽酶B2(CPB2)0.67 P35228诱导型一氧化氮合酶(NOS2)* 5.00 P16581E-选择素(SELE)0.67 P05106整合素β-3(ITGB3) 4.91 P07099环氧化物水解酶1(EPHX1)0.50 Q00987E3泛素蛋白连接酶Mdm2(MDM2)* 4.76 P00797肾素(REN)*0.50 P78396细胞周期蛋白A1(CCNA1) 4.76 P49768早老素-1(PSEN1)0.33 P20248细胞周期蛋白A2(CCNA2) 4.36 P09874聚[ADP-核糖]聚合酶1(PARP1)0.29 P24941细胞周期蛋白依赖性激酶2(CDK2) 4.36
注:*莱菔子作用靶点与胃肠动力相关基因的交集
2.2.2 “疾病-靶基因-药物”可视化网络
将上述95个莱菔子作用靶点与148个胃肠动力基因利用String数据库构建“疾病靶点-药物靶点”网络,利用Cytoscape网络可视化工具导入化合物靶点预测结果,构建“化合物-基因-疾病”三元生物可视网络。各网络节点的大小由其连接度(相邻网络节点的数目)决定,节点尺寸越大则该节点连接度越高。为更直观地考察莱菔子影响胃肠动力的核心作用靶点,利用Cytoscape的MCODE功能对“化合物-靶基因-疾病”三元生物网络进行聚类分析,MCODE得分越高,表明该集合的靶点在该网络中占据核心地位的可能性越高。见图2。
作为网络节点,莱菔子化合物在网络中的连接度明显低于莱菔子靶基因及胃肠动力相关基因,因而在计算筛选核心靶点的过程中被剔除于核心靶点之外,故在核心靶点集合中未显示。
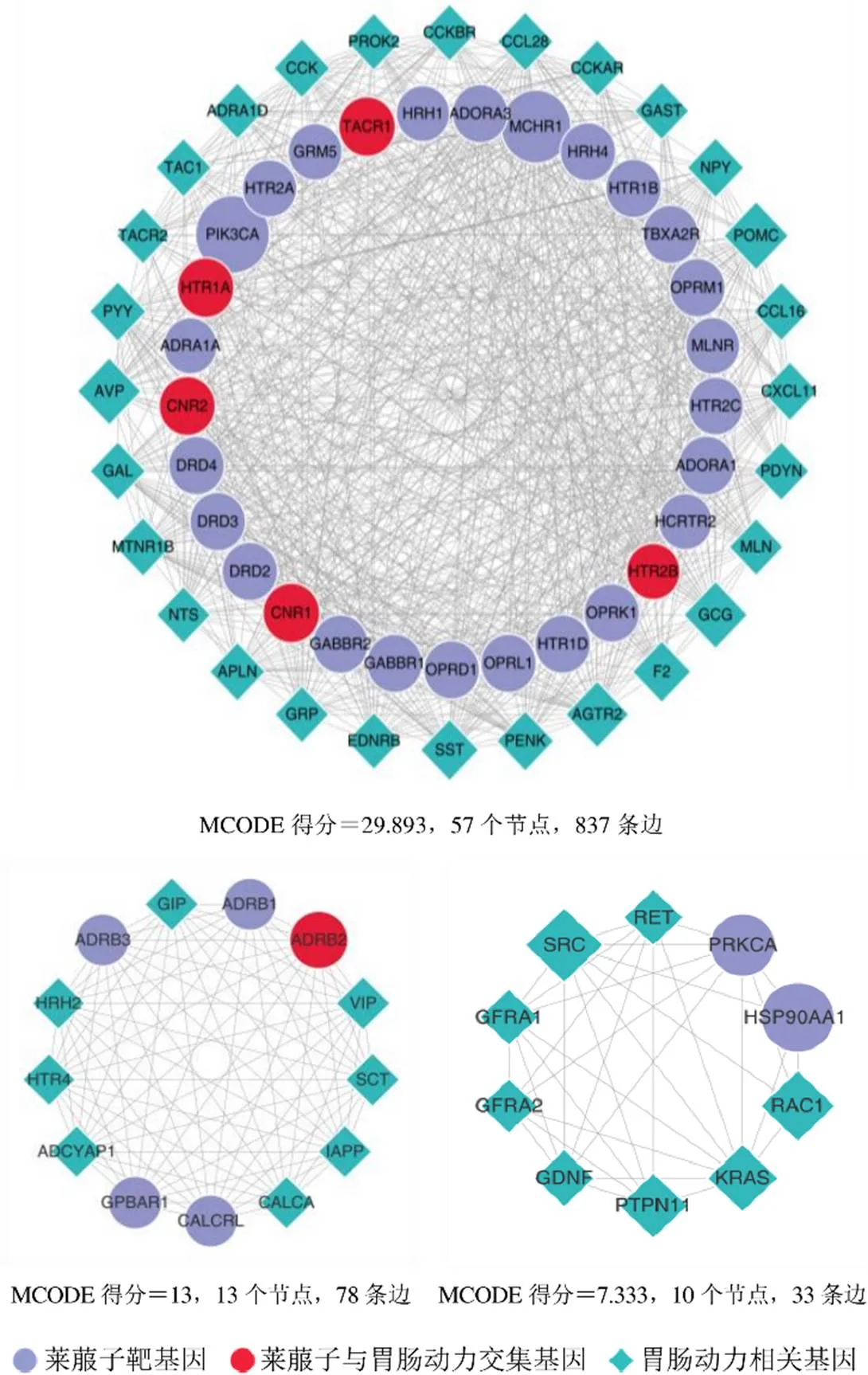
图2 莱菔子作用于胃肠动力“药物-基因-疾病”网络核心靶点聚类分析
2.3 基因功能与通路分析
从“药物-基因-疾病”网络中选择MCODE得分最高的集群中的57个相关基因,在Metascape平台进行基因功能与通路富集分析,得到584条结果,包括基因本体生物过程(GO-BP)结果548条(经MCODE筛选后得到核心条目31条)、京都基因与基因组百科全书(KEGG)结果18条、Reactome结果17条、经典信号通路1条。以logQ值(多次检验矫正后的值)的绝对值为横坐标,相关生物过程与信号通路为纵坐标,得到基因功能与通路分析结果,见图3~图5。
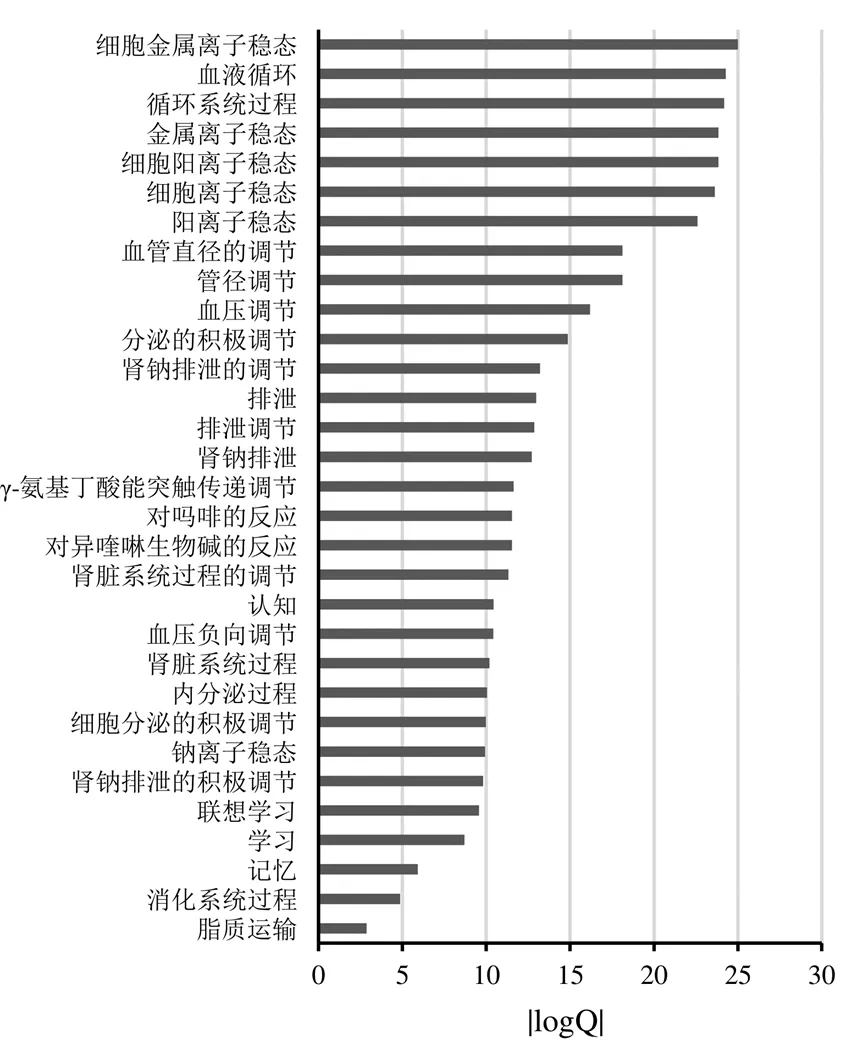
图3 莱菔子作用于胃肠动力核心靶点GO-BP富集结果

图4 莱菔子作用于胃肠动力核心靶点KEGG富集结果
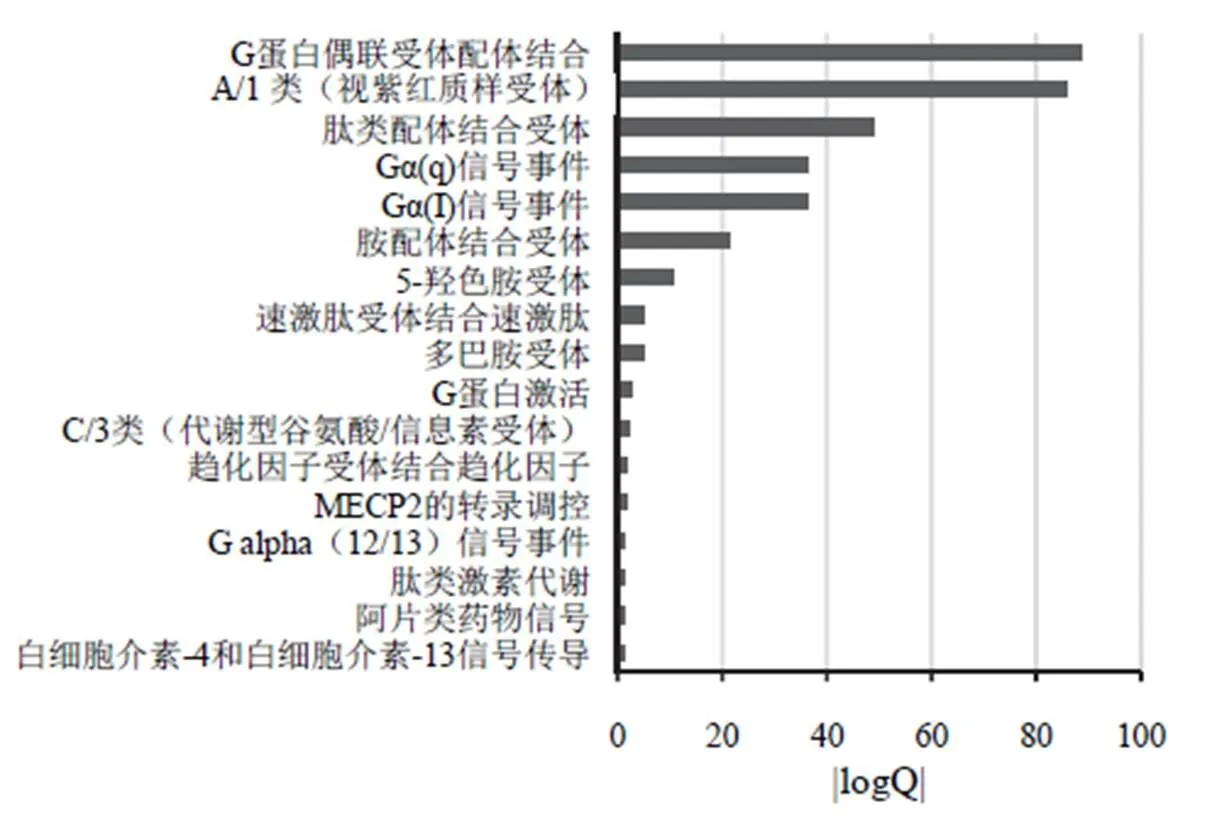
图5 莱菔子作用于胃肠动力核心靶点Reactome富集结果
3 讨论
莱菔子为药食同源。《老老恒言》收录莱菔子粥(莱菔子、粳米),主治腹胀、咳嗽痰多。黄元御《玉楸药解》称莱菔子“味辛、气平,入手太阴肺经,辛烈疏利,善化痰饮,最止喘嗽,破郁止痛,利气消谷”。朱丹溪以莱菔子配山楂、神曲、半夏等,命名保和丸,专治食积纳呆。莱菔子对胃肠动力具有促进作用已成为基本共识。然而,莱菔子究竟如何作用于胃肠动力、二者之间有着怎样的生物关系网络仍未明晰。
胃肠运动受神经和体液多种因素的调节。胃肠道神经-Cajal间质细胞-平滑肌网络是调节胃肠道运动的主力。胃肠运动相关神经递质与Cajal间质细胞表达的受体结合,并通过Cajal间质细胞与平滑肌细胞之间的缝隙连接传导兴奋性或抑制性连接电位导致相邻的平滑肌细胞激活[17],从而实现胃肠运动的传导。目前发现Cajal间质细胞膜表面表达多种调节平滑肌收缩的G蛋白偶联受体(GPCR),如嘌呤能受体、胆碱能受体、神经激肽受体(P物质等)、5-羟色胺(5-HT)能受体等,GPCR及cAMP/cGMP第二信使相关信号传导可以实现对胃肠平滑肌的调控[18]。
本研究通过网络药理学方法获得了莱菔子影响胃肠动力的作用靶点及相关基因功能与信号通路。我们选用莱菔子水煎液进行液相分析获取其有效成分,经文献及数据对比证实鉴定结果可靠,更符合临床实际,又能避免直接检索数据库及文献造成的冗余。此外,不同于常见的利用药物与疾病靶基因交集作为研究对象,本研究利用String数据库获取与胃肠动力基因直接相关的莱菔子靶基因,缩小了潜在有效的药物靶基因被剔除的可能性。最后,我们将“药物-靶基因-疾病”网络中相对核心的药物靶基因与疾病基因共同作为富集分析对象,将疾病基因纳入分析范围,有助于推测药物作用于疾病靶点后的级联反应,从而反映莱菔子在促进胃肠动力同时的附加治疗作用。
根据莱菔子靶点预测及富集分析结果推断,莱菔子的活性成分与5-HT等神经活性物质具有一定的结构相似性,可以与胃肠道神经的5-HT类受体、γ-氨基丁酸受体、大麻素受体、多巴胺受体、P物质受体、肾上腺素能受体等G蛋白偶联受体(以视紫红质样受体为主)结合。除多巴胺受体与肾上腺素受体外,上述受体对胃肠运动均有相应的促进作用[18-24]。莱菔子可能通过与G蛋白偶联受体(以视紫红质样受体为主)偶联,激活cAMP/cGMP及其相关的蛋白激酶后,激活相关Ca2+及其他阳离子通道,并通过间隙连接传导神经电刺激,影响胃肠道平滑肌细胞的电节律,从而影响胃肠道平滑肌的收缩与舒张。这一过程往往伴随对人体其他生命活动的影响(见图6)。

图6 莱菔子作用于胃肠动力cAMP及其相关信号通路示意图
莱菔子的基因富集分析结果提示,莱菔子在影响胃肠动力的同时往往伴随着对血压的负性调节,这可能是莱菔子作用于血管平滑肌上的G蛋白偶联受体后激活cAMP/cGMP信号通路及钙信号通路导致血管舒张造成的。莱菔子对肾素(REN)、血栓素A2受体(TBXA2R)、凝血因子13(F13A1)的作用可能在这一过程中扮演重要角色。现代药理研究及临床实践发现,莱菔子具有降血压及血管内皮保护作用[25-26]佐证了这一分析结果。这与中医“血为气之母,气为血之帅”的内涵相契合,人体气机得以疏利,血液运行与血管状态也随之受影响。
结合图6可知,以cAMP/cGMP为第二信使的G蛋白偶联受体的信号传导涉及细胞增殖、分化、凋亡等重要生理过程。因此,从某种层面上,莱菔子或许可与多种病理生理状态相联系。例如cAMP通过调节蛋白质降解以预防阿尔茨海默病、帕金森病等慢性神经退行性疾病[27],本研究对莱菔子的靶点基因富集结果提示莱菔子对认知、学习和记忆可能具有一定影响。实验研究表明,莱菔子所含莱菔硫烷有很强的生物活性,对神经元和神经胶质细胞具有保护作用[28],国内已有学者申请了莱菔子有效成分用于制备治疗脑萎缩的药品专利[29]。此外,cAMP信号传导在肿瘤及心血管疾病中也扮演着重要角色[30],相应地,对莱菔子的抗肿瘤作用早已进行挖掘研究[31],其降压和血管内皮保护作用已被充分利用[25-28]。
另外,莱菔子还具有抗感染、止咳化痰作用[32-33]。本研究结果显示,莱菔子对胃肠动力的作用靶点5-HT受体、组胺受体、肿瘤坏死因子-α(TNF-α)、蛋白激酶Cα型(PRKCA)、诱导型一氧化氮合酶(iNOS)在炎症相关信号传导方面扮演着重要角色[34-35]。这与中医“肺胃同治”思想内核一致。由紫苏子、莱菔子、芥子组成的三子养亲汤,以肺胃同治为法,降气消食,温化痰饮,消胀定喘。现今许多止咳化痰平喘经验方亦多效仿此法,以莱菔子为君药奏止咳定喘之功[36-37]。本课题组长期致力于研究肺胃积热证经验方银莱汤,以金银花、莱菔子为君,配伍连翘、黄芩、前胡、鱼腥草、瓜蒌,两清肺胃、消积化滞,临床疗效令人满意[38-39]。上述研究结果与中医整体观及现代生物学的系统论相吻合。
总而言之,本研究基于虚拟筛选和数据挖掘提出莱菔子调节胃肠功能的可能机制,并基于相关信号通路和生物过程归纳莱菔子增强胃肠动力及其附加功效,提示莱菔子对胃肠动力具有多靶点、多通道的作用特点,可为后续实验研究及临床实践提供参考。当然,靶点预测由于复杂的计算过程存在假阳性可能,现有基因功能、信号通路数据库也可能存在对热点研究问题的偏倚,故本研究提出的观点仍需后续实验验证。莱菔子与在胃肠平滑肌运动中发挥重要作用的Cajal间质细胞的具体关系仍有待探索,这或许可以成为后续研究的出发点。如何利用胃肠动力与感染的关系阐释中医“肺胃同治”的前瞻性,亦可作为后续研究的重点。
[1] 国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2015:272.
[2] 唐健元,张磊,彭成,等.莱菔子行气消食的机制研究[J].中国中西医结合消化杂志,2003,11(5):287-289.
[3] 张雨,李恒,李克宁,等.复方中药网络药理学的研究进展[J].中成药, 2018,40(7):1584-1588.
[4] KÖHLER S, CARMODY L, VASILEVSKY N, et al. Expansion of the Human Phenotype Ontology (HPO) knowledge base and resources[J]. Nucleic Acids Research,2019,47(D1):D1018-D1027.
[5] STELZER G, ROSEN N, PLASCHKES I, et al. The GeneCards suite:from gene data mining to disease genome sequence analyses[J]. Current Protocols in Bioinformatics,2016,54(1):1.30.1-1.30.33.
[6] LI Q, ZHAO K, BUSTAMANTE C D, et al. Xrare:a machine learning method jointly modeling phenotypes and genetic evidence for rare disease diagnosis[J]. Genetics in Medicine,2019,21:2126-2134.
[7] LIU Y, LIANG Y, WISHART D. PolySearch2:a significantly improved text-mining system for discovering associations between human diseases, genes, drugs, metabolites, toxins and more[J]. Nucleic Acids Research,2015,43(W1):W535-W542.
[8] MANDLOI S, CHAKRABARTI S. PALM-IST:pathway assembly from literature mining - an information search tool[J]. Scientific Reports,2015,5:10021.
[9] UP Consortium. UniProt:the universal protein knowledgebase[J]. Nucleic Acids Research,2017,45(D1):D158-D169.
[10] DAINA A, MICHIELIN O, ZOETE V. SwissTargetPrediction:updated data and new features for efficient prediction of protein targets of small molecules[J]. Nucleic Acids Research,2019,47(W1):W357- W364.
[11] SZKLARCZYK D, MORRIS J H, COOK H, et al. The STRING database in 2017:quality-controlled protein-protein association networks, made broadly accessible[J]. Nucleic Acids Research, 2017,45(D1):D362-D368.
[12] SHANNON P, MARKIEL A, OZIER O, et al. Cytoscape:a software environment for integrated models of biomolecular interaction networks[J]. Genome Research,2003,13(11):2498-2504.
[13] ZHOU Y, ZHOU B, PACHE L, et al. Metascape provides a biologist- oriented resource for the analysis of systems-level datasets[J]. Nature Communications,2019,10(1):1523.
[14] SHAM T T, YUEN A C Y, NG Y F, et al. A review of the phytochemistry and pharmacological activities of Raphani Semen[J]. Evidence- Based Complementary and Alternative Medicine,2013,2013:636194.
[15] JUNG Y W, LEE J-S, ZHAO B T, et al. Quantitative and pattern recognition analyses of five marker compounds in Raphani Semen using high-performance liquid chromatography:analyses of compounds in Raphani Semen by HPLC[J]. Bulletin of the Korean Chemical Society,2015,36(9):2307-2319.
[16] 中国科学院上海有机化学研究所.上海有机所化学专业数据库.植物化学成分数据库[DB/OL].[2019-10-31].http://www.organchem.csdb. cn/scdb/main/plant_introduce.asp.
[17] WARD S M. Interstitial cells of Cajal in enteric neurotransmission[J]. Gut,2000,47(Suppl 4):40-43.
[18] 尹晓岚,唐旭东,王凤云,等.功能性消化不良平滑肌舒缩障碍中G蛋白偶联信号转导机制的研究进展[J].世界华人消化杂志,2016,24(6):886-893.
[19] MCLEAN P G, BORMAN R A, LEE K. 5-HT in the enteric nervous system:gut function and neuropharmacology[J]. Trends in Neurosciences,2007,30(1):9-13.
[20] VIANNA C R, DONATO J, ROSSI J, et al. Cannabinoid receptor 1 in the vagus nerve is dispensable for body weight homeostasis but required for normal gastrointestinal motility[J]. Journal of Neuroscience,2012,32(30):10331-10337.
[21] AUTERI M, ZIZZO M G, SERIO R. GABA and GABA receptors in the gastrointestinal tract:from motility to inflammation[J]. Pharmacological Research,2015,93:11-21.
[22] BARTHÓ L, HOLZER P. Search for a physiological role of substance P in gastrointestinal motility [J]. Neuroscience,1985, 16(1):1-32.
[23] GLAVIN G B, SZABO S. Dopamine in gastrointestinal disease[J]. Digestive Diseases and Sciences,1990,35(9):1153-1161.
[24] TANAKA Y, HORINOUCHI T, KOIKE K. New insights into β- adrenoceptors in smooth muscle:distribution of receptor subtypes and molecular mechanisms triggering muscle relaxation:β- adrenoceptors and smooth muscle relaxation[J]. Clinical and Experimental Pharmacology and Physiology,2005,32(7):503-514.
[25] 葛亚如,郭炜,董文亮,等.莱菔子降压机制研究与临床应用进展[J].中国中医药现代远程教育,2015,13(12):152-153.
[26] 杨雯晴.藤菔降压片治疗高血压病肝阳上亢证的临床基础及实验研究[D].济南:山东中医药大学,2014.
[27] HUANG H, WANG H, FIGUEIREDO-PEREIRA M E. Regulating the ubiquitin/proteasome pathway via cAMP-signaling:neuroprotective potential[J]. Cell Biochemistry and Biophysics,2013,67(1):55- 66.
[28] 孟鑫雨,王金库,刘旭,等.莱菔硫烷神经保护作用研究进展[J].中医药信息,2016,33(2):108-111.
[29] 徐华民,徐萌.莱菔子有效成分用于制备治疗脑萎缩的药品:CN102068424A[P].2011-05-05.
[30] DEMA A, PERETS E, SCHULZ M S, et al. Pharmacological targeting of AKAP-directed compartmentalized cAMP signalling[J]. Cellular Signalling,2015,27(12):2474-2487.
[31] 胡延雷,张小林,高艳.抗癌物质莱菔子素的最新研究进展[J].化工中间体,2006(9):7-9.
[32] 谭鹏,薛玲,吕文海,等.莱菔子不同炮制品对呼吸系统作用的实验研究[J].山东中医杂志,2005,24(5):300-302.
[33] 王婧,王敏,范玉敏,等.TLR-MyD88通路在COPD炎症反应中的作用及莱菔硫烷的抗感染效果[J].中国老年学杂志,2018,38(9):2184-2187.
[34] 王应灯,孙耕耘.G蛋白偶联受体激酶活性调控与细胞炎性损伤[J].中国药理学通报,2003,19(8):855-858.
[35] BOGDAN C. Nitric oxide and the immune response[J]. Nature Immunology,2001,2(10):907-916.
[36] 郑国华,王义珍.莱菔子散治疗支气管哮喘[J].陕西中医,2002, 23(3):270.
[37] 曹彦.王益谦运用莱菔子治疗小儿咳喘经验介绍[J].新中医,2003, 35(3):11.
[38] 肖荃月,于河,刘曜纶,等.谷晓红运用银莱汤加减治疗小儿发热[J].吉林中医药,2015,35(3):232-234.
[39] 吕国凯,于河,谷晓红.银莱汤加减治疗小儿肺胃积热型感冒40例病例系列研究[J].浙江中医药大学学报,2014,38(8):973-975.
Effect Mechanism of Raphani Semen on Gastrointestinal Mobility Based on Network Pharmacology Approach
LONG Chaojun, BAI Chen, HUANG Ling, HE Jianzhen, LIU Shaoyang, CUI Lijun, XIAN Fuyang,WANG Bochuan, YU He, LIU Tiegang, GU Xiaohong
To explore the effects and mechanism of Raphani Semen on gastrointestinal motility through application of network pharmacology approach; To guide the clinical application of Raphani Semen.Fried Raphani Semen decoction was analyzed by UPLC/Q-TOF-MS to infer its chemical constituents. ChemSpider database was used to obtain the properties of compounds of Raphani Semen, and the potential targets of Raphani Semen were obtained through the SwissTargetPrediction platform. The genes related to gastrointestinal mobility were obtained by GeneCard, HPO database and PALM-IST, PolySearch2 literature mining server. String database was used to construct the drug target gene- gastrointestinal motility gene network, and Cytoscape software was used to visualize the network and perform network topology analysis. The core gene function and pathway enrichment analysis were conducted through the Metascape platform.Totally 148 gastrointestinal mobility-related-genes were found in Raphani Semen, and 95 target genes of Raphani Semen were directly related to gastrointestinal motility, among which 11 intersection genes were screened out. 584 related results of gene function and pathway enrichment analysis were obtained.Raphani Semen has multi-target and multi-pathway effects on gastrointestinal motility, and its active ingredients have certain structural similarities with neuroactive substances such as 5-HT, which may affect the contraction and relaxation of smooth muscle of the gastrointestinal tract by activating G protein coupled receptor signaling pathway with cAMP/cGMP as the second messenger, Ca2+signaling pathway and other cation channels.
network pharmacology; Raphani Semen; gastrointestinal motility
R285.5
A
1005-5304(2020)12-0083-08
10.19879/j.cnki.1005-5304.201909360
国家自然科学基金(81973724);北京市科技专项(Z181100006218083)
刘铁钢,E-mail:liutiegang2009@163.com
(2019-09-25)
(2019-11-12;编辑:陈静)
