参麻益智方对血管性痴呆模型大鼠Nrf2/HO-1通路及小胶质细胞的影响
2020-12-30李琨裴卉曹宇马丽娜李浩
李琨,裴卉,曹宇,马丽娜,李浩
参麻益智方对血管性痴呆模型大鼠Nrf2/HO-1通路及小胶质细胞的影响
李琨1,裴卉2,曹宇2,马丽娜2,李浩2
1.北京开放大学,北京 100081;2.中国中医科学院西苑医院,北京 100091
观察参麻益智方对血管性痴呆(VaD)模型大鼠Nrf2/HO-1通路及小胶质细胞的影响,探讨其治疗VaD的分子机制。Wistar大鼠60只随机分为空白组、假手术组、模型组和参麻益智方低、中、高剂量组,各给药组给予相应剂量药物。大鼠采用微血栓栓塞法造模,给药4周后进行学习记忆能力测试,采用RT-qPCR和Western blot分别检测大鼠海马组织核因子E2相关因子2(Nrf2)、血红素加氧酶1(HO-1)基因和蛋白的表达,免疫组化检测小胶质细胞激活程度。与假手术组比较,模型组大鼠水迷宫实验逃避潜伏期均明显延长,海马组织Nrf2、HO-1蛋白和mRNA表达均明显升高,iba-1标记的小胶质细胞数量显著增多,标记程度增强,形态上胞体变圆,分支减少,差异有统计学意义(<0.05,<0.01);与模型组比较,参麻益智方中、高剂量组大鼠水迷宫实验逃避潜伏期均明显缩短,Nrf2蛋白和mRNA表达均明显升高,参麻益智方高剂量组大鼠HO-1 mRNA表达显著升高,参麻益智方中、高剂量组大鼠小胶质细胞被iba-1标记的程度减轻,数量减少,胞体变小,分支细长,差异有统计学意义(<0.05,<0.01)。参麻益智方可明显改善VaD大鼠模型学习记忆能力,其机制可能与参麻益智方促进Nrf2/HO-1通路蛋白及基因表达,以及抑制小胶质细胞过度激活而发挥抗炎、抗氧化应激作用相关。
参麻益智方;血管性痴呆;核因子E2相关因子2;血红素加氧酶1;小胶质细胞;大鼠
血管性痴呆(vascular dementia,VaD)是继发于缺血性和出血性脑血管疾病的认知损害[1]。VaD是发病人数仅次于阿尔茨海默病的痴呆类型,严重影响老年人的生命健康和生活质量。目前,VaD治疗主要依靠药物,常用药物包括胆碱酯酶抑制剂、兴奋氨基酸受体拮抗剂、促智药、钙离子拮抗剂等[2],尚无针对VaD的特效药物[3]。中医药在治疗VaD方面取得了较好的效果[4],参麻益智方由中国中医科学院西苑医院周文泉教授的经验方化裁而来[5]。参麻益智方临床治疗VaD可有效改善患者认知障碍等症状,提高MMSE量表积分[6]。脑卒中引起的脑损伤是VaD的直接原因,而氧化应激和炎症反应是加重脑卒中后脑损伤的重要机制,Nrf2/HO-1通路是抗炎抗氧化的主要通路。本研究观察参麻益智方对VaD模型大鼠Nrf2/HO-1通路及小胶质细胞的影响,从而明确参麻益智方治疗VaD的分子机制。
1 材料与方法
1.1 动物
SPF级健康雄性Wistar大鼠60只,鼠龄10周,体质量260~340 g,北京斯贝福生物技术有限公司,动物许可证号SCXK(京)2016-0002。饲养于清洁级动物室,自由摄食饮水。
1.2 药物
根据人与大鼠药物剂量换算,按3∶3∶3∶2比例取人参、天麻、鬼箭羽、川芎饮片共5.2 kg,饮片由中国中医科学院西苑医院中药房提供,纯净水浸泡,常规煎煮2次,合并2次药液,100 ℃恒温水浴箱浓缩至含原药材1 g/mL,4 ℃冰箱保存备用。
1.3 主要试剂与仪器
血红素加氧酶1(HO-1)兔多克隆抗体,美国Abcam公司,批号GR237605-11;核因子E2相关因子2(Nrf2)小鼠单克隆抗体,美国Abcam公司,批号GR293311-1;iba-1兔多克隆抗体,德国Proteintech公司,批号00024334。ZS-001型Morris水迷宫系统(北京众实迪创1056001),多功能酶标仪(美国BioTek Synergy HTX),SDS-PAGE电泳系统(美国Bio-Rad),凝胶成像系统(美国UVP EC3410),实时荧光定量PCR仪(瑞士Roche Light Cycler 96)。
1.4 分组、造模及给药
大鼠适应性喂养1周,按随机数字表法分为空白组、假手术组、模型组和参麻益智方低(3.3 g/kg)、中(6.6 g/kg)、高剂量组(16.5 g/kg),每组10只。参麻益智方低、中、高剂量组药物浓度依据人与大鼠药物剂量换算取得。采用微血栓栓塞法构建多梗死性痴呆和腔隙性脑梗死性痴呆大鼠模型[7]。自大鼠腹主动脉取血,静置24 h形成凝血块后生理盐水冲洗,取凝血块0.5 g,加入生理盐水10 mL,组织匀浆,200 μm细胞筛过滤备用。术前大鼠禁食8 h,腹腔注射4%水合氯醛0.9 mL/kg麻醉,颈部正中切口,分离右侧颈总动脉、颈外动脉,模型组和参麻益智方各剂量组夹闭右侧颈总动脉,结扎右侧颈外动脉,于结扎近心端注射制备好的凝血块0.3 mL,松开颈总动脉夹,伤口碘伏消毒后缝合皮肤。空白组不做任何处理,假手术组颈外动脉注射0.3 mL生理盐水后即缝合。术后第2日各给药组给予相应药物(6 mL/kg)灌胃,1次/d,连续4周,模型组及假手术组予等体积蒸馏水灌胃。
1.5 记忆功能检测
给药4周后,Morris水迷宫实验测定大鼠学习记忆能力,连续5 d依次将大鼠放入水迷宫进行定位航行实验,每日分别从水迷宫不同象限下水进行4次实验,计算平均逃避潜伏期。
1.6 Western blot检测核因子E2相关因子2、血红素加氧酶1蛋白表达
Morris水迷宫实验结束后,腹腔注射4%水合氯醛麻醉,大鼠主动脉灌流后固定取脑。每组取5只大鼠全脑石蜡包埋,切片后进行免疫组化检测。另5只分离右侧海马组织,液氮速冻后取部分组织RIPA裂解液裂解,超声破碎至底部无组织沉淀,制成海马组织匀浆。冰上孵育20 min,4 ℃、13 000 r/min离心20 min,取上清液,-80 ℃冰箱保存备用。BCA蛋白定量试剂盒进行蛋白定量,加入loading buffer,95 ℃处理5 min,-20 ℃冰箱保存。SDS-PAGF凝胶电泳,蛋白转膜至PVDF膜,TBST洗膜后将PVDF膜放入装有5%BSA湿盒中摇床孵育30 min,加一抗Nrf2、HO-1、GAPDH,摇床孵育30 min,4 ℃冰箱封闭过夜。TBST洗膜,5%BSA溶液摇床孵育30 min,加二抗,摇床孵育90 min,TBST洗膜。经增强型化学发光底物覆盖后,UVP凝胶成像系统成像,Image J图像分析系统进行条带灰度分析。
1.7 RT-qPCR检测核因子E2相关因子2、血红素加氧酶1 mRNA表达
取部分海马组织,Trizol试剂盒提取RNA,加入去RNA酶水溶解RNA,DNAaseⅠ去除样品中DNA,样品进行RNA琼脂糖凝胶电泳,紫外分光光度计观察显示18 s和28 s两条RNA条带,计算Ratio值在1.8~2.0,证明mRNA完整性好、纯度高。引物由北京中美泰和生物技术有限公司合成,Nrf2上游引物为5’-ATATACGCAGGAGAGGGAAG-3’,下游引物为5’-GTCTTCTGAGTGGCAGTGAT-3’;HO-1上游引物为5’-TCCCATCCTCATCACGTAAC-3’,下游引物为5’-CCAGGCATCTCCTTCCATTC-3’。RNA反转录为cDNA,PCR扩增反应体系分别加入2×Ex TaqMix(12.5 µL)、10 µmol/L上游引物及下游引物复合物(0.75 µL)及其对应的cDNA(1.0 µL),再加入ddH2O调节液体,总量至25 µL,阴性对照组不加模板RNA。液体充分混匀,置于PCR仪中94 ℃初始变性5 min,94 ℃、30 s→60 ℃、30 s→72 ℃、60 s,循环40次,4 ℃终止。120 V进行DNA琼脂糖凝胶电泳20 min,凝胶紫外分析仪成像。
1.8 免疫组化检测小胶质细胞激活程度
脑组织经脱水、透明、浸蜡、包埋、切片(厚度5 μm)处理后,按1∶500比例进行抗体稀释,加入一抗iba-1 20 µL,置于湿盒37 ℃孵育2 h,4 ℃过夜,次日于37 ℃复温45 min,PBS振荡清洗,每次5 min,连续5次,加入辣根过氧化物酶标记二抗20 µL,置于湿盒37 ℃孵育30 min,PBS振荡清洗,每次5 min,连续5次。滴加DAB工作液100 µL至切片组织变为黄褐色。
1.9 统计学方法
2 结果
2.1 参麻益智方对大鼠学习记忆能力的影响
与假手术组比较,模型组大鼠逃避潜伏期明显延长(<0.01);与模型组比较,参麻益智方高、中剂量组大鼠逃避潜伏期明显缩短,差异有统计学意义(<0.01,<0.05),参麻益智方低剂量组大鼠逃避潜伏期差异无统计学意义(>0.05)。结果见表1。
表1 各组大鼠Morris水迷宫实验逃避潜伏期比较(±s,s)
注:与假手术组比较,△△<0.01;与模型组比较,*<0.05,**<0.01
2.2 参麻益智方对核因子E2相关因子2、血红素加氧酶1蛋白表达的影响
与空白组比较,假手术组大鼠海马组织Nrf2、HO-1蛋白表达明显升高,差异有统计学意义(<0.05,<0.01);与假手术组比较,模型组大鼠海马组织Nrf2、HO-1蛋白表达均明显升高(<0.01);与模型组比较,参麻益智方中、高剂量组大鼠海马组织Nrf2、HO-1蛋白表达明显升高,差异有统计学意义(<0.05,<0.01)。结果见表2、图1。
表2 各组大鼠海马组织Nrf2、HO-1蛋白表达比较(±s)
注:与空白组比较,#<0.05,##<0.01;与假手术组比较,△△<0.01;与模型组比较,*<0.05,**<0.01
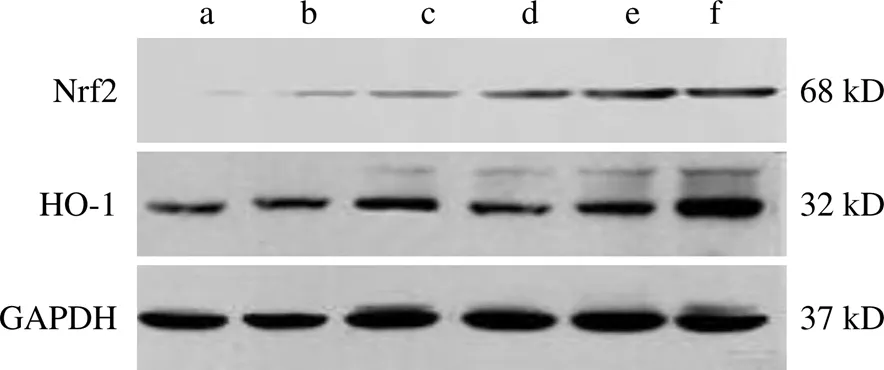
注:a.空白组;b.假手术组;c.模型组;d.参麻益智方低剂量组;e.参麻益智方中剂量组;f.参麻益智方高剂量组
2.3 参麻益智方对模型大鼠海马组织核因子E2相关因子2、血红素加氧酶1 mRNA表达的影响
与假手术组比较,模型组大鼠海马组织Nrf2、HO-1 mRNA表达均明显升高(<0.05,<0.01);与模型组比较,参麻益智方高、中剂量组大鼠海马组织Nrf2 mRNA表达明显升高(<0.01),参麻益智方高剂量组大鼠海马组织HO-1 mRNA表达明显升高(<0.01)。结果见表3、图2。
表3 各组大鼠海马组织Nrf2、HO-1 mRNA表达比较(±s)
注:与假手术组比较,△<0.05;△△<0.01;与模型组比较,**<0.01
注:a.空白组;b.假手术组;c.模型组;d.参麻益智方低剂量组;e.参麻益智方中剂量组;f.参麻益智方高剂量组
2.4 参麻益智方对模型大鼠海马组织小胶质细胞形态的影响
镜下观察海马CA1区iba-1标记的小胶质细胞显示,空白组、假手术组标记的小胶质细胞数量较少,胞体小,分支细而长;模型组较假手术组标记小胶质细胞数量显著增多,标记程度增强,形态上胞体变圆,分支减少;参麻益智方低剂量组小胶质细胞形态略变小,数量略减少;参麻益智方高、中剂量组较模型组小胶质细胞被iba-1标记的程度减轻,较模型组数量减少,胞体变小,分支细长。结果见图3。
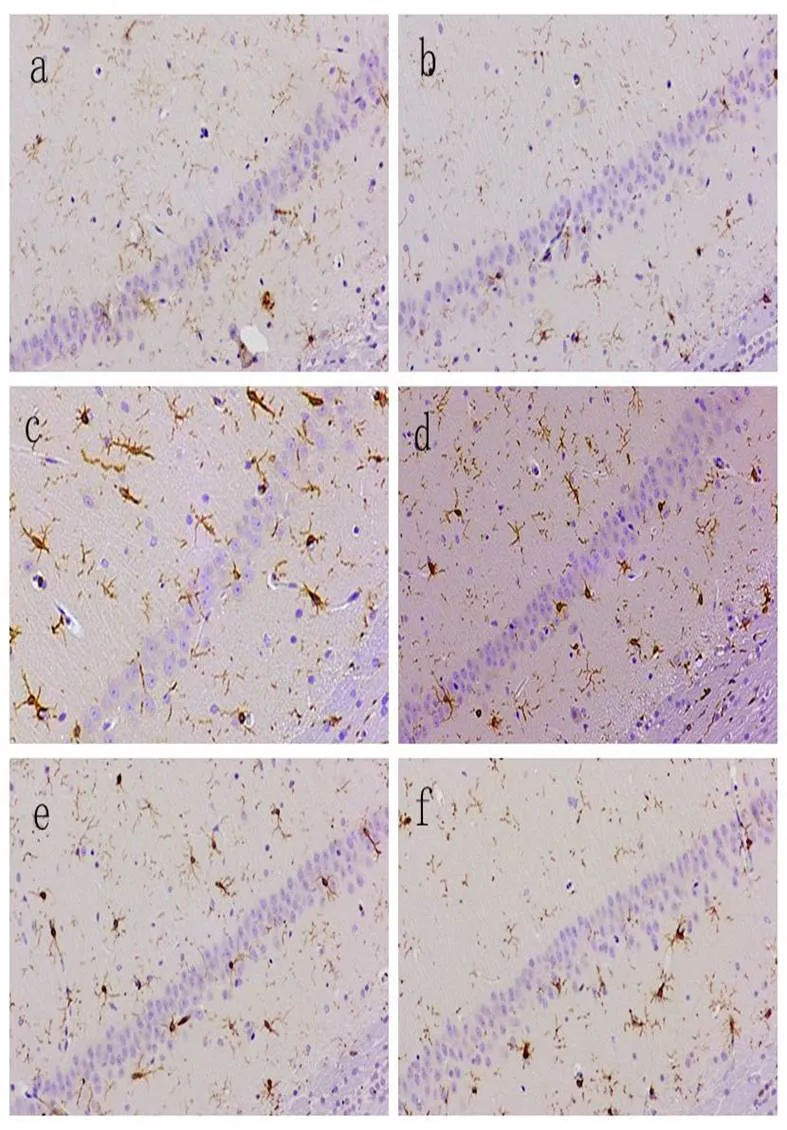
注:a.空白组;b.假手术组;c.模型组;d.参麻益智方低剂量组;e.参麻益智方中剂量组;f.参麻益智方高剂量组
3 讨论
Nrf2/HO-1信号通路是体内重要的抗炎、抗氧化通路,Nrf2是体内抗氧化应激、抗炎的关键性物质。Nrf2基因敲除小鼠VaD症状较野生型更重[8]。正常条件下Nrf2的Neh2功能区与Keap1 DGR功能区相连形成异二聚体,使Nrf2锚定于细胞质中。脑缺血缺氧时,Nrf2与Keap1解偶联,从而激活Nrf2,使Nrf2发生核转位,与ARE反应元件结合,从而激活下游200多种基因的表达[9]。HO-1是其中一种重要的酶,通过分解血红素的分解产物而产生抗炎、抗氧化的作用[10],HO-1在脑内主要分布于小胶质细胞及星形胶质细胞中。
本实验结果显示,模型组大鼠海马组织Nrf2、HO-1蛋白含量较假手术组、空白组高,提示缺血缺氧后Nrf2、HO-1表达升高,从而发挥抗氧化、抗炎作用;参麻益智方中、高剂量组大鼠海马组织Nrf2、HO-1蛋白表达较模型组明显升高,提示中、高剂量参麻益智方可提高大鼠海马组织内细胞Nrf2的表达,Nrf2在发生核转位后激活下游基因HO-1的表达,与胡跃强等[11]研究一致。免疫组化结果显示,与空白组及假手术组比较,模型组iba-1标记的小胶质细胞激活数量增多,胞体变圆,分支减少,呈阿米巴状,而参麻益智方中、高剂量组小胶质细胞胞体相对较小,分支多而长,激活数量减少,从组织层面提示参麻益智方可抑制小胶质细胞激活,减轻炎症反应。推测参麻益智方通过Nrf2/HO-1通路抑制炎症,从而抑制小胶质细胞的激活。为了进一步验证本结果,采用RT-qPCR检测Nf2、HO-1 mRNA表达,结果显示,参麻益智方中、高剂量组可提高Nrf2、HO-1 mRNA的表达,从基因层面提示参麻益智方通过Nrf2/HO-1通路发挥抗炎、抗氧化的作用,从而改善模型大鼠的学习记忆能力。
VaD属中医学“呆证”范畴,《素问•调经论篇》有“血并于下,气并于上,乱而喜忘”,《杂病源流犀烛•中风》“中风后善忘”。周文泉[12]认为VaD是脏腑功能失调,中风形成的病理产物痰浊瘀血停留于脑窍,形成窠囊,神明失用而致智能障碍,其病机以脏腑功能失调为本,以痰瘀阻络为标。
参芪益智方由人参、天麻、鬼箭羽、川芎4味药物组成,其主要功效是益气活血增智,其中君以人参,可大补元气、安神、益智。《神农本草经》记载人参“主补五脏,安精神,止惊悸,除邪气,明目,开心益智”。相关研究表明,人参有效成分可提高痴呆大鼠学习记忆能力,其机制与减轻炎症反应和抗氧化应激有关[13]。《名医别录》认为人参有“令人不忘”功效。臣以天麻,可平肝熄风止痉。《药性论》认为天麻可治疗“瘫缓不遂,语多恍惚,多惊失志”。川芎活血行气,上行头目,引药上入于脑,鬼箭羽破血通经,增强全方化瘀之力,二药共为佐使药。
VaD目前发病机制不明,西药治疗效果并不理想,而中医药对VaD有较好疗效,积极探索中医药治疗VaD机制,可为VaD的研究和治疗提供新思路。
[1] IEMOLO F, DURO G, RIZZO C, et al. Pathophysiology of vascular dementia[J]. Immun Ageing,2009,6(1):13.
[2] 秦玮婷,李放.血管性痴呆的诊断和治疗进展[J].现代医药卫生, 2017,33(18):2749-2754.
[3] 何浩,孙林娟,杨文明,等.脑络欣通对血管性痴呆大鼠学习记忆功能及海马神经元内钙离子浓度的影响[J].中成药,2018,40(5):1031-1035.
[4] 刘川杨,肖凌勇,屠建锋,等.中药复方治疗血管性痴呆的机制研究进展[J].中华中医药杂志,2019,34(2):696-701.
[5] 罗增刚,周文泉,高普,等.参麻益智胶囊治疗老年血管性痴呆的临床研究[J].中医杂志,2001,42(8):470-473.
[6] 吴琼.参麻益智方治疗血管性痴呆(气虚血瘀阳亢证)60例临床观察[D].北京:中国中医科学院,2018.
[7] 臧艳桥,孙兰,杜冠华.大鼠脑多梗死性栓塞痴呆模型的建立[J].中国药学杂志,2006,41(5):347-350.
[8] WANG X R, SHI G X, YANG J W, et al. Acupuncture ameliorates cognitive impairment and hippocampus neuronal loss in experimental vascular dementia through Nrf2-mediated antioxidant response[J]. Free Radical Biology & Medicine,2015,89:1077-1084.
[9] GAN L, JOHNSON J A. Oxidative damage and the Nrf2-ARE pathway in neurodegenerative diseases[J]. Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease,2014,1842(8):1208-1218.
[10] 朱子夫.HO-1抗氧化损伤的研究进展[J].医学综述,2010,16(15):2266-2270.
[11] 胡跃强,秦红玲,唐农,等.基于Nrf2/ARE信号通路探讨清热化瘀方对大鼠脑缺血再灌注损伤氧化应激反应的影响[J].中国实验方剂学杂志, 2018,24(14):128-133.
[12] 周文泉,于向东.关于血管性痴呆研究的思考[J].中医杂志,2002, 43(4):299-301.
[13] 林少滨.人参皂苷Rb1后处理对大鼠全脑缺血再灌注后认知功能的影响[J].海峡药学,2017,29(7):15-17.
Effects ofPrescription on Nrf2/HO-1 Pathway and Microglia in Ratswith Vascular Dementia
LI Kun1, PEI Hui2, CAO Yu2, MA Lina2, LI Hao2
To evaluate the effects ofPrescription on Nrf2/HO-1 pathway and microglia in rats with vascular dementia (VaD); To explore its molecular mechanism of VaD treatment.Totally 60 Wistar rats were randomly divided into blank group, sham-operation group, model group,Prescription low-, medium-, and high-dosage groups. Each administration group was given relevant dosage of medicine. Microthromboembolism was used to create the model. The learning and memory abilities of model rats were tested after 4 weeks of administration. RT-qPCR and Western blot were used to detect the expressions of Nrf2, HO-1 protein and gene in hippocampus of rats. Activation of microglia was detected by immunohistochemistry.Compared with the sham-operation group, the escape latency of the water maze experiment in the model group was significantly prolonged, the protein contents of Nrf2 and HO-1 increased, the mRNA expressions of Nrf2 and HO-1 increased, the number of microglia labeled by iba-1 significantly increased, the degree of labeling was enhanced, the cell body became round and the branches decreased, with statistical significance (<0.05,<0.01). Compared with the model group, the escape latency of the water maze experiment inPrescription medium- and high-dosage groups was significantly shortened, the expression of protein and mRNA of Nrf2 significantly increased, the expression of HO-1 mRNA significantly increased inPrescription high-dosage group, the degree of microglia labeled by iba-1 was reduced inPrescription medium- and high-dosage groups, the number of microglia was decreased, the cell body was smaller, and the branches were slender, with statistical significance (<0.01,<0.05).Prescription can significantly improve the learning and memory abilities of VaD rats. The mechanism may be related to the anti-inflammatory and anti-oxidative stress effects ofPrescription on promoting Nrf2/HO-1 pathway protein and gene expression, and inhibiting the over activation of microglia.
Prescription; vascular dementia; Nrf2; HO-1; microglia; rats
R285.5
A
1005-5304(2020)12-0038-05
10.19879/j.cnki.1005-5304.202005163
国家自然科学基金(81603616);北京市科委“十病十药”研发项目(Z171100001717016)
李浩,E-mail:xyhplihao1965@126.com
(2020-05-12)
(2020-06-15;编辑:华强)
