非靶向代谢组学对赤霞珠果皮不同砧穗组合差异代谢物的分析
2020-12-29章智钧刘怀锋孙军利赵宝龙潘立忠刘晶晶
章智钧,刘怀锋,孙军利,赵宝龙,潘立忠,何 旺,刘晶晶
(石河子大学农学院,特色果蔬栽培生理与种质资源利用兵团重点实验室,新疆 石河子 832003)
酿酒葡萄是经济价值最高和种植最广泛的水果 之一[1-2]。中国葡萄的种植面积已连续十年增长,居世界前列[3]。位于中国西北部的新疆因拥有非常适宜酿酒葡萄种植的光热资源,酿酒葡萄产业蓬勃发展,种植面积和产量稳居全国前列,但是新疆地域广袤,气候多样,干旱、盐碱、寒冷等生态条件严重限制了酿酒葡萄的进一步发展。采用嫁接技术,选用对生物胁迫(如土壤有害生物)和非生物胁迫(如寒冷、干旱及盐碱)具有优良耐受性的砧木,通过改变植株的水分关系、气体交换、养分吸收及生长素等从而提高葡萄的抗逆性和对极端气候的耐受性,成为酿酒葡萄发展的趋势[4-5]。 很多研究发现适宜的砧穗组合不仅可以调控酿酒葡萄的长势、物候期和产量,还影响酿酒葡萄的果实品质如糖、酸、单宁、花色苷、白藜芦醇及香气等[6-10],甚至对葡萄酒的质量及颜色、口感等感官特性产生影响[11-13]。 但目前砧木对接穗的影响多集中在生长发育和 果实品质方面,而砧木对接穗葡萄果实中代谢物及其相关代谢过程、代谢途径的影响还鲜见报道。
代谢组学是基于高通量、多变量数据,对生物体中的小分子代谢物成分进行分析和数据整合的研究方式,近些年发展迅速,其中非靶标代谢组学是无偏向性地分析样品中尽可能广泛的代谢产物,已经在生物学、临床医学、药学、食品等生命科学领域广泛应用[14]。因代谢产物最接近表型,代谢组学已经被用于食品掺假检验[15-16],种植模式鉴定[17],探索品种基因型对植物 表型[18]、环境对植物表型[19]及胁迫对植物表型的影 响[20],研究植物不同部位代谢的差异[21],区分植物各器官药用价值[22],分析贮藏条件[23]及不同原料对葡萄酒品质的影响[24]。Wang Dandan等[25]利用高效液相色谱-质谱联用仪对黑芝麻和白芝麻进行代谢组学分析发现苯丙烷类生物合成,酪氨酸代谢和核黄素代谢途径有差异,存在显着差异的生物标志物与传统中医药记录的功能高度相关。Vanderweide等[26]采用代谢组学分析发现,早期机械去除叶片可提高葡萄花色苷及黄酮醇的含量,为提高葡萄成熟度及酚类物质提供了栽培方法。代谢组学为分析植物品种及栽培方法对植物代谢物质及其代谢通路的影响提供了方法。
本研究利用基于液相色谱- 质谱(liquid chromatography-mass spectrometry,LC-MS)联用技术的非靶向代谢组学,分析不同砧穗组合酿酒葡萄主栽品种‘赤霞珠’果皮代谢物质,经过包括主成分分析(principal component analysis,PCA)、偏最小二乘判别分析(partial least squares discriminant analysis,PLSDA)等多元统计分析方法,筛选不同砧穗组合葡萄代谢产物的差异并分析其相关通路,探究代谢物对葡萄品质影响,以期为葡萄砧穗组合的选择提供理论依据,为优质葡萄砧木的选育提供指导。
1 材料与方法
1.1 材料与试剂
接穗品种为酿酒葡萄‘赤霞珠’(Cabernet Sauvignon,简称:CS),品系为169,选择抗性优良的砧木品种分别为:冬葡萄×河岸葡萄杂交组合 (V. berlandieri×V. riparia)的品种SO4、5C,冬葡萄× 沙地葡萄杂交组合(V. berlandieri×V. rupestris)品种140R、1103P,河岸葡萄×沙地葡萄杂交组合 (V. riparia×V. rupestris)品种3309C,砧木来自于郑州果树研究所国家葡萄资源圃,砧穗组合为CS/1103P、 CS/SO4、CS/140R、CS/5C、CS/3309C,以CS自砧嫁接作对照。2015年秋季选取长势一致的1 a生硬枝嫁接苗各10 株定植于新疆石河子大学农学院试验站(86°06’N,44°32’E),株距0.5 m,栽培管理条件一致,控制各组处理产量相近。2017年秋季,在靠近根部及远离根部各随机采摘完全成熟葡萄果穗,在果穗中随机选取400 g左右果粒作为一个重复,共5 个生物学重复。样品收集后在实验室用去离子水清洗,擦干后迅速剥皮,用锡箔纸包装,液氮速冻,在-80 ℃超低温冰箱中贮存。
甲醇、氯仿(均为色谱纯) 国药集团化学试剂有限公司;乙腈(色谱纯) 默克化工技术(上海)有限公司;甲酸(色谱纯) 日本东京化成工业株式会社;超纯水由赛多利斯新型纯水系统制备。
1.2 仪器与设备
ACQUITY UPLC液相色谱仪、ACQUITY UPLC®HSS T3色谱柱(2.1 mm×150 mm,1.8 µm) 美国沃特世公司;LTQ Orbitrap XL质谱仪 美国赛默飞世尔科技公司;53050型真空浓缩仪、H1650-W冷冻离心机 德国艾本德公司;Arium®mini纯水仪 德国Sartorius 公司;0.22 µm PTFE滤膜 天津市津腾实验设备有限 公司;KW-100TDV型超声波清洗器(舒美) 昆山市超声仪器有限公司;SCIENTZ-48组织研磨器 宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 成熟指标可溶性糖含量:采用蒽酮比色法测定;可滴定酸含量:采用酸碱滴定法测定。
1.3.2 样品制备
称取葡萄果皮0.500 0 g经高通量组织研磨仪研磨后取100 mg粉末于5 mL管中,加入1 000 μL甲醇 (-20 ℃),涡旋振荡30 s;室温超声提取30 min,添加750 μL氯仿和800 μL ddH2O(4 ℃),涡旋振荡1 min;4 ℃、12 000 r/min离心10 min,取上清液1 000 μL,转移到一个新的1.5 mL离心管中,经真空离心浓缩仪浓缩;用250 μL甲醇-水溶液(1∶1,V/V)4 ℃溶解样品,0.22 μm膜过滤;从每个待测样本各取20 µL混合成质量控制(quality control,QC)样本校正混合样品分析结果的偏差以及由于分析仪器自身原因所造成的误差,用剩余待测样本进行LC-MS检测[27]。
1.3.3 色谱条件
使 用ACQUITYUPLC®HSST3 色 谱 柱(2.1 mm×150 mm,1.8 µm),自动进样器温度设为4 ℃,流速0.25 mL/min,柱温40 ℃,进样6 μL进行梯度洗脱,流动相A为0.1%甲酸溶液;流动相B为0.1%甲酸-乙腈。梯度洗脱程序:0~1 min,98% A、2% B;1~9.5 min,98%~50% A、2%~50% B;9.5~14 min,50%~2% A、50%~98% B;14~15 min,2% A、98% B;15~15.5 min,2%~98% A、98%~2% B;15.5~17 min,98% A、2% B。
1.3.4 质谱条件
电喷雾离子源,正负离子电离模式,正离子喷雾电压4.80 kV,负离子喷雾电压4.50 kV,鞘气45 arb,辅助气15 arb。毛细管温度325 ℃,毛细管电压35 V/-15 V,管透镜电压50 V/-50 V,以分辨率60 000进行全扫描,扫描范围m/z50~1 000,并采用碰撞诱导裂解进行二级裂解,碰撞电压为30 eV,同时采用动态排除(重复计数为2)去除无必要的MS/MS信息,动态排除时间15 s[28]。
1.4 数据分析
通过Proteowizard软件(v3.0)将数据格式转换[29],利用R(v3.3)进行峰识别、峰过滤、峰对齐,得到包括质荷比和保留时间及峰面积等信息的数据矩阵,再对数据进行峰面积的批次归一化和自适换算标准化处理。使用的多元统计分析(软件包SIMCA-P(v13.0)和R语言ropls包)对数据进行PCA、PLS-DA和正交-偏最小二乘判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)等化学计量学原理和多元统计分析。代谢组学数据由苏州智核生物医药科技有限公司进行分析。
2 结果与分析
2.1 不同砧穗组合‘赤霞珠’葡萄果实成熟指标
从葡萄果实完全转色开始对葡萄成熟指标进行监控,9月25日各处理葡萄果实中可溶性糖含量均达到200 mg/g 且相对稳定。采样后对葡萄中可溶性糖及可滴定酸进行测定,结果如表1所示,各组处理葡萄果实中可溶性糖及可滴定酸含量略有不同,但均无显著性差异 (P>0.05),各组处理葡萄果实达到相近的成熟度。

表1 不同砧木赤霞珠葡萄成熟指标Table 1 Maturity indexes of Cabernet Sauvignon in different scion-rootstock combinations
2.2 样本分析
QC工作是进行基于质谱技术的代谢组学研究时获得可靠且高质量的代谢组学数据的基础。由图1可以看出,QC样品总离子流图重复性好,峰分离度高,同时由图2可发现,QC样本相对于实验样本聚集,且QC误差小于 2 倍的标准偏差以内,说明本实验LC-MS检测的系统误差在可控范围内。

图1 QC样本总离子流图Fig. 1 Total ion current chromatograms of quality control samples

图2 QC样本PCA得分图Fig. 2 PCA score plots of quality control samples
2.3 不同砧穗组合‘赤霞珠’葡萄果皮代谢组差异
2.3.1 PCA
采用多维统计分析方法PCA对样品进行分类,因无外加因素,得到的PCA模型反映了代谢组数据的原始状态,有利于掌握不同砧穗组合‘赤霞珠’葡萄果皮中代谢物的整体情况并从整体上进行研究。不同砧穗组合‘赤霞珠’葡萄果皮的代谢产物PCA得分图见图3。 如图3所示,CS/1103P和CS/140R两组点分别单独在第1象限(t[1]>0,t[2]>0)和第3象限(t[1]<0,t[2]<0),表明这两种砧穗组合果皮中代谢物间有显著差异,代谢模式都与其他砧穗组合代谢模式不同。CS/5C与CS/SO4两组样品点距离较近,CS/3309C与CS对照组两组样品点有部分重叠,说明CS/5C与CS/SO4、CS/3309C与CS砧穗组合果皮中代谢物间没有显著差异。

图3 不同砧穗组合赤霞珠葡萄果皮PCA得分图Fig. 3 PCA score plot of different scion-rootstock combinations
2.3.2 PLS-DA
PLS-DA可以分析高共线及噪音数据,忽略组内误差、消除与研究目的无关的随机误差,是代谢组数据分类和回归的经典工具,为进一步对不同砧穗组合对葡萄果皮代谢物分类,本研究通过PLS-DA对不同砧穗组合的代谢信息进行进一步的分析[30-31]。
不同砧穗组合葡萄果皮样本PLS-DA得分图和置换检验结果如图4所示,其结果与PCA相似。不同砧穗组合葡萄果皮样本的模型系数Q2为0.942、R2Y为0.995,表明模型预测能力高,模型的拟合度较好。在置换检验中模型Q2点从左到右均远低于最右端的原始Q2点,且位于最右边的R2和Q2值均超过0.9,Q2回归线的截距为-0.479,说明模型具有较好的预测能力并且有效可用。

图4 不同砧穗组合赤霞珠葡萄果皮PLS-DA得分图(A)和 置换检验图(B)Fig. 4 PLS-DA score (A) and permutation test plots (B) of different scion-rootstock combinations
2.3.3 OPLS-DA
OPLS-DA是代谢组学数据分析中常用的分析方法,是PLS-DA的扩展[32]。图5为OPLS-DA得分图,该结果与PCA结果大体一致。不同砧穗组合葡萄果皮模型参数中=0.625,说明该模型对自变量X的解释程度为62.5%;=0.992,表示对分类变量Y的解释程度为99.2%;Q2=0.932,说明该模型对样本变量的预测程度为93.2%,不同砧穗组合葡萄果皮代谢影响模型对自变量X的解释程度为54.5%;对分类变量Y的解释程度为99.5%;对样本变量的预测程度为86.5%,结果显示OPLS-DA模型稳定性良好且预测能力较强。其中CS/140R和CS/5C样本在PCA和PLS-DA中均没有分离开,在OPLS-DA中基本分离开,表明OPLS-DA的效果更好。而CS与CS/3309C Skin样本在PCA、PLS-DA和OPLS-DA均未分离,说明CS与CS/3309C组合在葡萄果皮中代谢模式非常相近。
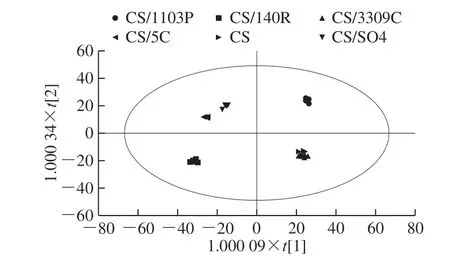
图5 不同砧穗组合赤霞珠葡萄皮OPLS-DA得分图Fig. 5 OPLS-DA score plot of different scion-rootstock combinations
2.4 差异代谢物的筛选与鉴定
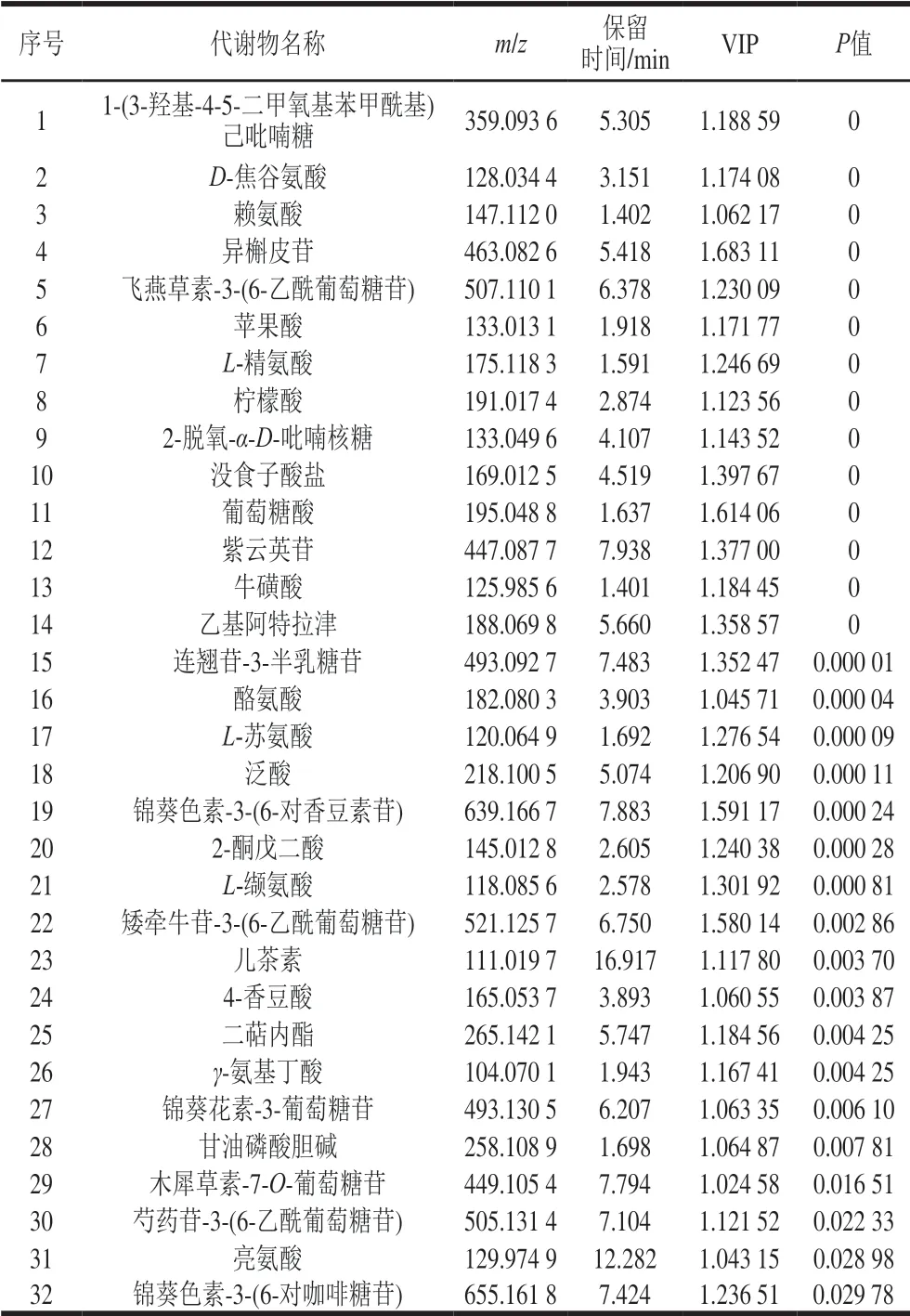
表2 不同砧穗组合葡萄果皮中显著差异代谢物Table 2 Differential metabolites in Cabernet Sauvignon grape skins of different scion-rootstock combinations
通过OPLS-DA模型的第1主成分变量重要性值投影(variable importance in the projection,VIP)>1且t检验的P≤0.05结合一维方差分析(one-way ANOVAP-value)不高于0.05,寻找差异代谢物并鉴定结果如表2所示,不同砧穗组合葡萄果皮中显著差异代谢物有32 个。
2.5 差异代谢物热图分析
采用聚类分析和热图分析方法对不同砧穗葡萄果皮中的差异代谢产物进行分析,结果见图6。图中颜色表示含量,红色表示含量高表达,绿色表示含量低表达,通过对鉴定的代谢物进行聚类分析后,从图中条带可以看出葡萄果皮中都有明确的高表达或者低表达的区域,可以根据表达情况区分每组处理。

图6 不同砧穗组合葡萄果皮差异代谢物的层次聚类热图Fig. 6 Hierarchical clustering heatmap of metabolites of grape skins of different scion-rootstock combinations
在果皮中,CS中2-酮戊二酸、乙基阿特拉津、葡萄糖酸、L-苏氨酸、木犀草素-7-O-葡萄糖苷、L-缬氨酸、苹果酸、异槲皮苷高于其他组合,在CS/1103P中D-焦谷氨酸、2-脱氧-α-D-吡喃核糖、儿茶素、甘油磷酸胆碱、牛磺酸高于其他组合,在CS/SO4中1-(3-羟基-4,5-二甲氧基苯甲酰基)己吡喃糖、γ-氨基丁酸、紫云英苷、锦葵色素-3-(6-对咖啡糖苷)、锦葵色素-3-(6-对香豆素苷)、芍药苷-3-(6-乙酰葡萄糖苷)、矮牵牛苷-3-(6-乙酰葡萄糖苷)、二萜内酯高于其他组合,在CS/140R中没食子酸酯、L-精氨酸、连翘苷-3-半乳糖苷、酪氨酸高于其他组合,在CS/5C中亮氨酸高于其他组合,在CS/3309C样本中香豆酸、柠檬酸、飞燕草素-3-(6-乙酰葡萄糖苷)、赖氨酸、锦葵花素-3-葡萄糖苷高于其他组合。由此可见,不同砧木对果皮中代谢物种类和含量均有差异。
2.6 代谢产物代谢途径分析
代谢途径的分析是依托KEGG代谢途径数据库采用通路分析(MetPA)通过拓扑分析,识别出可能受不同砧穗组合影响的代谢通路[23]。图7为不同砧穗组合葡萄果皮代谢通路影响因子图,图中每个圆点代表一个代谢通路,纵坐标为-lgP表示富集到通路中代谢物的显著性,从低到高显著性依次增加同时颜色越深。横坐标从0~1代表差异代谢物对通路的影响值,值越大影响越大、圆圈越大。

图7 不同砧穗组合赤霞珠葡萄果皮代谢通路影响因子图Fig. 7 Influence of differential metabolites on metabolic pathways of Cabernet Sauvignon grape skins of different scion-rootstock combinations
如图7和表3所示,在葡萄果皮中受不同砧穗组合扰动的代谢途径主要是异喹啉生物碱生物合成、黄酮和黄酮醇合成、泛酸和辅酶A生物合成、柠檬酸循环等21 个通路。

表3 不同砧穗组合葡萄果皮中显著差异代谢物Table 3 Significantly differential metabolites in grape skins of different scion-rootstock combinations
2.7 差异代谢物的分析
葡萄果实已被广泛用于鲜食、制汁、酿酒和制药,葡萄的代谢产物在影响葡萄生长发育的同时也是相关产品质量的重要影响因素。要保证葡萄相关产品质量安全,改良相关产品品质,对葡萄果实相关代谢产物的研究和探究对其的调控方式不可或缺。
有机酸与葡萄品质有着密切的关系,对于酿酒葡萄而言,有机酸在葡萄酒的风味构成中起重要作用,低含量的有机酸可使葡萄酒口感丰富,含量过高则会导致酸涩感增强,影响葡萄酒的口感平衡与品质[33]。2-酮戊二酸是柠檬酸循环、丙氨酸、天冬氨酸和谷氨酸代谢、赖氨酸生物合成、乙醛酸和二羧酸盐代谢、丁酸代谢的组成部分,从图8可以看出,在果皮中各砧穗组合相比CS均不同程度降低了2-酮戊二酸含量,嫁接后可能会降低氨基酸的合成及碳水化合物的合成。柠檬酸与苹果酸是葡萄中重要的有机酸,本研究中CS/SO4和CS/5C砧穗组合极显著降低了葡萄皮中柠檬酸的含量,CS/SO4、CS/140R、CS/5C和CS/3309C砧穗组合极显著降低了葡萄果皮中苹果酸的含量。可见,嫁接可以改变葡萄果皮中有机酸的含量。


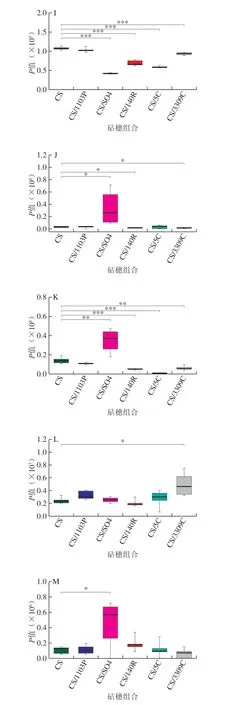

图8 不同砧穗组合葡萄果皮中差异代谢物含量箱形图 Fig. 8 Box plots of the contents of differential metabolites in grape skins of different scion-rootstock combinations
多酚类化合物是葡萄果实中重要的次生代谢产物,保持着水果正常的生理和生化过程,调控植物生长发育,具有影响植物对生物胁迫和非生物胁迫应激保护等功能。酿酒葡萄中的多酚类化合物决定葡萄酒中颜色、口感等主要品质,并且具有抗氧化和清除自由基的作用,具有保健功能[34-35]。儿茶素、没食子酸盐、紫云英苷不仅具有显著的抗氧化性,而且具有抗炎、抗过敏、修复受损DNA作用、改善心血管疾病及抗癌的功效[36-39]。本研究发现,CS/1103P砧穗组合显著提高了葡萄果皮中儿茶素含量,CS/140R砧穗组合极显著提高了葡萄果皮中没食子酸盐含量,CS/SO4、CS/140R、CS/5C和CS/3309C极显著提高了紫云英苷含量。飞燕草素糖苷、芍药苷、锦葵素糖苷、矮牵牛素糖苷、连翘苷等花色苷影响葡萄酒的色泽及口感,有报道发现葡萄中的花色苷具有抗癌、保护心脑血管等功效[40-42]。本研究中,CS/SO4砧穗组合不同程度提高了连翘苷-3-半乳糖苷、锦葵色素-3-(6-对香豆素苷)、矮牵牛苷-3-(6-乙酰葡萄糖苷)、芍药苷-3-(6-乙酰葡萄糖苷)、锦葵色素-3-(6-对咖啡糖苷)的含量。其他研究也有关于砧木改变接穗葡萄多酚类物质的报道[7],及CS/M4中VviPAL3-like、VviCHS3、VviLAR2、VviUFGT花色苷合成相关基因表达量高于1103P/CS[4],由此可以看出通过不同砧穗组合可以砧穗组合可改变葡萄果皮中多酚类物质的含量,其机制需进一步挖掘。
不同砧穗组合可以提高葡萄果皮中有机酸及多酚类物质的含量,甚至可以根据不同用途通过选择不同砧穗组合从多方面改变葡萄果皮中成分,从而改善相关产品的口感、营养特性甚至是功效。
3 结 论
本研究使用LC-MS非靶向代谢组学分析方法,研究了5 种嫁接砧穗组合和CS自砧嫁接葡萄果皮中32 种差异代谢物,并对差异代谢物进行了通路富集分析,筛选出了6 种砧穗组合葡萄果皮中差异显著的代谢途径。发现适当的砧穗组合可以通过影响异喹啉生物碱生物合成、黄酮及黄酮醇合成、泛酸和辅酶A生物合成、柠檬酸循环等代谢途径,改变葡萄果皮代谢物质含量。不同砧穗组合可以调节葡萄果皮中有机酸、多酚类物质的含量,提高葡萄品质,改善相关产品的口感、营养特性甚至是功效。
本实验成功鉴定出了赤霞珠葡萄6 种砧穗组合的特征标志物,揭示了赤霞珠葡萄砧木对接穗影响的代谢机制,为葡萄砧穗组合的选择提供理论依据,并为葡萄砧木的良种选育提供了方向,为改良以葡萄为原料的相关产品质量提供了重要启示。
