超高效液相色谱-串联质谱法检测大豆主要过敏原蛋白
2020-12-29李丽芳黄文胜张九凯王彦波傅玲琳韩晓祥
李丽芳,黄文胜,张九凯,王彦波,傅玲琳,韩晓祥,陈 颖,
(1.浙江工商大学食品与生物工程学院,浙江 杭州 310018;2.中国检验检疫科学研究院,北京 100176)
大豆(Glycine max[L.] Merr.)是世界卫生组织认定的八大食物过敏原之一[1]。大豆过敏原易在婴幼儿和幼龄动物体内引发IgE抗体介导的速发型(I型)超敏反应。目前尚无治愈食物过敏的有效疗法,避免大豆及其制品的直接摄入是大豆过敏者预防过敏反应的唯一方式。但由于大豆蛋白在食品工业(预制和加工食品)中应用广泛,很难将其从日常饮食中完全去除[2]。为保护大豆过敏消费者,欧盟、日本、美国、加拿大、澳大利亚、新西兰等国家的食品标签法规要求,任何含有大豆及其制品的食品,无论含量高低都须在包装上明确标识[3]。 我国GB 7718—2011《预包装食品标签通则》中也建议在食品包装上标识相关致敏物质。尽管各国标签法规相继颁布,但因交叉污染或违规而导致食物过敏原未按照规定进行标识的情况仍经常发生[4]。因此,为督促食品生产者自觉遵守过敏原标识相关法规,帮助消费者判断标签标识的真实性,研发高灵敏度、快速准确的食物过敏原检测方法至关重要。
目前,用于检测大豆过敏原蛋白的方法主要有酶联免疫吸附法(enzyme-linked immune sorbent assay,ELISA)[5-7]和高效液相色谱-质谱(high performance liquid chromatography-mass spectrometry,HPLC-MS)联用技术等[8-9]。基于抗体的ELISA法应用最早也最为广泛,但食品加工中常用的高压和热处理等加工方式易引起蛋白质发生结构变化,导致检测结果出现假阳性或假阴性[5-7]。近年来,HPLC-MS法因其良好的特异性和灵敏度,在大豆过敏原检测中的应用逐渐增多。迄今为止,世界过敏原数据库(http://www.allergenonline.org/)中共收录了43 种大豆过敏原。其中,大豆球蛋白(包括G1、G2、G3、G4和G5亚基)和β-伴大豆球蛋白(包括α’、α和β亚基)、Gly m Bd 30K(P34蛋白)、Gly m Bd 28K(P28蛋白)以及Kunitz型胰蛋白酶抑制剂(kunitz trypsin inhibitor,KTI)5 类是主要的大豆过敏原蛋白,组成大豆球蛋白和β-伴大豆球蛋白的各亚基均已被证明具有独立的免疫原性[10-12]。不同的大豆品种中过敏原蛋白的组成和含量存在差异,国内外已经发现不少有关P34等过敏原蛋白缺失[13]以及α’、α、β等亚基缺失[14-15]的大豆种质资源。但现有的基于HPLC-MS技术的检测方法通常仅以单一的大豆过敏原蛋白[16]/亚基[17-18]或某几种大豆过敏原[11,19]为检测目标,未涵盖大豆中5 大类主要的过敏原蛋白及其亚基。
本研究利用超高效液相色谱-四极杆-飞行时间质谱(ultra-high performance liquid chromatographyquadrupole-time of flight-mass spectrometry,UPLC-QTOF-MS)联用技术,针对大豆5 大类主要过敏原蛋白的11 种过敏原,筛选出特征标识肽段,建立多反应监测(multiple reaction monitoring,MRM)模式质谱检测方法,以期为食物过敏原检测提供技术支撑。
1 材料与方法
1.1 材料与试剂
国内外不同地区各类型大豆样品24 份(表1),由中国农业科学院作物科学研究所国家大豆种质资源库提供。
尿素、冰乙酸、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、牛血清蛋白(bovine serum albumin,BSA)、碳酸氢铵(ammonium bicarbonate,ABC)、二硫苏糖醇(dithiothreitol,DTT)、碘乙酰胺(iodoacetamide,IAA)、乙腈(HPLC级)、甲酸(HPLC级)、10 kDa离心浓缩装置 美国Sigma公司;胰蛋白酶蛋白酶(MS级) 美国Thermo Fisher-Pierce 公司;低分子质量蛋白标准品Marker 美国Bio-Rad公司;考马斯亮蓝R250 北京克尔慧公司;超纯水由Milli-Q超纯水净化系统制备;其他试剂均为国产分析纯。
1.2 仪器与设备
LC-20AD XR液相色谱仪 日本Shimadzu公司; Q-TOF®6600质谱、Q-TRAP®5500质谱 美国AB Sciex 公司;ACQUITY UPLC BEH C18色谱柱(4.6 mm× 150 mm,3.5 μm,300 Å) 美国Waters公司; TissueLyser II型组织研磨仪 德国Qiagebn公司;ME403E型电子天平 瑞士Mettler Toledo公司;Centrifuge 5418R型离心机、Concentrator plus型真空浓 缩仪 德国Eppendorf公司;Multiskan GO型酶标仪 美国Thermo Scientific公司;Vortex-Genie 2型振荡器 美国Scientific Industries公司;PowerPac Basic型凝胶电泳仪、ChemiDoc型凝胶扫描仪 美国Bio-Rad公司;HNDSY800型水浴摇床 德国Wiggens公司;HH-1型数显恒温水浴锅 金坛市白塔新宝仪器厂。
1.3 方法
1.3.1 样品制备
所有大豆样品均在液氮作用下研磨成粉末,过80 目筛,4 ℃保存。确称取1 g大豆粉末并置于50 mL离心管中,以料液比1∶10(g/mL)加入超纯水,用1 mol/L NaOH溶液调节溶液pH值至10.0,50 ℃振荡1 h;4 ℃、4 500 r/min离心20 min后取上清液;将沉淀重悬于10 倍体积的提取缓冲液中,重复上述步骤;将2 次提取的上清液合并,过400 目滤布即得大豆全蛋白提取液;分装后保存于-80 ℃待用。
1.3.2 提取液蛋白含量的测定
采用Bradford法[20]测定大豆总蛋白的含量。用0.15 mol/L NaCl溶液配制质量浓度为0、0.2、0.4、0.5、0.6、0.8 mg/mL和1.0 mg/mL的BSA标准曲线溶液。将样品大豆蛋白原液稀释30 倍。分别吸取各系列质量浓度BSA标准溶液与各样品稀释液30 µL,加入1 mL考马斯亮蓝染料,轻摇混匀,室温静置2~3 min。使用酶标仪于595 nm波长处测定标准蛋白溶液和样品稀释液的OD值,根据标准曲线计算样品总蛋白含量,实验重复3 次。提取液中的蛋白质提取率按照下式计算[21]:

1.3.3 十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分析
SDS-PAGE分析参照Laemmli[22]的方法:根据Bio-Rad推荐配方分别制备质量分数为12%的分离胶和5%的浓缩胶,将蛋白样品稀释至1 μg/μL并与上样缓冲液1∶1混匀,95 ℃水浴10 min,上样量为15 μL,加样完毕后接通电源,开始时浓缩胶电泳电压为80 V,到达分离胶后调节电压为120 V,待溴酚蓝指示剂距分离胶底部5 mm时结束电泳,取出凝胶用考马斯亮蓝R250染色约2 h,染色结束后倒去染色液,以适量体积的超纯水清洗凝胶以去除残留染料,再用脱色液(甲醇-冰乙酸-水(4∶1∶5,V/V))脱色至背景无色,采用Bio-Rad凝胶成像系统进行扫描,利用Quantity One软件进行图像分析。
1.3.4 胰蛋白酶消化
参考Wisniewski等[23]的过滤辅助样品制备(filtration auxiliary sample preparation,FASP)法进行蛋白质酶解。取约200 μg的大豆总蛋白提取物于10 kDa截留超滤管中,加入100 μL 10 mmol/L DTT溶液(8 mol/L尿素、0.1 mol/L Tris-HCl,pH 8.5),37 ℃孵育1 h;加入10 μL 50 mmol/L IAA(8 mol/L尿素、0.1 mol/L Tris-HCl,pH 8.5)于室温避光放置15 min,将蛋白烷基化;在室温下以12 000 r/min离心10 min,用100 μL Buffer1(8 mol/L尿素,0.1 mol/L Tris-HCl,pH 8.0)洗涤样品;加入100 µL 50 mmol/L ABC溶液,12 000 r/min离心10 min,重复3 次,至超滤管上没有残留液体。在超滤管中加入100 μL 50 mmol/L ABC溶液,再以1∶50质量比加入4 μL胰蛋白酶(1 μg/μL,溶于50 mmol/L乙酸溶液中),涡旋混匀,37 ℃过夜酶切。酶解液12 000 r/min离心10 min,然后用100 μL 25 mmol/L ABC溶液洗涤3 次,使小分子肽段进入滤液中。将滤液旋转干燥,加入质谱水除盐,重复旋转蒸干3 次,最后加入100 µL流动相A(0.1%甲酸-2%乙腈-98%水)溶液复溶。
1.3.5 UPLC-Q-TOF-MS检测条件
色谱条件:色谱柱为ACQUITY UPLC BEH C18(4.6 mm×150 mm,3.5 μm);流动相A为0.1%甲酸-2%乙腈-98%水溶液;流动相B为0.1%甲酸-2%水-98%乙腈溶液;流速0.25 mL/min;柱温40 ℃;进样量10 µL;梯度洗脱程序:0~0.1 min,98% A、2% B;0.1~0.5 min,98%~92% A、2%~8% B;0.5~25 min,92%~78% A、8%~22% B;25~31 min,7 8%~6 5% A、2 2%~3 5% B;3 1 ~3 3 m i n,65%~20% A、35%~80% B;33~39 min,20% A、80% B;39~39.5 min,20%~98% A、80%~2% B;39.5~44 min,98% A、2% B。
AB SCIEX TripleTOF®6600质谱条件:电喷雾离子源(electron spray ionization,ESI)正离子扫描模式;离子化电压5 000 V;离子源温度550 ℃;雾化气压力50 psi;辅助气压力50 psi;气帘气压力35 psi;质谱扫描模式:信息依赖型采集工作模式(information dependent acquisition,IDA);TOF MS模式m/z 350~1 500,500 ms;IDA TOF MS/MS模式m/z 350~1 500, 40 MS/MS,100 ms,IDA阈值100 cps,母离子电荷选择范围为+2~+5;滚动碰撞能量enabled;动态排除时间12 s;运行时间44 min。
1.3.6 高效液相色谱-三重四极杆质谱检测条件
色谱条件:色谱柱为ACQUITY UPLC BEH C18(4.6 mm×150 mm,3.5 μm),流动相A为0.1%甲酸-2%乙腈-98%水溶液;流动相B为0.1%甲酸-2%水-98%乙腈溶液;流速0.4 mL/min;柱温40 ℃,进样体积10 µL。梯度洗脱程序:0~0.1 min,97% A、3% B;0.1~10 min,97%~70% A、3%~30% B;10~13 min,7 0%~4 5% A、3 0%~5 5% B;1 3 ~1 3.1 m i n,45%~20% A、55%~80% B;13.1~16 min,20% A、80% B;16.1~20 min,20%~97% A、80%~3% B;20~20.1 min,97% A、3% B。
AB QTRAP®5500质谱条件:ESI正离子扫描参数:气帘气压力35 psi,碰撞气:Medium,离子化电压4 500 V,离子源温度500 ℃,雾化气压力65 psi,辅助气压力50 psi;正离子扫描Scheduled MRM模式:MRM检测窗口120 s;扫描时间3 s。
1.4 数据处理
利用高分辨质谱和计算机对胰蛋白酶酶解肽的质荷比(m/z)、保留时间(retention time,RT)和响应强度等原始数据进行IDA,生成wiff文件。从Uniprot数据库(UniprotKB,http://www.uniprot.org)中检索并下载大豆蛋白数据库并导入AB SCIEX公司的ProteinPilot v.5.0软件,对原始数据进行搜库处理。ProteinPilot v.5.0软件参数设定如下:样品类型:鉴定;Cys烷基化:IAA;消化:胰蛋白酶;搜索工作:完整蛋白信息(identity document,ID);ID焦点:生物学修饰;检测到的蛋白质阈值(Unused ProtScore(Conf)):>0.05(10.0%);运行错误发现率分析。
2 结果与分析
2.1 提取条件的优化
样品蛋白的高效提取是质谱鉴定分析的前提,因此本实验对大豆蛋白提取缓冲液的组成与pH值、提取料液比及提取温度和时间等条件进行优化。由于大豆蛋白在碱性溶液中具有良好的溶解性[19],本实验对比3 种提取缓冲液(缓冲液a:H2O;缓冲液b:0.03 mol/L Tris-HCl;缓冲液c:0.1 mol/L ABC)在碱性条件下(pH 9.0和pH 10.0)对大豆中可溶性蛋白总回收率的影响。结果显示,缓冲液a在pH 9.0和pH 10.0时获得的大豆蛋白提取率均高于缓冲液b和缓冲液c(图1A);并采用HPLC-MS/MS 方法检测不同缓冲液在pH 10.0条件下提取的大豆蛋白酶解肽中目标致敏原特征肽段的得率,经比较分析,当使用碱性水溶液作为提取溶剂(缓冲液a)时,各过敏原特征肽段的响应强度可达到最高值(图1B),故本研究最终选择以1 mol/L NaOH溶液作为碱化介质调节的水溶液作为大豆蛋白的提取缓冲液。在此基础上,调节提取缓冲液的pH值(pH 8.0~12.0),发现pH值为10.0时大豆蛋白提取率最高(图1C)。通过评估不同料液比(1∶6、1∶8、1∶10、1∶12、1∶14、1∶16、1∶18和1∶20(g/mL))下的提取效率,发现料液比为1∶10时大豆蛋白提取效果最佳(图1D)。为增加大豆蛋白的溶解度,需辅助进行加热和振荡处理,进一步考察提取温度(25~60 ℃)和振荡提取时间(15~120 min)对其提取效率的影响。结果表明,在50 ℃和60 min的提取条件下获得了大豆蛋白的最佳提取率(图1E和图1F)。在优化的提取条件下完成了所有大豆样品的蛋白提取,利用Bradford法测得24 个品种中大豆蛋白含量在252.89~329.85 mg/g之间。


图1 提取条件对大豆蛋白提取效果的影响Fig. 1 Effects of different extraction conditions on the extraction efficiency of soybean protein
2.2 SDS-PAGE分析
利用SDS-PAGE技术分析24 个大豆样品的蛋白组成,通过与已知的各过敏原相对分子质量进行比对,可准确定位大豆球蛋白的酸性多肽链A(34~44 kDa)和碱性多肽链B(18~20 kDa)、β-伴大豆球蛋白的α’(72 kDa)、α(68 kDa)和β(52 kDa)亚基、P34(30~34 kDa)、P28(28 kDa)及KTI(24 kDa)相应的条带位置。由图2可知,利用本实验方法提取的大豆总蛋白包括了上述主要大豆过敏原,各过敏原条带清晰可见,未发生降解,且不同品种间大豆蛋白质的亚基组成及含量存在差异。

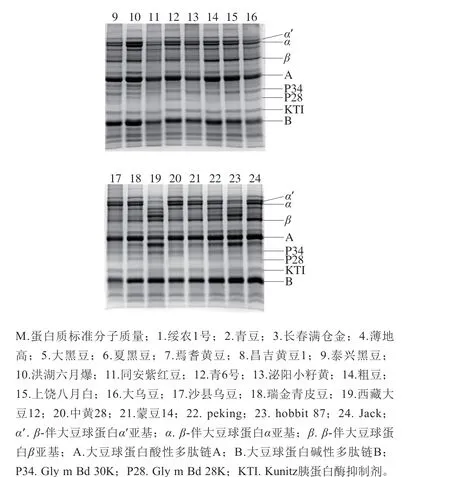
图2 大豆蛋白粗提物的SDS-PAGE图谱Fig. 2 SDS-PAGE profiles of crude soy protein extracts from different cultivars
2.3 大豆蛋白胰蛋白酶肽的UPLC-Q-TOF-MS分析
按1.3.5节色谱及质谱条件,利用UPLC-Q-TOF-MS对24 份大豆样品的全蛋白胰蛋白酶消化产物进行分析,得到其在全扫描模式下具有代表性的总离子流色谱图。以绥农1号大豆种质为例,大豆蛋白酶解产物的分离情况较好,其色谱图谱峰尖锐,响应强度较高,峰形对称且重复性好,数据采集情况良好(图3)。
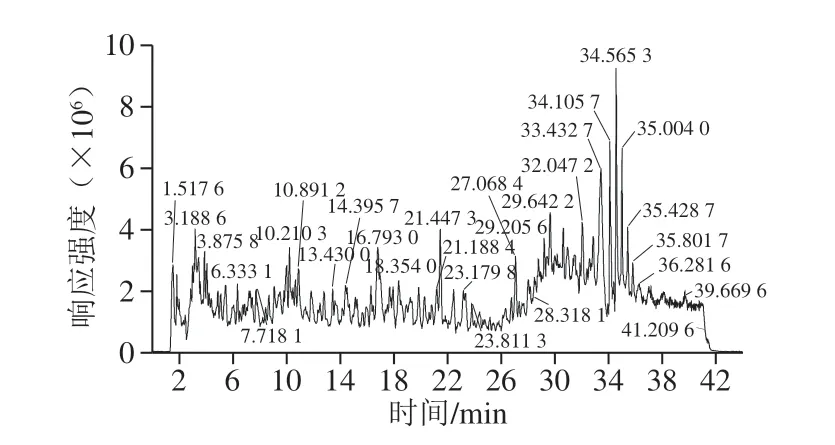
图3 大豆蛋白酶解产物在全扫描模式下的总离子流色谱图Fig. 3 Total ion current chromatograms of tryptic digestion products from soybean protein extracts
2.4 特征肽段的筛选
在Uniprot数据库中搜索并下载大豆蛋白的氨基酸序列,使用ProteinPilot软件结合Paragon算法针对大豆蛋白质数据库对经UPLC-Q-TOF-MS分析得到的MS2谱进行搜库处理,以生成蛋白质、肽序列、丰度和修饰信息的列表,实现蛋白质和多肽的鉴定。在95%置信度下,针对性地鉴定出11 种大豆主要过敏原,即大豆球蛋白的G1、G2、G3、G4和G5亚基,β-伴大豆球蛋白的α′、α和β亚基,P34、P28及KTI。为确定质谱检测的标志物,对经Uniprot数据库结果比对后得到的一系列肽段进行筛选。筛选原则如下:长度在7~21 个氨基酸之间;m/z<1 250;不含任何修饰氨基酸(半胱氨酸(C)与蛋氨酸(M));不含内部胰蛋白酶切割位点;在酶切位点处没有连续的精氨酸(R)或赖氨酸(K)残基[24-28]。根据上述原则,每个目标过敏原筛选得到1~4 条预选特征肽段,共计29 条(表2),其中11 条为本研究首次发现。将所选择的预选特征肽段利用BLAST分析工具进行UniProtKB数据库比对,以检查物种间同源性,确保这些肽段对于其所属的大豆过敏原具有特异性。比对结果表明,所选特征肽段仅存在于其所属大豆过敏原中,均可作为大豆过敏原定性定量蛋白质组学研究的候选靶肽。

表2 大豆中11 种主要过敏原的特征肽段信息及其MRM参数Table 2 Information about signature peptides and MRM parameters for 11 major allergens in soybean
2.5 大豆主要过敏原特征肽段的三重四极杆质谱验证
本实验利用Skyline软件对所选特征肽段进行模拟酶解,获得各肽段适用于质谱分析的理论传输离子对(母离子Q1和子离子Q3)、RT、碰撞能量(collision energy,CE)以及去簇电压(declustering potential,DP)等MRM参数信息,并通过三重四极杆质谱MRM模式对所选特征肽段进行验证。经碰撞诱导解离后,带电荷的肽段碎裂成许多小片段,产生y离子和b离子(肽段主链片段离子在N和C端保持正电荷),导致每个肽段出现多个峰。之前研究表明,每个特征肽段应至少选择3 个子离子进行监测,其中响应值最高的离子可作为定量离子,其余两个离子辅助定性分析[29-30]。以β-伴大豆球蛋白α亚基的特征肽段NPFLFGSNR为例,在m/z526.272+处观察到该肽的双质子化离子信号强度最高,该离子的MS2分析结果如图4所示。m/z580.28+(y5)、m/z693.37+(y6)和m/z840.44+(y7)处的片段碎裂效果最佳,其中y5子离子的响应强度在C-末端y-系列产物离子中最高,适用于MRM监测,而y6子离子和y7子离子分别具有第2和第3高的响应强度。因此,选择m/z 526.272+~580.28+、m/z 526.272+~693.37+和 m/z 526.272+~840.44+的离子跃迁用于该特征肽段的鉴定。同上方法,获得其余肽段适用于MRM监测的离子对信息。以绥农1号大豆作为实验样本,对特征肽段的RT、CE值和DP值等MRM参数进行优化,最终的HPLC-MRM方法能够同时监测上述11 种大豆主要过敏原的29 条特征肽段(表2)。图5显示了正离子采集模式下绥农1号大豆样品中上述过敏原特征肽段的提取离子色谱图,各特征肽段在优化的色谱质谱条件下均得到较好的检测结果,对应的色谱峰分离效果良好、峰形对称且响应强度高。

图4 β-伴大豆球蛋白α亚基的特征肽段NPFLFGSNR的二级质谱图Fig. 4 Tandem mass spectrum of signature peptide NPFLFGSNR of β-conglycinin α subunit



图5 大豆主要过敏原特征肽段的提取离子色谱图Fig. 5 Extracted ion chromatograms of signature peptides of major allergens in soybean
2.6 特异性验证实验结果
用于检测的特征肽段应具有序列保守性,覆盖绝大多数大豆品种,因此进一步利用24 个代表性大豆品种对所选择的特征肽段进行特异性验证。结果表明,同一条特征肽段在不同大豆品种中的响应强度存在差异,如 β-伴大豆球蛋白α亚基的特征肽段ESYFVDAQPK在焉耆黄豆中的响应强度最高,而在瑞金青皮豆中的响应强度最低;大豆球蛋白G1亚基的特征肽段VLIVPQNFVVAAR在焉耆黄豆中的响应强度与在上饶八月白中的响应强度相差一个数量级;KTI的特征肽段FIAEGHPLSLK在青豆中的响应强度为泌阳小籽黄的300多倍等。虽然不同大豆品种的肽段/蛋白质的组成和含量不同,但所选择的29 条特征肽段均存在于被测的24 个大豆品种中(图6),体现出良好的特异性。该结果与Ma Yingtao等[31]报道的桃脂转运蛋白(LTPI)的Pru p 3.01过敏原蛋白在不同栽培品种中的含量存在显著差异的结果一致。

图6 不同大豆品种中预选特征肽段的质谱检测结果Fig. 6 Mass spectrometry verification of signature peptides selected for different soybean cultivars
3 结 论
本研究结合Uniprot数据库和Skyline等生物信息学软件完成肽段匹配,成功筛选到可用于表征11 种大豆主要过敏原(大豆球蛋白的G1、G2、G3、G4和G5亚基, β-伴大豆球蛋白的α′、α和β亚基,P34、P28以及KTI)的特征肽段共29 条,并优化了这些肽段的三重四极杆串联质谱的MRM检测参数,利用24 个代表性大豆品种对特征肽段的特异性进行验证,从而建立了11 种大豆主要过敏原的UPLC-MS/MS-MRM定性检测方法。与现有大豆过敏原的HPLC-MS/MS检测方法相比,本方法检测目标包含了大豆球蛋白和β-伴大豆球蛋白的所有亚基,检测结果能够全面、准确地代表大豆品种和大豆制品中所含的过敏原。
引起食物过敏免疫应答的不是整个过敏原蛋白,而是其中某一段连续的氨基酸序列(线性抗原表位)或由几段不连续氨基酸序列形成的空间构象(构象表位)。现阶段,本实验所确定的特征肽段中,有些属于抗原表位的组成部分(如β-伴大豆球蛋白α亚基的特征肽段NPFLFGSNR和ESYFVDAQPK),有些则与抗原表位无关(如β-伴大豆球蛋白α亚基的特征肽段EQQQEQQQEEQPLEVR)。由于在加工食品中蛋白质易发生降解,此时应用本实验中某些特征肽段得到的过敏原含量可能无法与实际样品的致敏性强弱相关联[32]。
本研究下一步将以挖掘到的特征肽段为检测靶标,合成相应的稳定同位素标记多肽,详尽考察定量限、检出限、回收率、重复性等方法学要素,最终建立食品中11 种大豆主要过敏原的定量检测方法,为大豆过敏研究、大豆脱敏试剂开发以及低致敏性大豆品种培育、婴幼食品中大豆蛋白含量检测等提供技术支持,为完善我国食物过敏标签立法和食品安全监管提供技术保障。
