五味子甲素对四氯化碳诱导小鼠肝纤维化的保护作用及其机制研究
2020-12-28王肖辉周霖杜秋争师莹莹荆自伟
王肖辉 周霖 杜秋争 师莹莹 荆自伟
摘 要 目的:研究五味子甲素(SA)對四氯化碳(CCl4)诱导肝纤维化模型小鼠的保护作用及其机制。方法:将小鼠随机分为空白对照组、模型组、水飞蓟素组(阳性对照,100 mg/kg)和SA低、高剂量组(20、40 mg/kg),每组10只。除空白对照组外,其余组小鼠均采用皮下注射CCl4法建立肝纤维化模型。建模成功后,各给药组小鼠灌胃相应药物,每天1次,连续给药6周;空白对照组和模型组小鼠同法灌胃等体积0.5%羧甲基纤维素钠溶液。采用苏木精-伊红染色法观察小鼠肝组织病理学变化;分别采用紫外分光光度法和酶联免疫吸附法检测小鼠血清肝损伤指标[丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)]水平和炎症因子[肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)、IL-6]含量;采用Western blotting法检测小鼠肝组织中NOD 样受体蛋白3(NLRP3)/核因子κB(NF-κB)和转化生长因子β(TGF-β)/Smad信号通路蛋白的表达水平。结果:与空白对照组比较,模型组小鼠肝组织纤维化病变明显;血清肝损伤指标水平和炎症因子含量均显著升高(P<0.01);肝组织中NLRP3、凋亡相关斑点样蛋白、胱天蛋白酶1、IL-1β、TGF-β1蛋白表达水平以及磷酸化NF-κB p65(p-NF-κB p65)/NF-κB p65、磷酸化NF-κB抑制蛋白α(p-IκBα)/IκBα、p-Samd3/Smad3比值均显著升高(P<0.01)。与模型组比较,各药物组小鼠肝组织纤维化病变均明显减轻;小鼠血清肝损伤指标水平和炎症因子含量以及肝组织中NLRP3/NF-κB和TGF-β/Smad信号通路蛋白的表达及磷酸化水平均显著降低(P<0.01)。结论:SA可有效减轻CCl4诱导肝纤维化模型小鼠的肝损伤和炎症程度,其可能是通过调节NLRP3/NF-κB和TGF-β/Smad3信号通路从而 发挥抑制肝纤维化的作用。
关键词 肝纤维化;五味子甲素;NOD 样受体蛋白3/核因子κB信号通路;转化生长因子β/Smad信号通路;小鼠
中图分类号 R285.5 文献标志码 A 文章编号 1001-0408(2020)22-2725-06
DOI 10.6039/j.issn.1001-0408.2020.22.07
ABSTRACT OBJECTIVE: To study the protective effect of schisandrin A (SA) on CCl4-induced liver fibrosis model mice and its mechanism. METHODS: Mice were randomly divided into blank control group, model group, silymarin group(positive control, 100 mg/kg), SA low-dose and high-dose groups (20, 40 mg/kg), with 10 mice in each group. Except for blank control group, other groups were given CCl4 subcutaneously to induce liver fibrosis model. After successful modeling, administration groups were given relevant medicine intragastrically, once a day, for consecutive 6 weeks; blank control group and model group were given constant volume of 0.5%sodium carboxymethyl cellulose solution intragastrically by the same way. HE staining was used to observe the pathological changes of liver tissue in mice. UV spectrophotometry and ELISA assay were adopted to detect the serum levels of liver injury indexes (ALT and AST) and the contents of inflammatory factors (TNF-α, IL-1β, IL-6). Western blotting assay was used to detect the expression of NOD like receptor protein 3 (NLRP3)/NF-κB and TGF-β/Smad signaling pathway protein. RESULTS: Compared with blank control group, obvious pathological changes of liver fibrosis were observed in model group. The serum levels of liver injury indexes and contents of inflammatory factors were significantly increased (P<0.01). The expression of NLRP3, apoptosis associated spot-like protein, Caspase-1 and IL-1β, TGF-β1 and ratios ofp-NF-κB p65/NF-κB p65, p-IκBα/IκBα, p-Samd3/Smad3 were increased significantly (P<0.01). Compared with model group, SA could significantly relieve hepatic fibrosis in mice, reduce serum levels of liver injury indexes and contents of inflammatory factors, as well as the expression of NLRP3/NF-κB and TGF-β/Smad signaling pathway protein and phosphorylation level (P<0.01). CONCLUSIONS: SA can effectively relieve liver injury and inflammation of CCl4-induced hepatic fibrosis model mice, which may be through the regulation of NLRP3/NF-κB and TGF-β/Smad3 signaling pathways, thus inhibiting the process of liver fibrosis.
KEYWORDS Liver fibrosis; Schisandrin A; NLRP3/NF-κB signaling pathway; TGF-β/Smad signaling pathway; Mice
肝纤维化是由各种致病因子所致肝内结缔组织异常增生的一种病理生理过程,后期会继续发展成为肝硬化,是目前威胁人类生命健康的重要疾病之一[1-2]。肝纤维化的主要发生机制是由于肝组织内细胞外基质(ECM)的超速合成与缓慢降解,最终导致ECM在肝内的过度沉积,这也是各种肝损伤类疾病发生、发展过程的共有病理学基础[3]。
中药五味子是木兰科植物五味子Schisandra chinensis(Turcz.)Baill或华中五味子Schisandra sphenanthera Rehd. et Wils.的干燥成熟果实,具有益气滋肾、生津敛汗、宁心安神及涩精止泻等功效,其主要有效成分为五味子甲素(Schisandrin A,SA)、五味子乙素、五味子醇甲、五味子酚等[4]。现代药理研究表明,SA具有明显的抗肝纤维化作用,然而其具体作用机制目前尚不明确[5-6]。邱宏涛等[7]基于网络药理学手段预测并验证了五味子的主要成分SA具有显著的抗炎作用,并能显著降低小鼠单核巨噬细胞RAW264.7中炎性因子如肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)、IL-6的分泌水平。有研究报道,SA可抑制小鼠骨髓来源巨噬细胞中NOD 样受体蛋白3(NLRP3)炎性小体的活性,而核因子κB(NF-κB)依赖的NLRP3炎性小体作为宿主免疫防御系统的重要组成部分,主要参与体内的炎症反应,是肝纤维化形成的重要信号通路[8-9]。有研究发现,五味子提取物(SA是其中重要组成部分)可通过抑制Smad信号转导通路从而降低转化生长因子β(TGF-β)介导的α-平滑肌肌动蛋白(α-SMA)的异常升高,最终起到抑制血管平滑肌细胞应激纤维形成和细胞迁移的作用[10]。由于TGF-β能够调控其下游的Smad信号通路蛋白,刺激其磷酸化过程从而介导ECM的合成与聚集,这与病理性纤维化过程密切相关[11],因此SA也可能通过该信号通路发挥抗纤维化作用。以上研究提示,肝纤维化与NLRP3/NF-κB和TGF-β/Smad信号通路密切相关,而SA是否可以通过干预以上信号通路从而发挥抗纤维化的作用,目前尚未有相关报道。因此,本研究采用经典的四氯化碳(CCl4)诱导法建立小鼠肝纤维化模型,并基于NLRP3/NF-κB和TGF-β/Smad信号通路,深入挖掘SA对小鼠肝纤维化的影响及其相关机制,为中药有效成分治疗肝纤维化提供研究思路和实验基础。
1 材料
1.1 仪器
ME104E型分析天平(瑞士Mettler Toledo公司);Heraeus Fresco 17 Centrifuge型微量冷凍离心机(美国Thermo Fisher Scientific公司);DYY-6C型电泳仪(北京市六一仪器厂公司);SpectraMax i3x型多功能酶标仪(美国Molecular Devices公司);RT-6000型酶标分析仪(深圳雷杜生命科学股份有限公司);ECLIPSE Ti2型倒置显微镜(日本Nikon公司);ChemiDoc XRS+型全自动化学发光凝胶成像分析系统(美国Bio-Rad 公司)。
1.2 药品与试剂
SA对照品(成都曼斯特生物科技有限公司,批号:MUST-17022401,纯度:97%);水飞蓟素对照品(阳性药物,宝鸡市辰光生物科技有限公司,批号:HG1144W1,纯度:98%);TNF-α、IL-6、IL-1β酶联免疫吸附测定法(ELISA)检测试剂盒和BCA蛋白提取及浓度测定试剂盒(北京索莱宝科技有限公司,批号:SEKM-0034、SEKM-0007、SEKM-0002、PC0020);丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)检测试剂盒(南京建成生物工程研究所,批号:C010-2-1、C009-2-1);兔源NLRP3、凋亡相关斑点样蛋白(ASC)、胱天蛋白酶1(Caspase-1)、IL-1β、NF-κB p65、磷酸化NF-κB p65(p-NF-κB p65)、NF-κB抑制蛋白α(IκBα)、磷酸化IκBα(p-IκBα)、TGF-β1、Smad3、磷酸化Smad3(p-Smad3)、甘油醛-3-磷酸脱氢酶(GAPDH)多克隆抗体以及辣根过氧化物酶标记的山羊抗兔IgG二抗(美国Cell Signaling Technology公司,批号:13158、67824、24232、12703、59674、8214、4812、8219、3709、9513、9520、5174、4414);高敏型ECL化学发光检测试剂盒(南京唯诺赞生物科技股份有限公司,批号:E412-02);RIPA裂解液(碧云天生物技术有限公司,批号:P0013B);羧甲基纤维素钠(CMC-Na)、苏木精-伊红(HE)染色试剂及聚丙烯酰胺凝胶等其余试剂均购自上海阿拉丁试剂公司,实验用水为三级水。
1.3 动物
50只雄性ICR小鼠,8~12周龄,体质量18~22 g,购自上海西普尔-必凯实验动物有限公司[动物生产许可证号:SCXK(沪)2020-0006]。所有动物于室温(22±1) ℃、空气湿度40%~50%、昼夜交替时间12 h/12 h条件下,以普通饲料喂养并自由饮水。
2 方法
2.1 造模
采用经典的CCl4诱导法[12]建立小鼠肝纤维化模型:将CCl4与橄榄油按体积比1 ∶ 1配制成油溶液后进行小鼠皮下注射,注射体积为3 mL/kg,每周2次(间隔3 d),连续注射6周。空白对照组小鼠同法注射等体积橄榄油。肝纤维化模型复制成功的评判标准[13]:基本体征方面表现为活动减少、反应迟钝,毛色粗糙、灰暗、无光泽;生化指标方面表现为血清中肝损伤指标AST、ALT水平以及血清炎症因子TNF-α、IL-1β、IL-6含量明显升高;病理学变化方面表现为肝小叶结构破坏,有炎性细胞浸润,并出现大量纤维增生。
2.2 分组与给药
将小鼠随机分为空白对照组、模型组、水飞蓟素组(100 mg/kg)和SA低、高剂量组(20、40 mg/kg),每组10只。按“2.1”项下方法分别注射橄榄油或CCl4油溶液建立模型。末次皮下注射24 h后,水飞蓟素组和SA低、高剂量组小鼠分别灌胃相应药物(SA和水飞蓟素均以0.5%CMC-Na生理盐水溶液为溶剂,分别配制成5、2 mg/mL的混悬液后给药;给药剂量参考相关文献并按动物剂量换算而得[14-16]),灌胃体积均为20 mL/kg(其中SA低剂量组用生理盐水补足灌胃体积至20 mL/kg);空白对照组和模型组小鼠灌胃等体积0.5%CMC-Na生理盐水溶液。各组小鼠均每天给药1次,连续给药6周。
2.3 小鼠血清中肝损伤指标水平检测
末次灌胃给药24 h后,于小鼠眼眶取血并制备血清。取部分血清样品,严格按相应试剂盒说明书操作,按紫外分光光度法采用酶标分析仪检测血清中AST和ALT的水平。
2.4 小鼠血清中炎症因子含量检测
取“2.3”项下小鼠血清样品,严格按照相应ELISA检测试剂盒说明书操作,以多功能酶标仪检测血清中TNF-α、IL-1β、IL-6的含量。
2.5 小鼠肝组织病理学检查
小鼠取血完毕后,给予戊巴比妥麻醉并处死,立即取出肝脏,在4%中性甲醛溶液中固定过夜,脱水,石蜡包埋,切片(4 μm)后进行HE染色,置于倒置显微镜下观察并拍照。
2.6 小鼠肝组织中NLRP3/NF-κB及TGF-β/Smad信号通路蛋白表达水平检测
采用Western blottting法进行检测。取“2.5”项下肝组织适量,用含有蛋白酶抑制剂的RIPA裂解液在冰上充分裂解,提取总蛋白,并采用BCA法测定蛋白含量。取蛋白样本50 μg,变性处理后,采用12%聚丙烯酰胺凝胶电泳,并转至聚偏氟乙烯薄膜上,于4 ℃下用5%脱脂牛奶封闭2 h;然后加入NLRP3、ASC、Caspase-1、IL-1β、NF-κB p65、p-NF-κB p65、IκBα、p-IκBα、TGF-β1、Smad3、p-Smad3抗体(稀释度均为1 ∶ 1 000),4 ℃下孵育过夜;用TBST缓冲液洗膜,加入二抗(稀释度为1 ∶ 10 000),室温孵育2 h;用TBST缓冲液洗膜,加入ELC发光液后,在全自动化学发光凝胶成像分析系统中曝光显影。采用Image J 1.8.0软件对目的蛋白条带进行分析,以GAPDH为内参,以各目标条带与内参的灰度值比值表示其蛋白表达水平,以p-NF-κB p65/NF-κB p65、p-IκBα/IκBα、p-Smad/Smad3灰度值比值表示相应蛋白的磷酸化水平。
2.7 统计学方法
采用SPSS 21.0软件对数据进行统计分析。计量资料均以x±s表示,组间比较采用单因素方差分析(One-way ANOVA)。P<0.05为差异有统计学意义。
3 结果
3.1 SA对肝纤维化模型小鼠血清肝损伤指标水平的影响
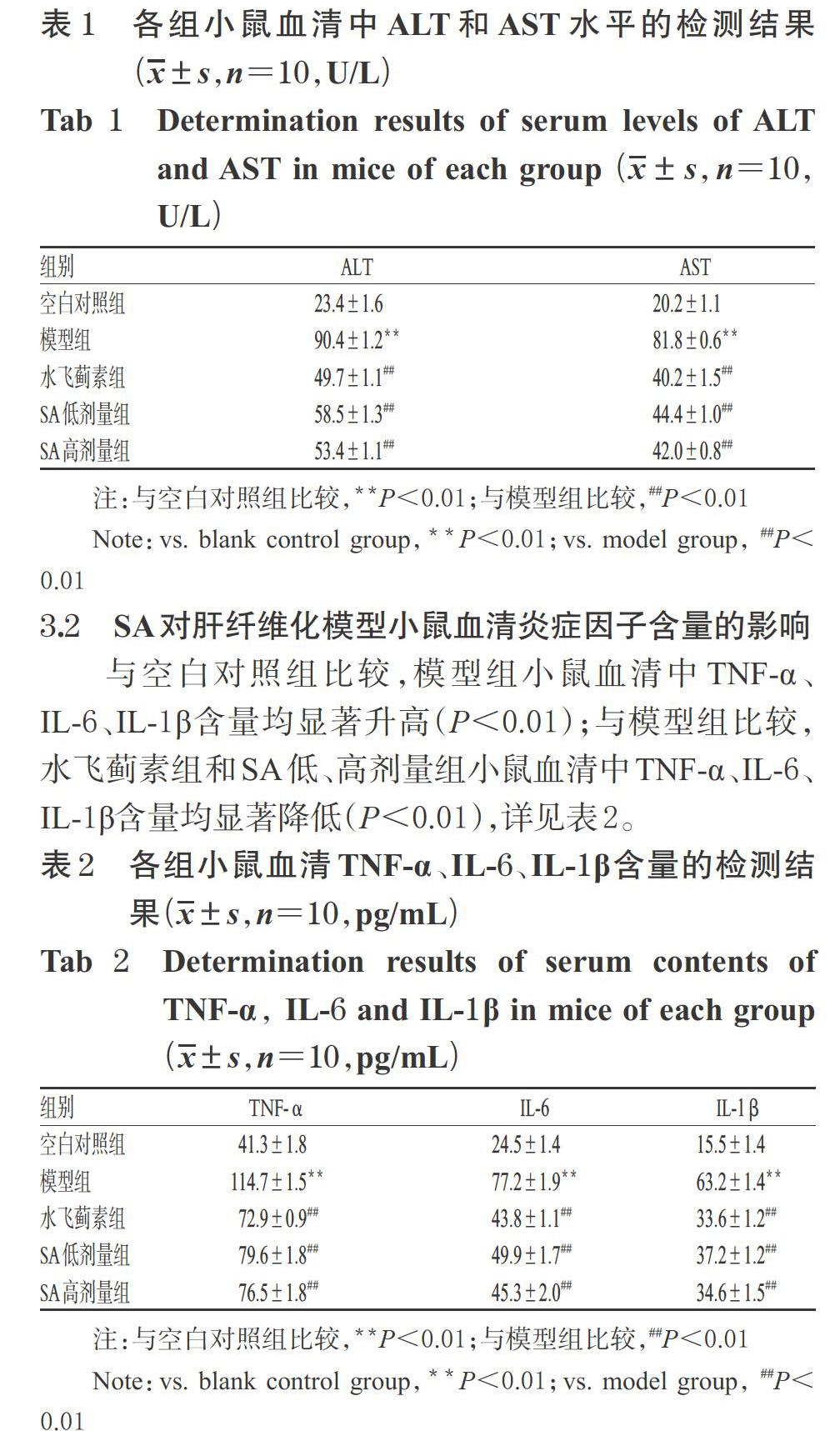
与空白对照组比较,模型组小鼠血清中ALT和AST水平均显著升高(P<0.01);与模型组比较,水飞蓟素组和SA低、高剂量组小鼠血清中ALT和AST水平均显著降低(P<0.01),详见表1。
3.2 SA对肝纤维化模型小鼠血清炎症因子含量的影响
与空白对照组比较,模型组小鼠血清中TNF-α、IL-6、IL-1β含量均显著升高(P<0.01);与模型组比较,水飞蓟素组和SA低、高剂量组小鼠血清中TNF-α、IL-6、IL-1β含量均显著降低(P<0.01),详见表2。
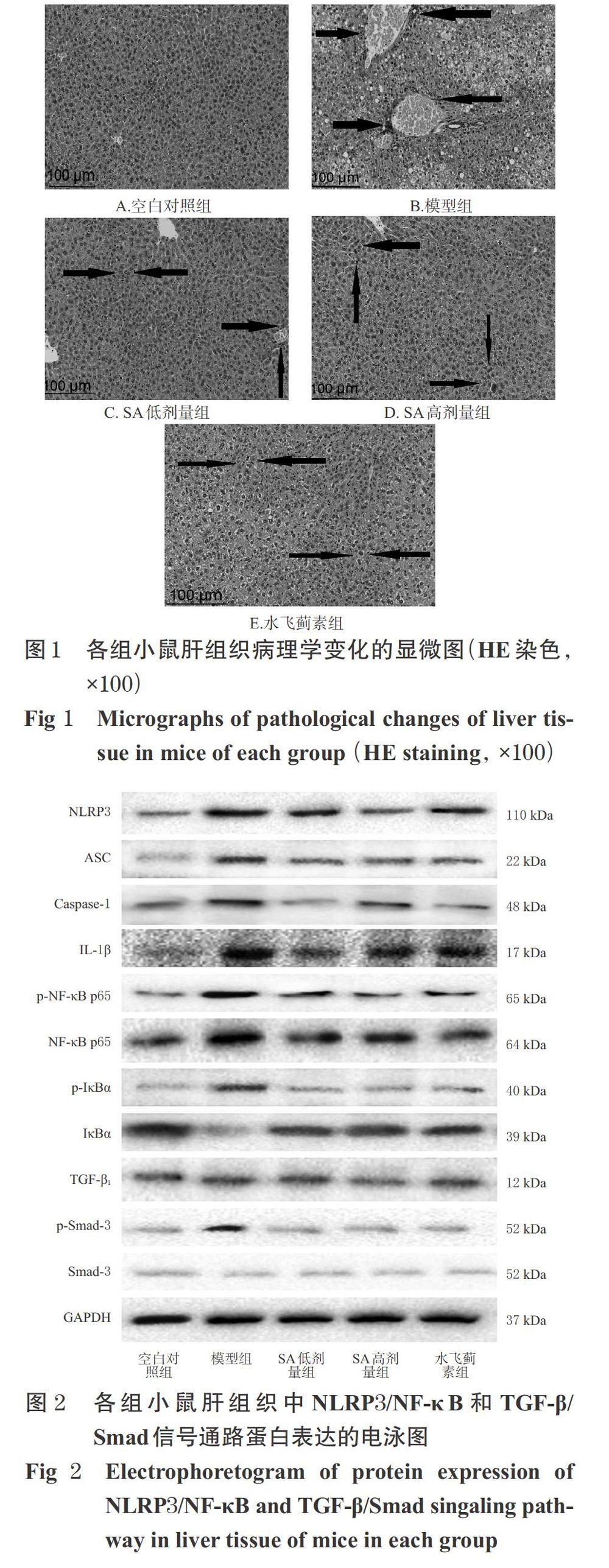
3.3 SA對肝纤维化模型小鼠肝组织病理学变化的影响
空白对照组小鼠肝细胞索排列规则,细胞结构完整,小叶轮廓清晰;模型组小鼠肝细胞出现明显水肿,肝细胞体积变大,肝中央静脉结构异常、充血扩张,肝细胞索呈不规则排列,有炎性细胞浸润;水飞蓟素组和SA低、高剂量组小鼠肝细胞炎性病变及坏死程度均较模型组明显减轻,其肝组织病理变化程度处于空白对照组与模型组之间,详见图1(图中,“箭头”所指为炎性病变和坏死的区域)。
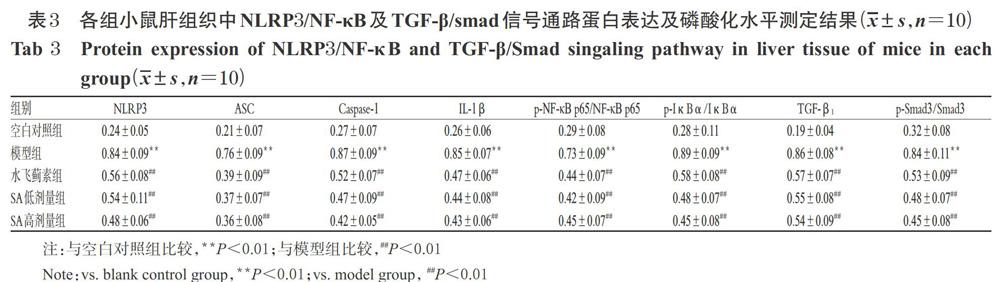
3.4 SA对肝纤维化模型小鼠肝组织中NLRP3/NF-κB及TGF-β/Smad信号通路蛋白表达的影响
与空白对照组比较,模型组小鼠肝组织中NLRP3、ASC、Caspase-1、IL-1β、TGF-β1蛋白的表达水平以及p-NF-κB p65/NF-κB p65、p-IκBα/IκBα、p-Smad/Smad3比值均显著升高(P<0.01);与模型组比较,水飞蓟素组和SA低、高剂量组小鼠肝组织中上述蛋白表达水平及比值均显著降低(P<0.01),详见图2、表3(注:图2中p-NF-κB p65/NF-κB p65为p-NF-κB/NF-κB在体内的活化亚基形式)。
4 讨论
肝纤维化的主要病理学机制是由于肝组织内ECM的超速合成与缓慢降解,最终导致肝内ECM的过度沉积[3,17]。肝星状细胞(HSC)是弥散性ECM的主要来源,且活化的HSC还可进一步转化为肌成纤维细胞,是肝纤维化发生的关键环节[18]。当前治疗肝纤维化的药物可在一定程度上限制疾病的快速发展,然而抗纤维化治疗药物的研究仍然以针对病因为主,真正直接干预纤维化的特异性药物的研发较少,临床治疗效果并不明显[19]。临床常规手段主要是依靠对症治疗,如使用保肝降酶药物等,但这些手段并不能从根本上解决问题,反而有引起药源性疾病的风险。SA是从中药五味子中提取出的主要有效成分,具有保肝护肝、逆转肝损伤的作用,是当前临床治疗肝纤维化的有效补充手段,能够明显改善患者肝功能,阻断疾病发生发展的关键靶点通路,从而发挥高效低毒的治疗作用[4,6]。因此,本研究以经典的天然保肝药物水飞蓟素[16]为阳性对照,通过小鼠肝纤维化模型对SA改善肝损伤和肝纤维化的作用及其相关信号通路机制进行了探索。
AST和ALT是反映肝功能的两个重要生化指标,当发生肝功能异常时,AST和ALT将会从肝细胞中被外排到达血液循环,从而表现为血液中这两项指标水平的急剧升高[20]。本研究结果显示,与空白对照组比较,模型组小鼠血清中AST、ALT水平均显著升高,表明CCl4诱导的模型小鼠的肝功能明显受损;而给予水飞蓟素和不同剂量SA干预后,小鼠血清中上述肝损伤指标水平均显著降低,提示SA对小鼠肝功能有明显的保护作用。
炎症途径在肝纤维化中起着至关重要的作用,研究证实,肝Kuffer细胞在损伤期间会募集中性粒细胞和T淋巴细胞等,并释放促炎介质如TNF-α、IL-1β、IL-6等,同时刺激HSC的纤维化活性[21]。因此,TNF-α、IL-1β、IL-6参与和促进了肝纤维化的进程,并可用于表征肝细胞的纤维化程度,是研究肝纤维化的重要生物学指标。本研究结果显示,与空白对照组比较,模型组小鼠血清中TNF-α、IL-1β、IL-6含量均显著升高,表明CCl4诱导的模型小鼠出现了明显的肝纤维化,实验模型建立成功;而给予水飞蓟素和不同剂量SA干预后,小鼠血清中上述炎症因子含量均显著降低,提示SA能明显减轻模型小鼠的肝纤维化程度。
本研究通过HE染色法观察小鼠肝组织病理学变化,结果显示,对照组小鼠细胞结构清晰、细胞索规则排列,无炎症浸润现象;模型组小鼠出现细胞水肿体积变大,细胞核聚集、皱缩以及炎性细胞浸润等现象,细胞索排列不规则,表明肝纤维化模型成功建立;而给予水飞蓟素和低、高剂量SA干预后,小鼠肝细胞炎性病变及坏死程度均较模型组明显减轻,提示SA能明显缓解模型小鼠的肝纤维化病理进展程度。
NLRP3/NF-κB信号通路的激活可导致炎症水平升高,进而促进纤维化进程中的作用已被证实,并被认为是经典的肝纤维化信号通路[22]。机体静息状态下,NF-κB可与IκBα结合形成三聚体,并在细胞质中以无活性的形式存在;而在被NLRP3等炎性小体刺激后,则可诱导炎症反应的发生,且以p65/p50异二聚体的活化形式存在[23]。NLRP3炎性小体是宿主免疫防疫系统的重要成员,该炎症小体主要由NLRP3、Caspase-1和ASC等3种蛋白组成;同时,Caspase-1可以将无活性IL-1β前体(pro-IL-1β)剪切为IL-1β并释放到胞外,从而引发下游炎症反应,而IL-1β是NLRP3下游炎症通路中的重要因子[24-25]。上述4种蛋白的表达水平升高,则提示机体炎性水平升高、炎症通路被激活。本研究结果显示,与空白对照组比较,模型组小鼠肝组织中NLRP3、ASC、Caspase-1、IL-1β蛋白表达水平以及p-NF-κB p65/NF-κB p65、p-IκBα/IκBα比值均显著升高,表明模型组小鼠出现明显的肝纤维化;而给予水飞蓟素和不同剂量SA干预后,小鼠肝组织中上述5个蛋白的表达水平均显著降低,表明SA可能是通过干预NLRP3/NF-κB信号通路从而起到有效减轻小鼠肝纤维化的作用。
TGF-β1是目前公认的最强促纤维化因子之一,其主要通过促进纤维细胞增殖、转化和转分化,以及在转录和转录后水平调节胶原等ECM的表达并有效抑制其降解来高效促进组织纤维化[26]。Smad蛋白是TGF-β1信号转导至核内关键的下游信号物质,TGF-β1可通过增加Smad3磷酸化水平来发挥其促肝纤维化的作用[27]。Smad7是该信号通路的负调节因子,可以通过与Smad3产生竞争性抑制,从而阻断TGF-β/Smad3信号传导,最终抑制肝纤维化的发生[28];且已有实验证实敲除Smad7编码基因后,小鼠肝纤维化可在短时间内快速形成[29]。因此,TGF-β/Smad3信号通路是肝纤维化形成的关键重要信号通路。本研究结果显示,与空白对照组比较,模型组小鼠肝组织中TGF-β1蛋白表达水平以及p-Smad3/Smad3比值均显著升高,表明模型小鼠肝纖维化程度加重;而给予水飞蓟素和不同剂量SA干预后,小鼠肝组织中TGF-β1蛋白表达水平以及p-Smad3/Smad3比值均显著降低,表明SA可干预TGF-β/Smad3通路信号转导,有效抑制TGF-β1的表达和Smad3的活化,从而抑制肝纤维化的疾病进展。
综上所述,SA可有效减轻CCl4诱导肝纤维化模型小鼠的肝损伤和炎症程度,其可能是通过调节NLRP3/NF-κB和TGF-β/Smad3信号通路从而发挥抑制肝纤维化进程的作用。
参考文献
[ 1 ] 蒋园,白云,刘萍,等.黄芪甲苷对CCl4所致小鼠肝损伤的影响[J].中药药理与临床,2015,31(6):24-27.
[ 2 ] 周璐,宋新龙,吕军苹,等.马齿苋对四氯化碳诱导小鼠急性肝损伤的保护作用[J].中国实验方剂学杂志,2020,26(10):35-43.
[ 3 ] 谢爱泽,吕超,石清兰,等.中医药防治肝纤维化机制的研究进展[J].中国医药导报,2020,17(17):34-37.
[ 4 ] 罗运凤,高洁,柴艺汇,等.五味子药理作用及临床应用研究进展[J].贵阳中医学院学报,2019,41(5):93-96.
[ 5 ] 孙,彭修娟,徐虹.南五味子化学成分及药理学研究进展[J].陕西中医学院学报,2007,30(4):74-75.
[ 6 ] 李静,张培,李文尧,等.五味子甲素研究进展[J].中国药业,2020,29(5):53-56.
[ 7 ] 邱宏涛,赵筱萍,李正,等.基于网络药理学的五味子木脂素类主要药效作用研究[J].中国中药杂志,2015,40(3):522-527.
[ 8 ] 崔鹤蓉,李朋彦,李雨萌,等.五味子甲素对NLRP3炎性小体活性的抑制作用及机制初步研究[J].药学学报,2017,52(1):80-85.
[ 9 ] JO EK,KIM JK,SHIN DM,et al. Molecular mechanisms regulating NLRP3 inflammasome activation[J]. Cell Mol Immunol,2016,13(2):148-159.
[10] CHUN JN,KIM SY,PARK EJ,et al. Schisandrin B suppresses TGF beta1-induced stress fiber formation by inhi- biting myosin light chain phosphorylation[J]. J Ethnopharmacol,2014,152(2):364-371.
[11] 赵静,成军.肝纤维化发生信号通路的研究进展[J].中华肝脏病杂志,2019,27(6):403-406.
[12] 余万桂,张恒文,贺尚荣,等.三七总皂苷对肝纤维化小鼠血清中转化生长因子-β1及白介素-1的影响[J].时珍国医国药,2006,17(1):54-55.
[13] 孙家昌,孙妩弋,厉歆然,等.不同浓度四氯化碳诱导小鼠肝纤维化模型的比较[J].实验动物与比较医学,2018,38(4):255-260.
[14] 徐志立,梁晗业,胡丽萍,等.五味子甲素对溃疡性结肠炎小鼠血液流变性及凝血功能的影响[J].现代生物医学进展,2017,17(24):4631-4634.
[15] 梁晗業,徐志立,陶小军,等.五味子甲素对小鼠溃疡性结肠炎的治疗作用[J].中药药理与临床,2017,33(3):38-42.
[16] 李佐军.水飞蓟素对CCl4和/或酒精所致小鼠肝纤维化的保护作用及机制初探[D].长沙:中南大学,2008.
[17] 江宇泳,王宪波.复方中药抗肝纤维化的研究进展[J].时珍国医国药,2008,19(11):2725-2727.
[18] 杨悦杰,黄芬.肝星状细胞及相关细胞因子在肝纤维化形成中的作用[J].世界华人消化杂志,2007,15(27):2885- 2890.
[19] 陈永平.浅析肝纤维化治疗现状[J].现代实用医学,2018,30(3):281-283.
[20] 林文海.芪苓散粗多糖对四氯化碳引起急性肝损伤雏鸡血清中ALT和AST的影响[J].福建畜牧兽医,2020,42(2):4-6.
[21] 吴聪,张荣臻,王挺帅,等.细胞因子对肝纤维化发展影响的研究进展[J/OL].海南医学院学报,2020:1-10[2020- 08-24]. https://doi.org/10.13210/j.cnki.jhmu.20200706. 001.
[22] 赵静,成军,ZHAO J,等. TAF和TDF上调NS5ATP9,汇集调控TGFβ1/Smad3、NF-κB/NLRP3炎性小体信号通路,抑制肝纤维化[J].临床肝胆病杂志,2020,36(3):591.
[23] 刘元山,陈剑群,朱炳喜.细胞因子表达与NF-κB活化在溃疡性结肠炎发病中的意义[J].徐州医学院学报,2009,29(8):553-556.
[24] 张飞,李湘民,张方杰. NOD样受体家族核苷酸结合寡聚化结构域样受体3炎性小体在脓毒症中的作用[J/CD].中华危重症医学杂志:电子版,2018,11(6):420- 424.
[25] 黄晨恺,甘达凯,张望,等.熊果酸对肝纤维化大NOX2/ROS/NLRP3炎性小体活化的影响[J].基础医学与临床,2018,38(4):485-491.
[26] 邵松军,方海燕,叶贤伟,等. TGFβ1/Smad3信号通路介导的赖氨酸羟化酶2活性变化在肺纤维化胶原沉积中的作用[J].中国病理生理杂志,2019,35(10):1858-1863.
[27] 于洋,史嘉翊,黄珍,等.肝纤维化中TGF-β/Smad信号通路研究进展[J].牡丹江医学院学报,2019,40(5):121- 123、174.
[28] 彭琴,赵绅君,李武.肝纤维化相关信号转导通路研究进展[J].临床肝胆病杂志,2017,33(5):954-958.
[29] 王琳,邓跃毅,陈以平. Smad7对TGF-β/Smad信号转导通路的调节及其在肾纤维化中的作用[J].第二军医大学学报,2004,25(2):207-209.
(收稿日期:2020-06-23 修回日期:2020-10-20)
(编辑:段思怡)
