《美国药典》《欧洲药典》《日本药典》与《中国药典》中中药饮片微生物限度检查及标准的比较研究
2020-12-28范一灵李琼琼秦峰刘浩杨美成
范一灵 李琼琼 秦峰 刘浩 杨美成

摘 要 目的:比較《美国药典》43版(USP43)、《欧洲药典》10.0版(EP10.0)、《日本药典》17版(JP17)与《中国药典》2020年版(ChP2020)中中药饮片微生物限度检查方法及标准的差异,为我国中药饮片相关微生物标准的修订和完善提供参考。方法:比较USP43、EP10.0、JP17和ChP2020在中药饮片的微生物计数法(包括抽样与取样、菌种和培养基选择、微生物和耐热菌计数等)、控制菌检查(包括样品前处理、增菌、分离、鉴定等)、微生物相关限度标准等方面的差异。结果与结论:在中药饮片微生物的检查方法上,USP43、EP10.0、JP17都有各自独立的规定,ChP2020则新增了“通则1108”。在检验项目上,除需氧菌总数、霉菌和酵母菌总数外,ChP2020与EP10.0规定了3种控制菌(耐胆盐革兰阴性菌、大肠埃希菌、沙门菌)的检查方法;在此基础上,JP17补充了金黄色葡萄球菌的检查方法;USP43增加了梭菌的检查方法,并最早提出不可接受微生物风险评估理念;ChP2020还新增了耐热菌计数方法。在微生物限度标准上,USP 43对中药饮片的分类最为细致,要求较为严格且高于EP10.0、JP17;ChP2020仍未对中药饮片控制菌检查设立统一的限度标准。虽然,ChP2020对“中药提取物及中药饮片的微生物限度标准”进行了修订,但相较于美国、欧洲和日本药典的规定还不完善。建议根据我国中药饮片微生物污染和控制现状,逐步完善药典对中药相关产品的微生物检验和限度标准,合理细化相应产品的微生物限度水平。
关键词 中药饮片;药典;微生物检查;限度标准;比较研究
中图分类号 R921;R927.1 文献标志码 A 文章编号 1001-0408(2020)22-2695-06
DOI 10.6039/j.issn.1001-0408.2020.22.02
ABSTRACT OBJECTIVE: To compare the difference of microbiological limit test and criteria of TCM decoction pieces among 43 edition of United States Pharmacopeia (USP43), 10.0 edition of European Pharmacopeia (EP10.0), 17 edition of Japanese Pharmacopeia (JP17) and 2020 edition of Chinese Pharmacopeia (ChP2020), and to provide refernce for the revision and improvement of microbiological standards for TCM decoction pieces in China. METHODS: The differences in the microbial enumeration tests method (including sampling and sample preparation, selection of bacteria and culture medium, count of microorganisms and heat-resistant bacteria, etc.), tests for specified microorganisms (including sample pretreatment, enrichment, separation and identification, etc.) and microbial related limit criteria were compared among USP43, EP10.0, JP17 and ChP2020. RESULTS & CONCLUSIONS: In terms of microbiological examination of TCM decoction pieces, USP43, EP10.0, JP17 had their own independent provisions. Chp2020 added “general rule 1108”. In terms of inspection items, in addition to the total aerobic bacteria count and total combined yeasts and molds count, ChP2020 and EP10.0 provided three methods for the inspection of control bacteria (bile-resistant Gram-negative bacteria, Escherichia coli, Salmonella). On the basis, JP17 supplemented Staphylococcus aureus test; However, USP43 added Clostridium test method and put forward the concept of objectionable microorganisms risk assessment; ChP2020 also added a new method for counting heat-resistant bacteria. In terms of microbial limit criteria, USP43 was the most detailed in the classification of TCM decoction pieces, which was more strict than EP10.0 and JP17; ChP2020 had not set up a unified limit for the inspection of control bacteria of TCM decoction pieces. ChP2020 revised the “microbial limit standard for TCM extracts and TCM decoction pieces”, but it was not perfect compared with the Pharmacopoeia of the United States, Europe and Japan. It is suggested that according to the current situation of microbial contamination and control of TCM decoction pieces, the microbial limit test and criteria of TCM related products in Pharmacopoeia should be gradually improved, and the microbial limit level of corresponding products should be reasonably refined.
KEYWORDS TCM decoction piece; Pharmacopeia; Microbial limit test; Limit criteria; Comparative study
中药饮片是由中药材通过炮制加工而成的可直接用于中医临床的产品,其大多源自天然植物、动物或矿物,通常携带有大量微生物[1-2]。多数中药饮片的炮制过程简单(如净制、炒制等),灭菌不完全,使得具有致病力的微生物有所残余[3-4];此外,在运输和贮存过程中,与操作人员及外部非洁净环境的接触也增加了中药饮片受致病微生物污染的可能,从而使其安全性受到影响[5]。
中药饮片的微生物污染情况尚未得到足够的关注,对其加工过程中微生物种群变化的研究也较为缺乏,这导致了中药饮片微生物安全性评价的缺失。许多潜在的致病微生物(如耐热菌和细菌毒素等)未能得到有效控制,增加了免疫力低下患者在使用中药饮片过程中的风险[6]。虽然2015年版《中国药典》(一部)收录了中药饮片品种理化性质分析的多种鉴别和检查方法,但相关微生物的具体检查方法和限度标准却长期处于缺失状态;同时,在2015年版《中国药典》(四部)通则中,除直接入口的中药饮片外,并未规定其余形式中药饮片的微生物相关检查项目[7]。
中药在欧洲被称为植物药,在日本被称为生药,在美国被归为营养补充剂,虽然其概念与我国的中药饮片不完全相同[8-9],但在《欧洲药典》10.0版(EP10.0)[10]、《日本药典》17版(JP17)[11]和《美国药典》43版(USP43)[12]中都分别明确收载了相关产品(植物药、生药或营养补充剂)的微生物检查方法及限度标准。2020年版《中国药典》(ChP2020)(四部)[13]增加了“中药饮片微生物限度检查法”(通则1108),但相关的微生物限度标准还不完善,而且对煎煮类中药饮片的微生物限度标准亦未作出统一、明确的规定。本文通过比较USP43、EP10.0、JP17和ChP2020在中药饮片微生物检查方法和限度标准等方面的差异,了解中药饮片微生物标准的修订方向,探讨对中药饮片按其风险等级设立微生物限度的必要性,以期为我国中药饮片微生物控制相关标准的修订和完善提供参考。
1 中药饮片微生物计数
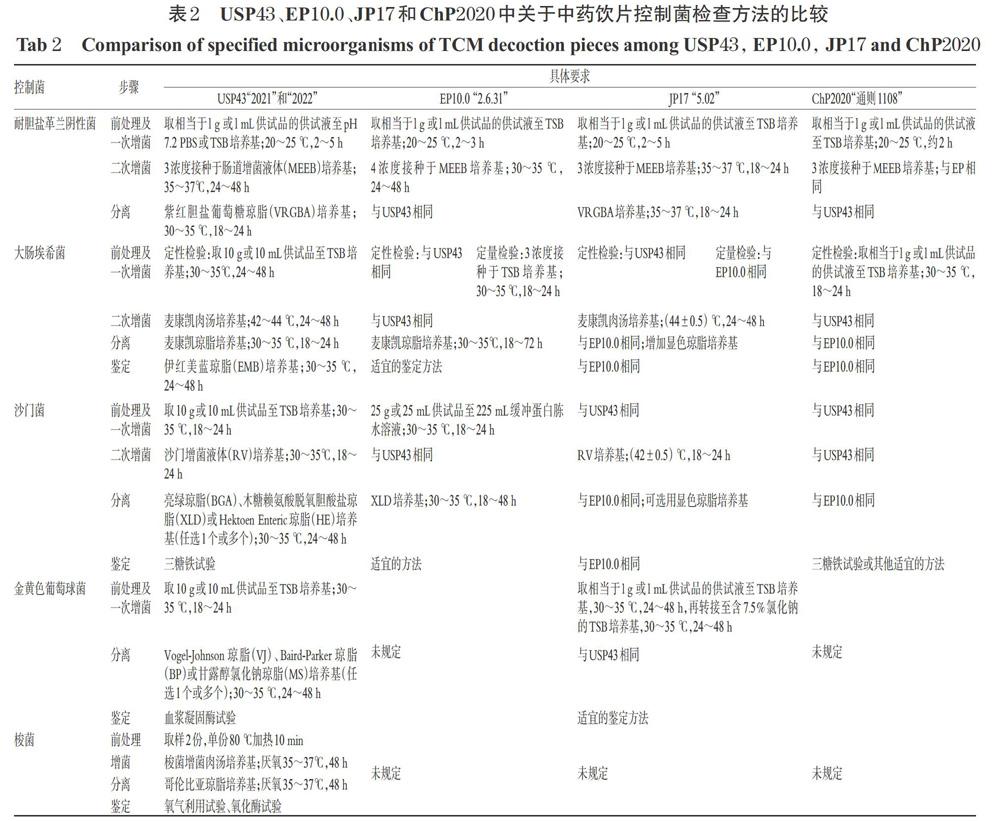
笔者通过对EP10.0、JP17、USP43和ChP2020中与中药饮片相关的微生物检验方法进行比较后发现,虽然前3部药典在非无菌产品微生物检查部分进行了国际间的协调与融合,但在中药饮片微生物的检查上,三者均有各自独立的章节规定,如EP10.0“2.6.12”和“2.6.31”、 JP17“5.02”、USP43“2021”和“2022”,而ChP2020则新增了“通则1108”用于检测中药饮片中的微生物。在检测项目上,4部药典均规定了需氧菌总数(Total aerobic microbial count,TAMC)、霉菌和酵母菌总数(Total combined yeasts and moulds count,TYMC)的检查方法,其主要区别体现在抽样与取样、菌种和培养基、微生物计数方法等方面,详见表1。
1.1 抽样与取样
中药饮片种类繁多,形狀、质地和大小各异,加之微生物污染具有不均匀的特点,因此抽样和检验取样的代表性至关重要[14]。4部药典在“抽样与取样”的规定上有明显区别。其中,EP10.0“2.6.12”[10]和USP43“2021”[12]对中药饮片抽样的要求与化学药品相同,取样量为10 g或10 mL。JP17“5.02”[11]规定了4种针对中药饮片的抽样方式,分别为:(1)小体积或粉末状样品,取50~250 g样品混匀;(2)大体积样品,取250~500 g样品混匀并切碎;(3)单个样品不少于100 g,至少取5个或500 g,切碎后混匀;(4)以溶液或制剂形式的样品混匀后直接取样。从上述混匀的样品中取10 g或10 mL作为样品检验。ChP2020“通则1108”[13]则指出,“除另有规定外,参照药材和饮片取样法(‘通则0211)抽取试验样品,大包装饮片每批抽取100~500 g,混匀;独立小包装饮片按装量抽取100~500 g的包装数;检验量除另有规定外均为25 g或25 mL,贵重品种或密度较小品种可酌减”。
1.2 菌种和培养基选择
在菌种选择方面,USP43列出了包含金黄色葡萄球菌ATCC 6538、大肠埃希菌ATCC 8739、枯草芽孢杆菌ATCC 6633、白色念珠菌ATCC 10231和巴西曲霉ATCC 16404在内的5种微生物用于培养基适用性和方法适用性检查[12]。EP10.0和JP17将大肠埃希菌更换为铜绿假单胞菌ATCC 9027,并对上述各菌种给出了英国食品工业与海洋细菌菌种保藏中心(National Collections of Industrial,Food and Marine Bacterial,NCIMB)、法国巴斯德研究所菌种保藏中心(Collection de LInstitut Pasteur Of Institut Pasteur,CIP)和日本生物资源中心(NITE Biological Resource Center,NBRC)的等效菌株编号,该规定与人用药品注册技术要求国际协调会议(International Council for Harmonization,ICH)的协调案一致[10-11]。ChP2020的菌种种类与EP10.0和JP17相同,但仅允许使用CMCC菌种[13]。
在培养基的选择上,除采用TSA培养基和SDA培养基作为常规计数培养基外,考虑到中药饮片常常存在较多的不溶性物质和较高的细菌、真菌污染概率,上述因素均有可能影响TAMC和TYMC计数结果,JP17还规定可在TSA培养基中可添加一定浓度的TTC以用于区分细菌菌落和其他杂质;如真菌生长影响样品TAMC计数结果,可在TSA培养基中添加两性霉素B以抑制真菌生长;如真菌在含抗生素的SDA培养基中蔓延生长,则可添加玫瑰红成分以抑制蔓延现象[11]。ChP2020规定当TYMC计数受细菌生长影响时,可使用含抗生素(如氯霉素、庆大霉素)的SDA培养基或其他选择性培养基(如玫瑰红钠琼脂培养基)[13]。但USP43和EP10.0均未明确提及相关要求。
3.2 JP17
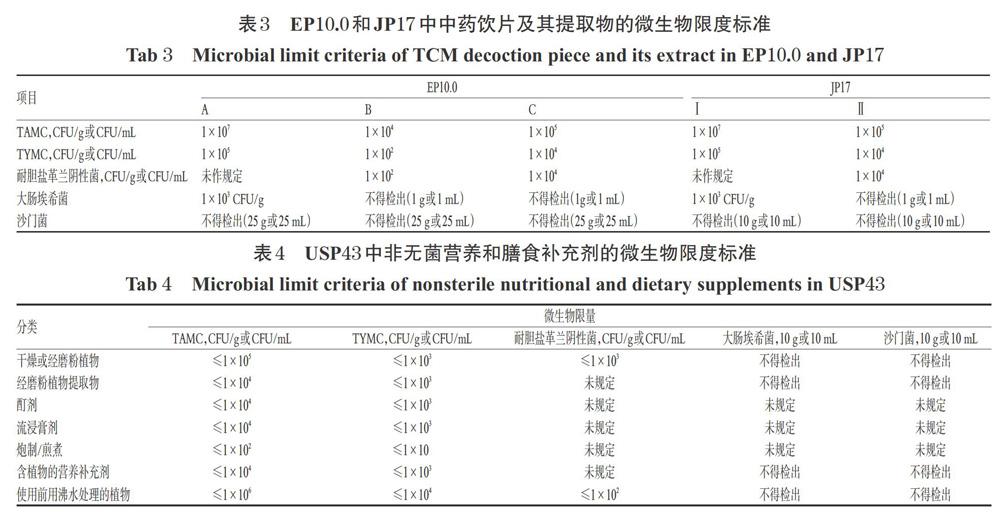
JP17“G4”将中药饮片及其提取物分成两类:经沸水处理的样品(Ⅰ类)和无需经过提取工艺直接使用的样品(Ⅱ类)[11]。比较而言,JP17中Ⅰ类产品相当于EP10.0中A类产品,JP17的Ⅱ类与EP10.0中的C类相近,但JP17中未规定EP10.0中B类产品的限度标准,详见表3。
3.3 USP43
相比于EP10.0和JP17的饮片分类,USP43在非无菌营养和膳食补充剂的微生物限度标准“2023”中对含有中药(植物药)的产品进行了较为详细的分类,共有干燥或经磨粉植物、经磨粉植物提取物等7个类别,详见表4。其中,干燥或经磨粉植物样品的要求为TAMC计数≤1×105 CFU/g(或CFU/mL),TYMC计数≤1×103 CFU/g(或CFU/mL),且每10 g不得检出大肠埃希菌和沙门菌,该要求高于EP10.0和JP17对相同分类产品的要求。
3.4 ChP2020
ChP2020“通则1108”在2015年版基础上,修改了直接口服和泡服中药饮片的微生物限度标准,增加了TAMC、TYMC计数和大肠埃希菌的规定,除TYMC计数要求为1×103 CFU/g外,其余与EP10.0的C类样品的微生物限度标准(见表3)相同。但ChP2020仍未对中药提取物的控制菌检查设立统一的限度标准。可见,ChP2020对中药饮片微生物限度的要求,无论是需要控制微生物的中药分类还是微生物限量标准,都不及其余3部药典完善。
4 讨论
2015版《中国药典》中已收载了部分中药饮片相关微生物的限度标准,在引导中药生产企业重视微生物污染、规范中药饮片加工过程等方面具有积极作用[15]。但我国中药饮片整体生产水平和技术条件还远不及发达国家,产品仍普遍存在微生物污染的现象,并可能存在條件致病菌[16-18]。虽然中药饮片在使用前大多需经煎煮等工艺处理,但在用药过程中仍存在潜在风险,其残留的致病微生物仍可能对患者造成危害[3-4,8,17-19]。目前,ChP2020虽已对“中药提取物及中药饮片的微生物限度标准”进行了修订,但相较于USP43、EP10.0和JP17,ChP2020在样品分类、检验项目和限度标准等方面的规定还有待进一步完善。
中药饮片是初级加工产物,也是一类特殊的药品,其检查方法的适用性是标准制定过程中的重要环节[14]。中药饮片微生物本底污染量高,对控制菌的检查有较大干扰,存在漏检风险[17]。不同检查方法的增菌和分离效果存在较大差异,以JP17中金黄色葡萄球菌检查为例,使用含7.5%氯化钠的TSB培养基增菌培养可有利于抑制样品中背景微生物的生长、提高目标菌检出率。USP43和JP17还增加了多种显色培养基的使用,也是有效区分目标菌的方法。此外,4部药典均允许使用微生物检验替代方法,如电化学方法、气体检查法、化学发光法等,而其中,基于分子生物学的检测技术已在医学检验、食品检验等领域体现出高灵敏度、高特异度和快速检验的优点,可以在中药饮片的微生物检查中发挥积极作用,提高饮片控制菌检出率[19-20]。
在限度标准上,USP43对中药的分类最为细致,对中药饮片产品的微生物限度标准要求也较为严格。虽然,USP43并未明确不可接受微生物的种类,但其要求生产企业需主动评估产品中可能存在的不可接受微生物,尤其应控制可能对产品造成不良影响、导致安全性危害的微生物[12]。这种风险评估和风险管理的理念值得我国借鉴和参考。
综上所述,本研究对4部药典的中药饮片微生物计数法、控制菌检查法和微生物相关限度标准进行了比较分析,根据我国中药饮片微生物污染和控制现状,有必要进一步完善药典对中药相关产品的微生物检验和限度标准,持续收集和整理基础性微生物负载数据,合理指导中药生产企业加强微生物污染控制和管理,最终保障中药产品的安全。建议根据我国中药饮片微生物污染和控制现状,逐步完善药典对中药相关产品的微生物检验方法和限度标准,合理细化相应产品的微生物限度水平。
参考文献
[ 1 ] CZECH E,KNEIFEL W,KOPP B. Microbiological status of commercially available medicinal herbal drugs-a scree- ning study[J]. Planta Medica,2001,67(3):263-269.
[ 2 ] ENAYATIFARD R,ASGARIRAD H,SANI BK. Microbial quality of some herbal solid dosage forms[J]. African J Biotechnol,2010,9(11):1701-1705.
[ 3 ] 范一灵,李琼琼,房蕊,等.上海地区10种中药饮片微生物污染情况研究[J].中草药,2015,46(13):1908-1913.
[ 4 ] 乐巍,丁安伟,邱蓉丽.中药材微生物侵染途径及控制方法研究概况[J].江苏中医药,2010,42(2):80-81.
[ 5 ] 严丹,袁星,解达帅,等.中药饮片灭菌的研究现状与思考[J].中草药,2016,47(8):1425-1429.
[ 6 ] 段金连,李月,张路梅,等.中药注射剂中药材的微生物污染[J].云南中医学院学报,2019,42(4):1-8.
[ 7 ] 国家药典委员会.中华人民共和国药典.四部[S]. 2015年版.北京:中国医药科技出版社,2015.
[ 8 ] 刘鹏,许华玉,特玉香,等.中药饮片微生物限度的考察与思考[J].中国中药杂志,2002,27(8):628-629.
[ 9 ] 贾谦.中药现代化国际化的反思[J].中国中医药信息杂志,2003,10(6):1-4.
[10] European Pharmacopoeia Commission. European Pharmacopoeia[S]. 10.0 edition. Strasbourg. European Directorate for Quality Medicines,2019:68-97.
[11] Pharmaceuticals and Medical Devices Agency of Japan.The Japanese Pharmacopoeia[S]. 17th edition. Tokyo:the Ministry of Health,Labor and Welfare,2016:138-147.
[12] U.S. Pharmacopeial Convention. USP 43-NF38[S/OL].(2019-10-04)[2020-06-29]. https://www.uspnf.com/notices/usp-nf-final-print-edition.
[13] 國家药典委员会.中华人民共和国药典.四部[S].2020年版. 北京:中国医药科技出版社,2020:171-177.
[14] 彭爱娜,黄江红,岳朝霞.探讨提升中药材,中药饮片检验质量的有效措施[J].内蒙古中医药,2016,35(11):108、117.
[15] 王阶,乔夕瑶,林飞,等.中药饮片发展现状及质量管理中存在的问题与分析[J].中国中药杂志,2014,39(22):4475-4478.
[16] 邓彦,王娅珂,韩晓宇,等.不同品种根类中药饮片耐胆盐革兰阴性菌污染研究[J].中国中药杂志,2017,42(21):4135-4141.
[17] 李琼琼,范一灵,宋明辉,等.基于高通量测序的6类中药饮片污染微生物群落特征分析[J].药物分析杂志,2019,39(11):1945-1953.
[18] 刘鹏,战宏利,严倩倩,等.中成药口服给药制剂及其原料药微生物污染相关性分析[J].药物分析杂志,2014,34(6):1068-1072.
[19] 绳金房,杨晓莉,李辉.陕西省12种中药饮片微生物污染调查及风险评估[J].西北药学杂志,2016,31(6):608- 612.
[20] 甘永琦,农浚,零文超,等.广西等地区9种中药饮片微生物污染状况分析[J].中国药师,2018,21(5):170-175.
(收稿日期:2020-06-29 修回日期:2020-10-15)
(编辑:罗 瑞)
