阿帕替尼联合多西紫杉醇对卵巢癌干细胞的影响及其作用机制
2020-12-28甘蕾黄雅可黄燕谢荣凯
甘蕾,黄雅可,黄燕,谢荣凯
(陆军军医大学第二附属医院妇产科,重庆 400037)
卵巢癌作为目前致死率较高的女性生殖系统恶性肿瘤,具有起病隐匿、进展快速等特点。目前,提高卵巢癌患者生存率的方式仍以尽早发现、尽早手术切除并辅以化疗为主[1]。但相关研究显示,化疗药物可导致难以耐受的不良反应及化疗过程中产生的耐药性,疾病治愈率较低、复发率较高,严重影响患者预后[2-3]。阿帕替尼是抗肿瘤血管生成的靶向治疗药物,多西紫杉醇是新一代紫杉类化合物抗肿瘤药物,两者目前已被用于乳腺癌、肺癌、胃癌等多种恶性肿瘤的临床治疗,效果良好[4-6],部分学者将其应用于卵巢癌的治疗,并取得了一定的临床疗效[7-8],但具体作用机制尚不明确。近年来,随着卵巢癌发生、发展研究的不断深入,部分学者发现,占卵巢癌发病率80%~90%的上皮来源卵巢癌是一种干细胞相关性肿瘤,其中分离中的卵巢癌干细胞与卵巢癌的发生、发展、复发、耐药等密切相关[9-11]。而对卵巢癌干细胞的生物学特性、相关信号通路、靶向定位等的深入研究为此类患者的临床治疗提供了更多有价值的理论依据[12-13]。本研究主要分析阿帕替尼联合多西紫杉醇对卵巢癌干细胞的影响及其作用机制,以期为卵巢癌的临床治疗提供理论依据。
1 材料与方法
1.1实验材料 人卵巢浆液性乳头状腺癌细胞(SKOV3)株由陆军军医大学附属新桥医院中心实验室提供;阿帕替尼(江苏恒瑞医药股份有限公司生产,批号:180102KC,二甲基亚砜溶解后使用)、多西紫杉醇(江苏恒瑞医药股份有限公司生产,批号:180406AF,二甲基亚砜溶解后使用);重组人碱性成纤维细胞生长因子(美国Pepro Tech公司生产,批号:AF-100-18B)、重组人表皮生长因子(美国Pepro Tech公司生产,批号:AF-100-15);达尔伯克改良伊格尔培养基(Dulbecco′s modified Eagle′s medium,DMEM)/F12培养基(美国Hyclone公司生产,批号:SH300023);胎牛血清(批号:11011-6123)、胰蛋白酶、磷酸盐缓冲液(phosphate buffered saline,PBS)、 Cell Counting Kit-8(CCK-8)试剂盒、RIPA蛋白裂解液(美国Gibco公司生产);兔Oct-4单抗、兔CD133单抗、兔Nanog单抗、兔上皮钙黏素(E-cadhefin)单抗、兔波形蛋白(Vimentin)单抗、兔扭曲蛋白(Twist)单抗、兔甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单抗(英国Abcam公司生产);流式凋亡检测试剂盒、Trizol试剂、反转录试剂盒、实时定量逆转录聚合酶链反应(real time quantitative reverse transcription polymerase chain reaction,qRT-PCR)试剂盒(日本TaKaRa公司生产);引物设计及合成由生工生物工程(上海)股份有限公司完成;CO2恒温细胞培养箱(上海新苗医疗器械制造有限公司);4 ℃低温高速离心机(德国Beckman公司);酶标仪、流式细胞仪(美国Molecular Devices公司)。
1.2细胞培养
1.2.1SKOV3细胞的复苏与传代 ①用紫外线照射超净工作台台面30 min 后,迅速取出液氮中的人卵巢癌SKOV3细胞冻存管,并置于37 ℃恒温水浴箱中快速解冻;②待其完全融解后用移液器吹打细胞液使细胞分散,并将细胞液置于含10%胎牛血清的DMEM/F12培养基内混匀,放在37 ℃、含5% CO2的培养箱中培养;③待细胞贴壁生长良好、融合度达80%左右时,去除培养液,加入0.25%胰蛋白酶润洗,再次加入适量胰蛋白酶,待光学显微镜下观察细胞折光性增强且出现明显细胞间隙时吸去胰蛋白酶,加入10%胎牛血清终止胰蛋白酶消化;④吸管吹打液体至细胞形成悬液后,以离心半径10 cm,1 000 r/min离心5 min,弃上清,PBS洗涤2次,将细胞重悬于含10%胎牛血清的DMEM/F12培养基内混匀;⑤计数板计数后,以2×105个/mL的细胞密度分别接种于新的培养皿中,置于37 ℃、含5% CO2的培养箱中继续培养,隔天更换1次培养基,行传代培养。
1.2.2卵巢癌干细胞样细胞的培养及传代 ①取对数生长期SKOV3细胞,更换新鲜培养液1 d后,按1.2.1所述方式进行细胞消化制备细胞悬液,以离心半径10 cm,1 000 r/min离心5 min,弃上清,PBS洗涤2次,将细胞悬于无血清培养基(DMEM/F12培养基+重组人表皮生长因子20 ng/mL+重组人碱性成纤维细胞生长因子10 ng/mL+胰岛素5 μg/mL配置而成)中;②计数板计数后,以2×105个/mL的细胞密度分别接种于新的培养皿中,置于37 ℃、含5% CO2的培养箱中继续培养,隔天补充0.25 mL无血清培养基;③7~10 d后收集悬浮球细胞,以离心半径10 cm,800 r/min离心2 min,弃上清,机械吹打,PBS洗涤1次,将细胞悬液重悬于无血清培养基中;④计数板计数后,以2×105个/mL的细胞密度分别接种于新的培养皿中,置于37 ℃、含5% CO2的培养箱中继续培养,隔天补充0.25 mL无血清培养基;⑤6~8 d后,进行1∶2传代扩增培养;⑥培养7 d后取干细胞样细胞,PBS洗涤2次后,在含10%胎牛血清的培养基中培养至细胞融合度达80%左右时进行消化(同1.2.1),并重新接种于无血清培养基中。
1.3卵巢癌干细胞的鉴定 qRT-PCR法检测卵巢癌干细胞相关标志基因Oct-4、CD133及Nanog的表达。具体步骤如下:①取SKOV3贴壁细胞及传代培养至第7代的SKOV3干细胞样细胞,以离心半径10 cm,1 000 r/min离心5 min,弃上清,PBS洗涤1次,加入Trizol,移液枪吹打至细胞全部裂解后静置5 min,加入Trizol及氯仿作用5 min;② 4 ℃、离心半径10 cm、12 000 r/min离心15 min,取上层信使RNA(messenger RNA,mRNA),加入Trizol及异丙醇静置10 min;③ 4 ℃、离心半径10 cm、12 000 r/min离心10 min,弃上清,加入75%乙醇洗涤;④ 4 ℃、离心半径10 cm、9 000 r/min离心10 min,弃上清,吹干;⑤加焦碳酸二乙酯水溶解、重悬后,60 ℃作用10 min;⑥取少量mRNA,检测其在260 nm及280 nm波长的光密度(optical density,OD)值,若A260/A280值为1.8~2.0视为mRNA提取合格;⑦按照qRT-PCR试剂盒说明书反转录合成互补DNA,内参采用GAPDH,结果使用公式F=2-ΔΔCt转换。Oct-4引物序列为F:GGCCCGAAAGAGAAAGCGAACC,R:ACCCAGCAG-CCTCAAAATCCTCTC;CD133引物序列为F:TGGA-TGCAGAACTTGACAACGT,R:ATACCTGCTACGACAGTCGTGGT;Nanog引物序列为F:TTCCTTCCTCCATGGATCTC,R:TCTGCTGGAGGCTGAGGTAT;GAPDH引物序列为F:CGGAGTCAACGGATTTGGTCGTAT,R:AGCCTTCTCCATGGTGGTGAAGAC,实验重复3次,取平均值。
1.4四甲基偶氮唑盐比色法检测细胞增殖 将第7代SKOV3干细胞样细胞经胰蛋白酶消化重新形成单细胞悬液后分为对照组、5 μg/mL组、10 μg/mL组、20 μg/mL组、40 μg/mL组、80 μg/mL组,将细胞浓度为6×104个/mL的干细胞分别接种于96孔板中(每组设定5个复孔)培养24 h;对照组仅加入无血清培养基,其他各组分别加入相应浓度的阿帕替尼后置于培养箱中继续培养48 h;培养后,每孔加20 μL MTT孵育4 h,弃培养基后每孔加150 μL二甲基亚砜。最后用酶标仪测定OD值(450 nm),计算细胞增殖抑制率及半数抑制浓度(IC50,经计算为58.98 μg/mL,后续实验药物浓度取整数值60 μg/mL),增殖抑制率(%)=(1-药物作用组OD值/对照组OD值)×100%。
1.5流式细胞术检测细胞凋亡情况 将第7代SKOV3干细胞样细胞经胰蛋白酶消化重新形成单细胞悬液后分为对照组、阿帕替尼组、多西紫杉醇组与联合组,将细胞浓度为5×105个/mL的干细胞分别接种于96孔板中(每组设定5个复孔),对照组仅加入无血清培养基,阿帕替尼组加入无血清培养基和阿帕替尼(60 μg/mL),多西紫杉醇组加入无血清培养基和多西紫杉醇(60 μg/mL),联合组加入无血清培养基、阿帕替尼(60 μg/mL)和多西紫杉醇(60 μg/mL),作用48 h后,以离心半径10 cm、2 000 r/min离心5 min,胰蛋白酶消化后,以2 000 r/min、离心半径10 cm离心5 min,弃上清,PBS洗涤2次,以离心半径10 cm、2 000 r/min离心5 min,弃上清。按照流式磷脂结合蛋白V-荧光基团异硫氰酸荧光素/碘化丙啶双染细胞凋亡检测试剂盒说明书检测,Flowjo软件分析处理。
1.6Transwell细胞迁移实验检测细胞侵袭迁移情况 4组干细胞同1.5所述方式加入培养基及药物作用48 h后,每个Transwell小室的上室加入200 μL各组细胞悬液(细胞浓度均为25×104个/mL),下室加入600 μL含10%胎牛血清的DMEM/F12培养基(侵袭实验还需预先在小室内铺Matrigel基质胶);将Transwell小室放入24孔板中,置入37 ℃、含5% CO2的培养箱中培养,其中迁移实验培养16 h,侵袭实验培养48 h;取出Transwell,PBS洗涤3次,4%多聚甲醛固定10 min,0.1%结晶紫染色20 min,用棉签轻轻擦去内层未迁移细胞,将小室倒置于载玻片上,于正置显微镜下随机选取4个视野计算穿膜细胞数(每组设定5个复孔,观察4个视野,即20个复孔的情况)。
1.7qRT-PCR法检测E-cadhefin、Vimentin及Twist mRNA的表达水平 4组干细胞按1.5所述方式加入培养基及药物作用48 h后,Trizol法提取总RNA、反转录合成互补DNA、检测E-cadhefin、Vimentin及Twist mRNA表达水平(方法同1.3)。E-cadhefin引物序列为F:CTGGACGCTCGGGCCTGAAGT,R:GGGTCAGTATCAGCCGCTTT;Vimentin引物序列为F:ACAGGCTTTAGCGAGTTATT,R:GGGCTCCTAGCGGTTTAG;Twist引物序列为F:TGTCCGCGTCCCACTAGC,R:TG-TCCATTTTCTCCTTCTCTGGA。
1.8Western blotting法检测E-cadhefin、Vimentin及Twist蛋白的表达水平 4组干细胞同1.5所述方式加入培养基及药物作用48 h后,加入细胞裂解液冰浴15 min,以离心半径10 cm、12 000 r/min离心15 min后,提取总蛋白,并采用BCA法测定总蛋白浓度。取蛋白上样行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳、硝酸纤维素膜转膜,5%脱脂奶粉封闭后,分别加入GAPDH、E-cadherin、Vimentin、Twist一抗4 ℃孵育过夜;PBS洗涤3次,加入二抗,室温孵育60 min;PBS洗涤3次,电化学发光显影;最后用Image J图像分析软件检测蛋白条带灰度值。

2 结 果
2.1卵巢癌干细胞的鉴定 SKOV3干细胞相关标志基因Oct-4、CD133及Nanog的表达水平显著高于卵巢癌SKOV3贴壁细胞(P<0.05),见表1。

表1 SKOV3干细胞与SKOV3贴壁细胞Oct-4、CD133及Nanog mRNA表达水平比较
2.2不同浓度阿帕替尼对卵巢癌干细胞的增殖抑制率比较 阿帕替尼浓度处于5~80 μg/mL时,随着阿帕替尼浓度的增加,卵巢癌干细胞增殖抑制率明显增高(P<0.01),见表2,IC50值为58.98 μg/mL。
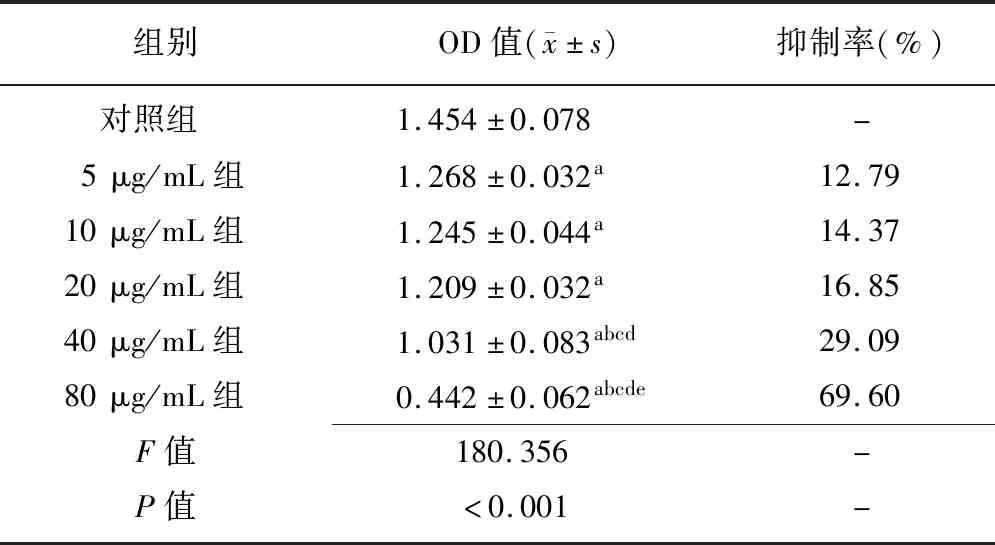
表2 不同浓度阿帕替尼对卵巢癌干细胞的增殖抑制率比较 (n=5)
2.3阿帕替尼及多西紫杉醇对卵巢癌干细胞凋亡的影响 对照组、阿帕替尼组、多西紫杉醇组、联合组流式细胞术检测的卵巢癌干细胞凋亡率分别为(5.58±1.55)%、(21.97±2.21)%、(21.70±2.26)%、(59.56±3.68)%,各组比较差异有统计学意义(F=404.100,P<0.001),与对照组比较,阿帕替尼组、多西紫杉醇组及联合组卵巢癌干细胞凋亡率均明显升高(P<0.05),其中联合组的卵巢癌干细胞凋亡率最高,见图1。
2.4阿帕替尼及多西紫杉醇对卵巢癌干细胞侵袭、迁移的影响 4组卵巢癌干细胞穿膜细胞数比较差异有统计学意义(P<0.01),与对照组比较,阿帕替尼组、多西紫杉醇组及联合组卵巢癌干细胞穿膜细胞数均明显减少(P<0.05),且联合组卵巢癌干细胞穿膜细胞数少于阿帕替尼组和多西紫杉醇组(P<0.05),见表3。
2.5阿帕替尼及多西紫杉醇对卵巢癌干细胞E-cadhefin、Vimentin及Twist mRNA表达的影响 各组卵巢癌干细胞E-cadhefin、Vimentin及Twist mRNA表达水平比较差异有统计学意义(P<0.01),与对照组比较,阿帕替尼组、多西紫杉醇组及联合组卵巢癌干细胞E-cadhefin mRNA表达水平均显著升高,联合组高于阿帕替尼组、多西紫杉醇组(P<0.05);与对照组比较,阿帕替尼组、多西紫杉醇组及联合组卵巢癌干细胞Vimentin及Twist mRNA表达水平均显著降低(P<0.05),联合组低于阿帕替尼组、多西紫杉醇组(P<0.05)。见表4。
2.6阿帕替尼及多西紫杉醇对卵巢癌干细胞E-cadhefin、Vimentin及Twist蛋白表达的影响 各组卵巢癌干细胞E-cadhefin、Vimentin及Twist蛋白表达水平比较差异有统计学意义(P<0.01),与对照组比较,阿帕替尼组、多西紫杉醇组及联合组卵巢癌干细胞E-cadhefin蛋白表达水平均显著升高,联合组高于阿帕替尼组、多西紫杉醇组(P<0.05);与对照组比较,阿帕替尼组、多西紫杉醇组及联合组Vimention和Twist蛋白水平均降低,联合组低于阿帕替尼组、多西紫杉醇组(P<0.05),见表5、图2。
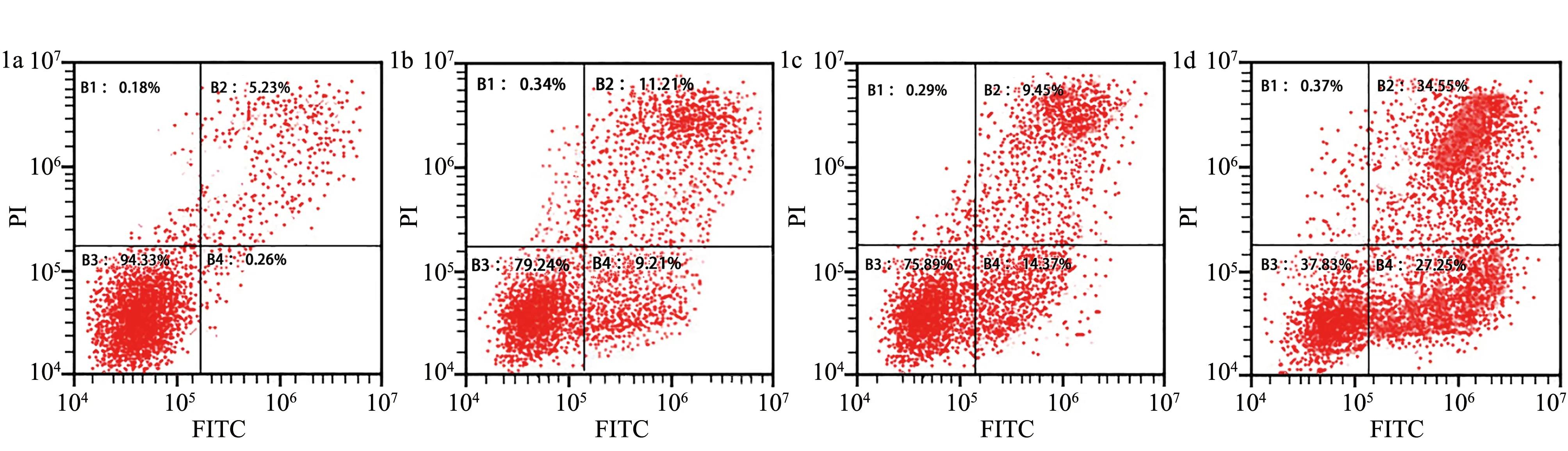
FITC:异硫氰酸荧光素;PI:碘化丙啶;对照组:仅加入无血清培养基;联合组:加入无血清培养基、阿帕替尼、多西紫杉醇图1 对照组(1a)、阿帕替尼组(1b)、多西紫杉醇组(1c)、联合组(1d)卵巢癌干细胞凋亡率流式细胞图

表3 各组卵巢癌干细胞穿膜细胞数比较 (n=20,个,
表4 各组卵巢癌干细胞E-cadhefin、Vimentin及Twist mRNA表达水平比较
表5 各组卵巢癌干细胞E-cadhefin、Vimentin及Twist蛋白表达水平比较
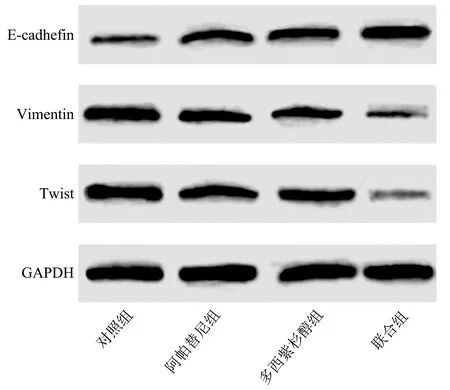
E-cadhefin:上皮钙黏素;Vimentin:波形蛋白;Twist:扭曲蛋白;GAPDH:甘油醛-3-磷酸脱氢酶图2 各组卵巢癌干细胞E-cadhefin、Vimentin及Twist蛋白表达条带图
3 讨 论
卵巢癌作为女性生殖系统致死率较高的恶性肿瘤,由于发病隐匿且缺乏有效的早期筛查手段,严重威胁着女性的生命健康。阿帕替尼作为一种特异性靶向血管内皮生长因子受体2的小分子血管生成抑制剂,能够高选择性地结合血管内皮生长因子受体2胞内酪氨酸ATP结合位点,阻断其下游信号转导通路,抑制肿瘤血管内皮细胞的增殖,阻止肿瘤血管生成,从而抑制肿瘤生长[14]。多西紫杉醇是新一代紫杉类抗肿瘤药物,可通过加强微管蛋白聚合、抑制微管解聚破坏肿瘤细胞的有丝分裂,将肿瘤细胞阻滞在G2/M期,从而抑制肿瘤生长[15],两者对卵巢癌的治疗均有一定的作用,但具体作用机制尚不完全明确。
卵巢癌干细胞作为肿瘤侵袭、转移、复发的根源,对卵巢癌高致死率、高复发率、高耐药性等的研究具有重要意义。作为全能性或多能性干细胞标志物,Oct4在保持胚胎干细胞自我更新及全能性方面具有重要作用[16];CD133为多种组织肿瘤干细胞表面独立表达的特异性标记分子,可通过其表达水平分选干细胞、前体细胞和肿瘤干细胞[17];Nanog是公认的肿瘤干细胞标志性基因,去除或使该基因失活能够抑制肿瘤细胞增殖和侵袭[16]。本研究中,通过分离获取的卵巢癌干细胞的Oct-4、CD133及Nanog mRNA的表达水平均明显高于卵巢癌SKOV3贴壁细胞,可见获取的卵巢癌干细胞质量较佳,为后续的增殖、凋亡、侵袭迁移等实验提供了基础。经增殖、凋亡、侵袭迁移等实验研究发现,阿帕替尼为5~80 μg/mL时,随着阿帕替尼浓度的增加,其对卵巢癌干细胞增殖的抑制作用明显增强;与单纯用药相比,阿帕替尼与多西紫杉醇联合应用可显著促进卵巢癌干细胞的凋亡,抑制卵巢癌干细胞的侵袭及迁移。由此推测,增加卵巢癌干细胞的凋亡率可能是两药联合应用协同抗癌的主要原因之一。
E-cadhefin作为一种钙离子依赖的细胞黏附分子,不仅可参与细胞形态的维持,还可介导细胞间的同源性黏附,其表达水平下调会降低同源细胞间的黏附力,有利于肿瘤细胞脱离原发部位向细胞外基质扩散[18-19]。Vimentin作为一种细胞骨架蛋白,可与胞质中的整合素和膜型基质金属蛋白酶-1结合,下调细胞表面黏附分子的表达,为肿瘤细胞的远处转移提供有利条件[20-21]。Twist作为一种常染色体的碱性螺旋-环-螺旋转录因子,能够抑制E-cadhefin mRNA的转录,从而改变细胞形态,降低细胞黏附性,并能诱导细胞发生上皮-间充质转化,增加肿瘤细胞的迁移及侵袭能力[22-23]。E-cadhefin、Vimentin、Twist均为上皮-间充质转化的重要标志物,上皮-间充质转化是上皮细胞恶性转变的重要过程,即极性上皮细胞在部分因素作用下转变成为运动能力较强的间叶性表皮细胞是上皮细胞恶性转变的部分机制[24]。本研究结果显示,阿帕替尼与多西紫杉醇联合应用组细胞内E-cadhefin的表达水平明显升高,而Vimentin及Twist的表达水平明显降低,推测E-cadhefin水平上调、Vimentin及Twist水平下调可能是阿帕替尼与多西紫杉醇联合应用抑制卵巢癌干细胞侵袭及迁移的部分分子生物学作用机制,即阿帕替尼与多西紫杉醇联合应用可能干预卵巢癌干细胞的上皮-间充质转化过程,进而抑制卵巢癌干细胞的侵袭及迁移,但其机制仍需进一步深入研究。
综上所述,阿帕替尼联合多西紫杉醇可显著抑制卵巢癌干细胞的增殖、侵袭及迁移,并能促进卵巢癌干细胞的凋亡。
