二术解毒汤对大鼠肝癌前病变的预防作用*
2020-12-26陈天阳
陈天阳 成 扬,2△
1.上海中医药大学附属曙光医院肝病研究所 (上海, 201203) 2.上海浦东新区传染病医院肝病科
癌前病变是一种成熟的组织病理学癌前组织,具有最高的肿瘤发生风险,优先从DNA损伤检查点的激活和持续的炎症中发展而来[1]。在过去几年中,在多种肿瘤中观察到癌前病变,包括但不限于结、直肠癌,乳腺癌,胃癌,肝癌[2-5]。肝癌前病变目前被认为是由肝硬化引起的结节性病变,是肝癌发生演变过程中的中间阶段,现已成为肝癌防治学研究的重点[6]。
目前针对肝癌前病变仍缺乏理想的治疗药物和手段,而中医药在该领域具有独特的优势。上海市名中医陈建杰教授根据中医学“未病先防、既病防变、治病求本”的学术思想,确立了“健脾化湿、清热解毒、软坚散结”为主要治法的二术解毒汤,在临床对于乙型肝炎肝硬化伴高甲胎蛋白血症患者有良好的疗效[7,8]。本研究拟采用二乙基亚硝胺(DEN)建立大鼠肝癌前病变模型,观察二术解毒汤对大鼠肝癌前病变的抑制作用,为进一步开发防治肝癌前病变的有效中药协定方提供依据。
1 材料与方法
1.1 实验动物 62只雄性Wistar大鼠,体质量为(180±10)g,购于必凯实验动物有限公司,生产许可证号:SCXK(沪)2013-0016。饲养于上海中医药大学实验动物中心SPF级实验室,每笼5只,适应性饲养7 d后进行实验。
1.2 药物及试剂 二术解毒汤颗粒剂(含丹参、苍术各12 g,炒白术、半枝莲、白花蛇舌草各9 g,炙鳖甲6 g)委托江阴天江药业有限公司生产,产品批号:1810332;华蟾素胶囊(陕西东泰制药有限公司)规格0.25 g×18粒/盒,产品批号:8F04;DEN,美国Sigma公司;ALT、AST、GGT试剂盒,南京建成生物公司;DAB发色液,Cell Signaling Technology公司;苏木精复染液,生工生物工程上海股份有限公司。
1.3 动物分组、造模及干预 62只雄性Wistar大鼠适应性饲养7 d后,按体质量随机分为6组:正常组8只,模型组14只,华蟾素组及二术解毒汤颗粒剂低、中、高剂量组(简称低、中、高剂量组)各10只。除正常组大鼠外,其余5组大鼠以DEN腹腔注射50 mg/kg,2次/周,连续4周,从第5~14周起1次/周,14周末造模结束[9]。正常组大鼠腹腔注射等量生理盐水,14周末结束。造模同时低、中、高剂量组大鼠以0.525 g/kg、1.05 g/kg、2.1 g/kg剂量的二术解毒汤颗粒剂灌胃,1次/d;华蟾素组大鼠以0.15 g/kg剂量华蟾素灌胃,1次/d;正常组及模型组大鼠以生理盐水灌胃,1次/d。灌胃体积均为5 ml/kg,至16周末结束。
1.4 标本采集 第16周末灌胃给药后,禁食12 h,称重后用3%戊巴比妥钠腹腔注射麻醉,腹主动脉采血并处死。检测肝功能指标;观察各组大鼠肝脏大体情况,并且切取同一位置的肝组织置于10%福尔马林溶液中固定,进行HE染色及免疫组化染色,观察肝脏病理学改变。免疫组化结果的判读:每个标本随机取5个高倍镜视野(×400)基于阳性染色细胞的百分比和染色强度进行评分。阳性染色细胞的百分比:0%~5%得0分,6%~35%得1分,36%~70%得2分,70%以上得3分;染色强度:未染色0分,弱染色1分,中度染色2分,强染色3分。使用两者相乘得分计算最终评分。评分等级:0~1分评为“-”,2~3分评为“+”,4分~6分评为“++”,> 6分评为“+++”。评分≥4分为阳性,判读过程由两位病理科医生独立进行。
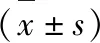
2 结果
2.1 各组大鼠一般情况 实验过程中,正常组大鼠精神状况较好,正常进食、水,活动自如,体质量逐渐增长,无死亡情况。模型组、华蟾素组以及低、中、高剂量组大鼠从第4周开始出现进食较正常组大鼠明显减少,背毛倒竖,活动迟缓,精神萎靡,体质量增长缓慢或者逐渐下降等现象。但华蟾素组、低、中、高剂量组大鼠表现程度均好于模型组。
2.2 各组大鼠体重变化情况 见表1。
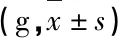
表1 各组大鼠体质量情况比较
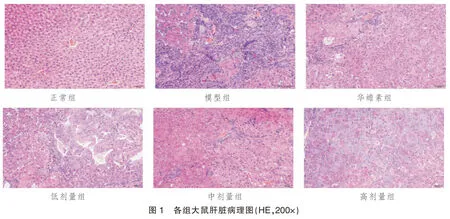
2.3 各组大鼠肝脏病理变化 见插页彩图1。正常组大鼠的肝脏组织质地柔软,表面光滑,颜色呈鲜红色。模型组大鼠的肝脏组织表面无光泽、粗糙、质地硬,色为暗红色,肝脏表面单发或满布大小不等的灰白色肿瘤结节,其直径大小不等(0.5~1.5 cm),或伴有不同程度的肝硬化,但未见腹水。华蟾素组及低、中、高剂量组大鼠的肝脏组织表面光泽较暗、质地硬,颜色呈暗红色,肝脏表面结节较少、较小。
肝组织HE染色:镜下见正常组大鼠肝小叶结构清晰,细胞大小一致,排列整齐呈条索状排列在中央静脉周围,核仁明显,核膜清楚,无炎症细胞浸润。模型组大鼠肝细胞出现不同程度变性、坏死,排列紊乱呈灶状、巢状、梁状,细胞呈多形性,胞核大,呈双核或多核,染色较深,密度增加,核质比增加,肝细胞明显发育不良,并伴有纤维组织増生,假小叶形成。中剂量组大鼠肝细胞变性坏死程度较模型组轻,细胞排列紊乱呈巢状,结缔组织增生程度也较轻。华蟾素组及低、高剂量组大鼠肝细胞变性,坏死程度及结缔组织增生情况介于模型组与中剂量组之间。
2.4 各组大鼠肝功能检测结果 见表2。
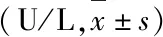
表2 各组大鼠肝功能结果比较
2.5 各组大鼠肝组织中GST-Pi及Ki67的表达情况 见表3。
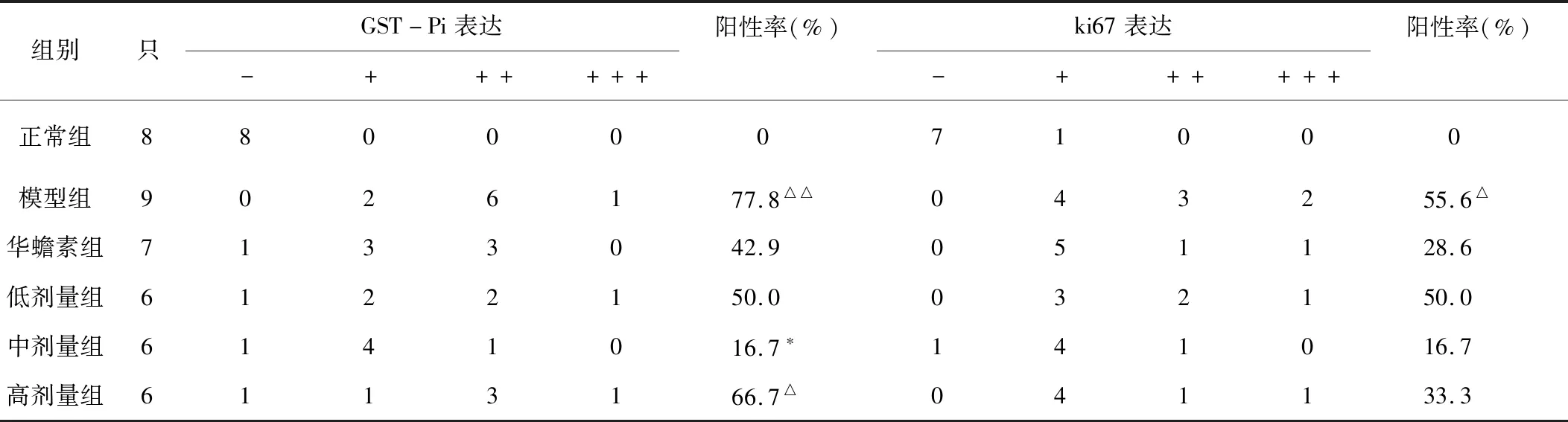
表3 各组大鼠肝组织GST-Pi、ki67表达比较 (只)
3 讨论
肝癌前病变根据细胞学和组织学变化将它们分为两个水平:显微镜下发育不良病灶(DF)和肉眼可见的发育不良结节(DN)[10]。DF是任意直径<1 mm的微观病变,其进一步分类为表现出大细胞变化(LCC)或小细胞变化(SCC),SCC形态学上与分化良好的HCC相似,组织学为HCC的连续体,故SCC为肝癌前病变的体现[11]。DN是病变直径主要为1~1.5 cm的结节性病变,根据细胞学与结构异型性进一步细分为低级别发育不良结节(LGDNs)和高级别发育不良结节(HGDNs),HGDNs被定义为恶性转化和肿瘤形成的最强独立预测因子,属于边缘恶性肿瘤类别[1,10]。根据报道,60%~80%的HGDNs可以在5年内发展为HCC[12],故HGDNs是发展为HCC的癌前病变。现在大多数学者认为肝癌的发生、发展是一个多阶段、多步骤、多因素参与的过程,即肝炎→肝硬化→不典型增生→早期肝癌→进展期肝癌,是一种目前研究肿瘤发生比较理想的模型[13]。同样在病理学上,HCC以如下序列以多步方式发展: LGDN→HGDN→早期HCC→分化良好的HCC→结节蛋白→结节HCC→中度分化的HCC[14],所以认为肝癌前病变阶段是肝硬化发展为肝癌的中间阶段,如能提前干预或阻止肝癌前病变的发生、发展,则可降低肝癌发生率。
肝癌前病变在中医学中没有特异性的病名与之对应,但是根据其病因病机及临床表现可归属于“胁痛”、“肝着”、“肝积”、“积聚”等范畴。它们的病名虽然不同,但却有着共同的病因病机。其病机多为正虚邪恋、本虚标实。而正气亏虚是肝癌形成的基础,热毒的产生是肝癌形成的关键,气滞、血瘀、痰浊是肝癌形成的必要条件。若外感湿热疫毒之邪羁留不去,邪凝毒结;内伤饮食劳倦,而致脾胃损伤,运化失调,痰湿停滞;情志不遂,肝气不疏,气机失调,脉络受阻,血行不畅;久病耗气耗血,瘀血阻滞,湿热残留。发病之初,邪气壅实,正气未虚,病机性质多属实;随着邪气入侵,损伤人体正气,表现为虚实夹杂之证;疾病后期,气血耗损严重,体质渐虚,转为正虚为主。故本病的病机为热毒、痰湿、气滞、血瘀互结与肝脏,损伤正气,导致肝癌前病变的发生。二术解毒汤由苍术、白术、半枝莲、白花蛇舌草、丹参、炙鳖甲组成。苍术燥湿健脾,白术健脾益气,二术同用可健脾理气,运脾化湿,调养后天之本,使气血生化有源,益气固本,扶正祛邪,则积者自除;半枝莲清热解毒,活血化瘀,白花蛇舌草清热解毒,消痈散结,二者同用加强清热解毒之效;丹参活血祛瘀,通经止痛,炙鳖甲滋肾潜阳,软坚散结,二者增强活血化瘀,软坚散结之功;诸药相合,共奏健脾解毒、活血消积之功。
实验过程中我们发现二术解毒汤颗粒可改善肝癌前病变大鼠精神状态、活动、进食、毛色及体重等情况。在肝癌患者中,AST/ALT比率通常> 1,且GGT水平通常高于AST和ALT水平[15-17]。而本研究结果提示二术解毒汤对肝癌前病变的抑制有明显效果。
谷胱甘肽S-转移酶(GSTs)是催化谷胱甘肽(GSH)与多种疏水和亲电子化合物结合的酶,在正常肝细胞中几乎检测不到,而在化学诱导的肿瘤前大鼠肝细胞结节和大鼠原发性肝细胞瘤中以高浓度表达,故GST-P阳性病灶可被认为是肝癌发生的可靠和敏感的标志物[18,19]。Ki67是一种仅在细胞分裂期间在细胞核中表达的蛋白质,其标记指数与肿瘤生长速率,组织学分期和HCC肿瘤复发相关,所以是肿瘤预后和预测标志物[20-22]。二术解毒汤颗粒剂抑制大鼠肝癌前病变形成和发展,其作用机制可能与其抑制GST-Pi及Ki67的阳性表达密切相关。但其具体机制仍需进一步研究。随着研究的深入,肝癌前病变的机制将会更加明确,为肝癌防治打下坚实的基础。
