四逆软肝方对人肝星状细胞株LX-2增殖、凋亡和活化的影响*
2020-12-26刘近明赵国荣艾碧琛何宜荣邹俊驹肖碧跃尹周安毛娅男
刘近明 赵国荣 艾碧琛 何宜荣 梅 明 邹俊驹 肖碧跃 尹周安 毛娅男
湖南中医药大学中医学院(湖南 长沙, 410208)
肝纤维化是各种慢性肝病导致肝硬化的共同病理基础和必经之路,是对慢性损伤的修复反应[1,2]。肝纤维化以细胞外基质的大量产生并异常沉积为主要特征。肝星状细胞(HSC)在肝纤维化过程中起着关键的作用[3],HSC的激活和增殖导致合成和分泌大量的胶原等细胞外基质,使其合成和降解失衡,并在肝脏内异常沉积,导致肝纤维化[4,5]。因此,抑制HSC的增殖及诱导凋亡已成为近年来国内外研究、治疗肝纤维化的重点课题。本研究在明确四逆软肝方对肝纤维化有治疗作用的基础上[6,7],通过体外细胞实验观察四逆软肝方对HSC增殖、凋亡和活化的影响,探讨其抗肝纤维化的机制及作用。
1 材料与方法
1.1 细胞的培养 人肝星状细胞LX-2株(以下简称“LX-2细胞”)来源于上海生博生物医药科技有限公司。用含10%胎牛血清的1640培养基(以下简称“正常培养液”)(美国Gibco公司,批号:8118016)培养,放置37℃(含5%CO2)恒温培养箱(NATURE公司,美国),细胞贴壁长满单层后,用0.25%胰酶(美国Hy Clone公司,批号为1881862、8117302)消化、传代,选对数生长期细胞供试验用。
1.2 实验药物的制备 四逆软肝方(由茵陈、田基黄、川贝、桃仁、牡丹皮、煅牡蛎、西洋参、白芍、白术、茯苓等药物组成)由湖南中医药大学三湘门诊部提供。四逆软肝方加纯化水适量冲洗3次,煎煮前先浸泡30 min,先武火煎开,后文火煎煮30 min,共煎煮两遍,合并两次煎煮的药液,双层滤纸抽滤,后于旋转蒸发仪中浓缩至1 g/ml(每毫升药液含生药1 g),高压灭菌锅中121℃灭菌30 min,分装药液并用0.22 μm微孔滤膜过滤后4℃或-20℃保存备用。以上药物浓度为1 g/ml(每毫升药液含生药1 g),用10倍稀释法分别稀释成多个浓度,以此进行药物浓度的筛选和后续试验的开展。
1.3 细胞分组及药物处理 将细胞随机分为四逆软肝方组和正常对照组;四逆软肝方组用其相对应浓度的药物水提物培养,正常对照组用正常培养液培养。
1.4 细胞增殖和毒性试验 在96孔培养板中按照5×103个/ml的细胞浓度进行铺板,每孔100 μl。培养隔夜待细胞贴壁后,分别用正常培养液或含0.1、1、1.25、2.5、10和100 mg/ml的四逆软肝方水提物培养液培养。48 h后,吸走细胞上清,按照10∶1的比例在正常培养基中加入CCK-8标记剂,按照每孔110 μl加至孔板中,培养箱培养1 h。用全自动酶标仪在450 nm处测量OD值,并计算出细胞存活率,存活率=(观察组OD值-空白组OD值)/(正常组OD值-空白组OD值)×100%。同样,采用0.1、1、10和100 mg/ml的多剂量四逆软肝方处理LX-2细胞48 h后,取细胞培养上清测定LDH(乳酸脱氢酶)的OD值,并通过标准曲线计算出各组LDH释放量。
1.5 细胞凋亡分析 分别用正常培养液和1、2和4 mg/ml四逆软肝方水提物培养液处理细胞48 h后,采用Annexin V-FITC/PI双染法(LiankeBio,中国)检测LX-2细胞凋亡。离心收集1×105个/ml细胞,用双蒸水稀释5×Binding buffer(结合缓冲液)为1×工作液,取500 μl 1×Binding buffer(结合缓冲液)重悬细胞。每管加入5 μl Annexin V-FITC和10 μl PI。混匀后室温避光孵育15 min。FITC或PI荧光强度用全自动细胞计数仪(Nexcelom Cellometer,美国)进行检测分析并导出数据。
1.6 免疫荧光染色 用24孔板进行细胞培养,待细胞贴壁生长后,吸出原培养液,PBS洗涤3次。分别用正常培养液和1、2和4 mg/ml四逆软肝方水提物培养液处理细胞48 h,再吸走培养液,PBS洗涤3次,每次5 min。室温下用4%多聚甲醛固定20 min。重复PBS洗涤步骤,在室温下用细胞渗透液(0.5%Triton X-100,PBS稀释,每孔400 μl)透膜15 min。吸走渗透液,重复洗涤步骤,室温下用封闭液(5%牛血清白蛋白,PBS稀释)封闭孵育30 min。重复洗涤步骤,用相应的初级抗体(PBS稀释,每孔50 μl)在4oC孵育过夜。重复洗涤步骤,加入二级抗体(Goat anti-rabbit IgG,PBS稀释,每孔50 μl,按1∶200稀释)在37oC中避光孵育1 h,然后用DAPI染色10 min,重复洗涤步骤,每孔加入一滴抗褪色剂固定液,将样品密封,然后使用荧光显微镜(奥林巴斯,日本)进行荧光点定位拍照。
1.7 蛋白质印迹分析 用RIPA裂解液(ComWin Biotech,中国)在冰上对正常培养液和1、2和4 mg/ml四逆软肝方水提物培养液干预的各组细胞进行裂解30 min,提取细胞总蛋白,并用BCA蛋白测定试剂盒(LiankeBio,中国)进行蛋白定量,计算蛋白浓度后进行蛋白含量配平,按照4∶1比例加入蛋白上样缓冲液,并用金属浴进行蛋白变性10 min。然后,将蛋白质样品(50 μg)经标准SDS-PAGE(LiankeBio,中国)处理后,转移到PVDF膜(Biosharp,中国)上,在含有5%(重量/体积)脱脂牛奶或5%BSA的Tris缓冲盐水(TBS-T;0.1%吐温-20)中封闭60 min,阻断非特异性蛋白结合。然后孵育膜用5%BSA稀释于TBST中的初级抗体于4oC过夜孵化。用TBS-T洗涤3次,每次10 min,再用次级抗体(Goat anti-rabbit IgG,PBS稀释,按1∶1 000稀释)(Proteintech,美国)在室温下孵育3 h。TBS-T洗涤3次,每次10 min,使用Potent ECL底物试剂盒(LiankeBio,中国)用化学发光法检测目标蛋白带。这些图像是在化学发光成像设备(Bio-Rad,美国)中获取的,并且使用Image Lab软件进行扫描密度测定。
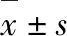
2 结果
2.1 四逆软肝方对LX-2细胞活性的影响 采用0.1、1、1.25、2.5、10和100 mg/ml的多剂量四逆软肝方分别评价其对LX-2细胞的生长抑制作用。细胞存活率通过CCK-8分析进行定量,结果发现在四逆软肝方治疗48 h后均以剂量依赖的方式降低(图1A)。正常培养液组作为阴性对照。与正常对照组相比,四逆软肝方组的细胞存活率均显著下降。采用0.1、1、10和100 mg/ml的多剂量四逆软肝方处理HSC细胞48 h后测定了(乳酸脱氢酶)LDH,见图1B。除了四逆软肝方(100 mg/ml)组与对照组相比有显著升高,其他四逆软肝方组均无显著升高。表明四逆软肝方可抑制LX-2的细胞增殖,且100 mg/ml以下剂量对细胞毒性小。结合细胞存活率和细胞毒性,我们选择3种不同浓度的四逆软肝方(1、2和4 mg/ml)进行后续试验。

图1 四逆软肝方作用下LX-2的细胞活力和毒性与对照组比较,*P<0.05,**P<0.01
2.2 四逆软肝方对LX-细胞凋亡的作用 结果显示,四逆软肝方诱导LX-2细胞凋亡在早期和晚期细胞凋亡及总凋亡中呈剂量依赖性。与对照组相比,除了四逆软肝方(1 mg/ml)组的早期凋亡率无显著改变,其他各组均有显著升高。见插页彩图2A、2B。凋亡蛋白执行子Cleaved-caspase 3免疫荧光分析显示,在2、4 mg/ml的浓度时,Cleaved-caspase 3蛋白的荧光强度均明显升高(插页彩图2C)。

蛋白质印迹分析显示,在4 mg/ml的浓度时Bcl-2显著降低,2、4 mg/ml浓度时Bax显著上调。
2.3 四逆软肝方对细胞外基质降解的影响 免疫荧光试验和进一步的Western blot分析显示,2、4 mg/ml的四逆软肝方可降低TIMP-1蛋白的表达 (插页彩图3A、图4)。同时,TGF-β1的表达也相应下调 (插页彩图3B)。
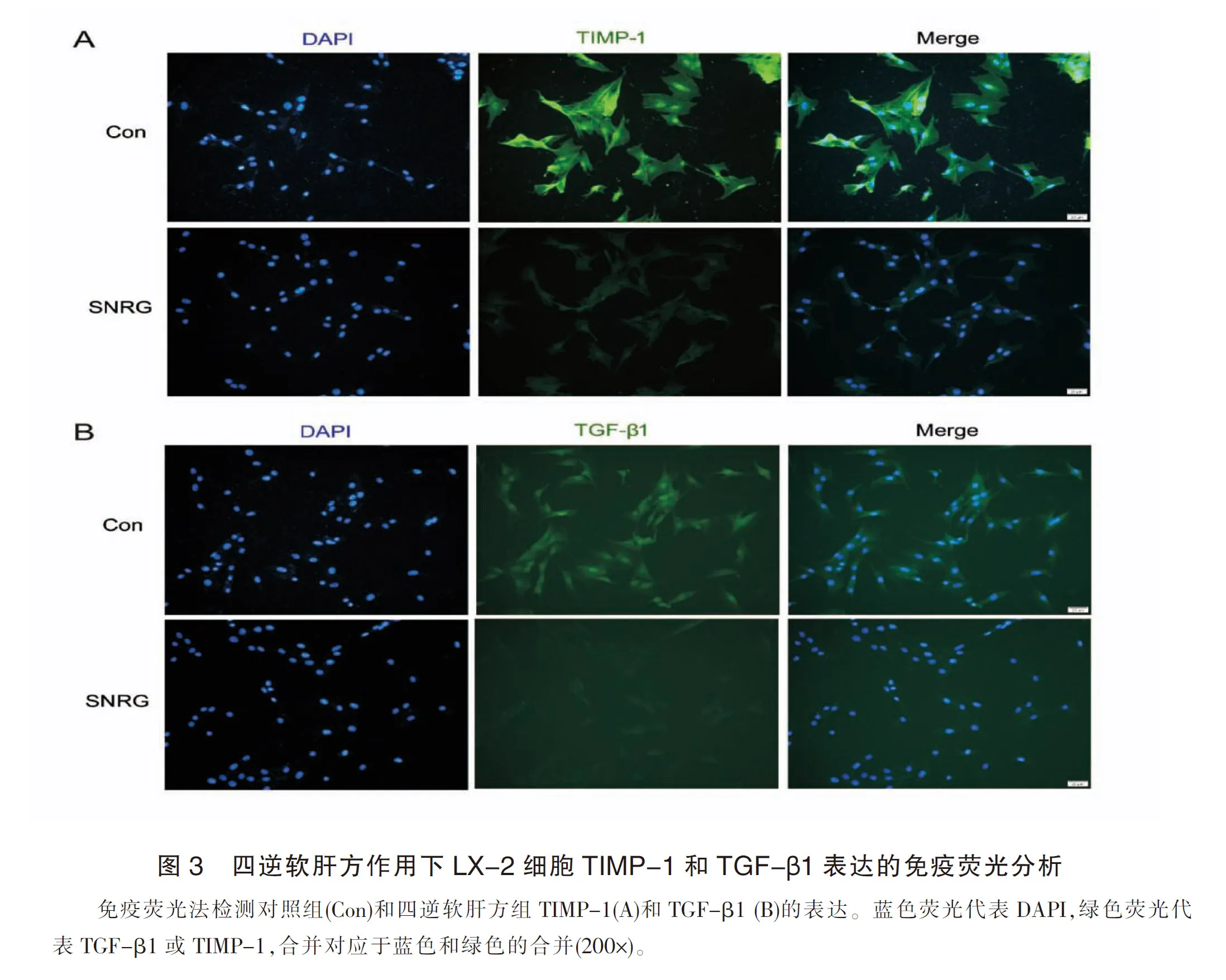
Western blot检测α-SMA(HSC活化标志性蛋白)、β-catenin的表达水平 ,结果显示四逆软肝方1、2 mg/ml浓度时,α-SMA蛋白明显下调;2、4 mg/ml浓度时抑制TIMP-1、β-catenin蛋白的表达。四逆软肝方可能通过β-catenin途径抑制LX-2细胞活化,并降低活化后LX-2细胞中TIMP-1和TGF-β1蛋白的表达。见图4。
图4 四逆软肝方作用下LX-2细胞TIMP-1、α-SMA和β-catenin表达的Western Blot 分析与对照组比较,*P<0.05,**P<0.01
3 讨论
肝纤维化是肝硬化和慢性肝衰竭发生的主要危险因素[8]。HSC的激活是这一过程的关键组成部分。因此,靶向星状细胞是抗纤维化治疗的主流[9]。针对HSC的治疗干预可能包括下调星状细胞活化、抑制HSC增殖、诱导HSC凋亡[10]。在本研究中,四逆软肝方通过凋亡诱导对人肝星状细胞LX-2株表现出明显的抗增殖作用。进一步研究表明,四逆软肝方能在体外通过下调TIMP-1、TGF-β1促进细胞外基质降解并通过下调β-catenin和α-SMA蛋白使LX-2细胞失活。四逆软肝方抑制LX-2细胞增殖,并通过上调Cleaved caspase-3、Bax的表达和下调Bcl-2的表达促进细胞凋亡。四逆软肝方还能促进ECM的降解,抑制LX-2细胞的激活。在体外,四逆软肝方可能促进纤维化的消融。
调节HSC凋亡的主要有Caspase 家族、Bcl-2 家族等通过各种凋亡信号途径引起细胞凋亡。Bcl-2为凋亡抑制因子,Bax为凋亡促进因子,在线粒体凋亡途径中起着重要的作用[11]。Bcl-2/Bax对细胞接受刺激后的存活有关键作用,比值升高,细胞存活率就高,反之比值降低,则细胞凋亡率高[12-14]。Caspase-3 是Caspase 家族中最重要的凋亡执行者之一,在细胞凋亡发生过程中扮演了关键角色,Caspase-3 蛋白的表达与细胞凋亡呈正相关[15]。Caspase-3在正常情况下以酶原的形式存在,当细胞发生凋亡时,caspase-3被活化成为cleaved-caspase 3,发挥促进细胞凋亡的作用[16]。本研究结果提示,四逆软肝方抗肝纤维化作用不仅仅是抑制LX-2细胞细胞增殖,更是通过促进LX-2细胞凋亡实现的。Nexcelom Cellometer细胞凋亡率检测结果显示,SNRG具有促进LX-2细胞凋亡的作用,并呈剂量依赖。
SNRG诱导LX-2细胞细胞凋亡的机制可能是通过上调Bax和cleaved-caspase 3蛋白,下调Bcl-2蛋白表达,降低Bcl-2 /Bax比例,从而通过Caspase依赖性和线粒体依赖性途径诱导细胞凋亡诱导LX-2细胞凋亡。
肝星状细胞的活化是肝纤维化发生发展过程中的重要组成部分。HSC通常是静止的,但它们在肝脏损伤时被激活,变得增殖和成纤维,并随后积累ECM[17,18]。HSC被多种细胞因子激活,TGF-β是最重要的促纤维化因子[19]。活化的HSC是肝损伤中TGF-β的主要细胞来源。TGF-β促进HSC向肌成纤维细胞的转化,促进ECM蛋白的合成,抑制其降解。
近年来,越来越多的研究表明,β-catenin信号在肝纤维化发生发展中起关键作用。Ge等[20]研究发现,与正常肝组织相比,肝纤维化程度越高,其肝组织中β-catenin表达水平越高,沉默β-catenin可抑制Ⅰ型、Ⅲ型胶原的分泌和肝星状细胞增殖,介导细胞凋亡。对β-catenin 的调控有望成为抗肝纤维化治疗的靶点和方向。我们的观察表明,四逆软肝方可明显抑制LX-2细胞中α-SMA(HSC细胞活化标志性蛋白)、β-catenin和TGF-β蛋白的表达。提示四逆软肝方可能通过β-catenin途径抑制LX-2细胞的活化。
此外,TGF-β还影响基质降解,其特点是对基质金属蛋白酶(MMPs)和TIMPs的混合作用。纤维化反映了MMPs和TIMPs介导的ECM产生和降解之间的平衡。根据Yoshiji[21]的说法,TIMP-1通过减少MMPs活性和抑制HSC凋亡,显著减轻肝纤维化的自发分解。在体外,四逆软肝方能显著降低TIMP 1蛋白在LX-2细胞中的表达,并可能通过减少TIMP 1的表达间接改变净基质蛋白酶的活性,从而促进细胞外基质的降解。此结果也与本课题组前期实验结果一致[7]。
四逆软肝方为赵国荣教授根据30多年的临床经验,辨证与辨病相结合所创立的治疗肝纤维化、肝硬化的方剂,主要以茵陈、田基黄、川贝、桃仁、牡丹皮、煅牡蛎、西洋参、白芍、白术、茯苓等药物组成,能疏肝健脾,益气活血,并辅以清热祛湿。该方能从逆转肝硬化、逆转肝纤维化、逆转肝硬化失代偿期、逆转肝功能不全4个方面对肝病不同阶段起到良好的治疗效果[6]。本课题组前期研究也发现,四逆软肝方可降低受损的人肝星状细胞LX-2株 HA、PCIII、TIMP-1指标的表达,可能是其抗肝纤维化的部分作用机制[7]。
