肝动脉化疗栓塞术联合射频消融术治疗不可切除肝细胞癌的疗效分析
2020-12-26黄群国刘启榆张顺源
黄群国 刘启榆 周 莹 何 瑜 张顺源
四川省绵阳市中心医院放射科 (四川 绵阳, 621000)
最新流行病学研究显示,全球每年新增肝细胞癌(HCC)65~75万例,而中国占其中的50%~60%[1]。多数HCC因早期无明显症状,起病隐匿,进展速度快,在确诊时已属中晚期,失去了手术切除或肝移植的最佳治疗机会[2,3]。近年来,肝动脉化疗栓塞术(TACE)、射频消融(RFA)等介入治疗备受学者青睐,是目前治疗不可切除HCC的主要治疗方法[4,5]。有研究报道,单纯的TACE和RFA治疗 HCC效果不理想,前者虽然通过栓塞肿瘤供血和局部化疗起治疗作用,但其HCC复发率及转移率较高[6],而后者尽管通过局部热消融发挥作用,但因其创伤性小,对肿瘤组织>5 cm的肝癌单独应用时很难深入肿瘤组织内部诱导肿瘤完全坏死[7],因此理论上两者联合应用可取长补短,有助于提高HCC患者的疗效[8,9]。本研究收集我院接受TACE联合RFA治疗的HCC患者资料,分析其手术并发症、局部控制率及中短期生存率,并对患者的生存情况进行单因素分析,旨在为临床诊疗提供参考。
1 资料与方法
1.1 一般资料 选择我院2016年5月至2019年3月接受TACE联合RFA治疗的52例HCC患者(71个病灶)作为观察组,其中男45例,女7例,年龄40~88岁,平均(66.4±10.2)岁。Child-Pugh评级:A级38例,B级14例;肿瘤累及单叶39例,双叶13例;病灶单发31例,多发21例。病灶直径29.7~110.3 mm,平均直径(49.4±15.6)mm;以同期行TACE治疗的49例HCC患者(69个病灶)为对照组,观察组与对照组患者年龄、性别、Child-Pugh分级、肿瘤最大径和肿瘤分期等方面差异均无统计学意义,两组数据具有临床可比性。本研究按照赫尔辛基宣言进行,并经本院伦理委员会批准,批准文号为LL1512013。
1.2 纳入及排除标准 纳入标准:①HCC诊断经肝组织病理学证实;②术前肝脏MRI平扫 + 增强检查符合肝脏肿瘤诊断;③无外科治疗指征;④符合TACE和RFA治疗指征;⑤ECOG评分≤ 1分,预计生存时间> 3个月。排除标准:①有严重的凝血功能障碍等介入治疗禁忌者;②肝动脉造影提示有严重的肝动脉-(门)静脉瘘者。③合并其他恶性肿瘤;④合并严重的心肺等器官功能不全者。
1.3 治疗方法
1.3.1 TACE治疗 患者取仰卧位,双侧腹股沟区消毒、铺巾;常规采用Seldinger法穿刺右侧股动脉,留置5 F动脉鞘(美国Cook公司);5 FRH导管(美国Cook公司)插管至肝动脉,造影评估肝内病灶情况;选择性插管至肿瘤供血动脉,必要时联合应用微导管(日本Terumo公司);经导管注入化疗栓塞剂[罂粟乙碘油5~15 ml(江苏恒瑞医药股份有限公司)+表柔比星20~40 mg(海正辉瑞制药有限公司)+奥沙利铂100~200 mg(南京制药厂有限公司)],必要时联合明胶海绵颗粒(杭州艾力康医药科技有限公司)进行栓塞;术毕拔除导管、鞘管,穿刺点加压包扎。
1.3.2 TACE联合RFA治疗 患者在TACE术后2~3周进行RFA治疗。首先进行肝脏CT检查,根据影像结果选定体位、穿刺点、进针方向和进针深度。采用北京博莱德光电技术公司生产的RFA-I 型设备及其配套射频针进行RFA治疗。穿刺点局部麻醉、铺巾;在CT引导下穿刺病灶,穿刺到位后推出内套针,展开集束电极针。根据病灶的大小和位置设置射频温度和时间。常规设置条件为温度90~110 ℃,时间20~30 min。病灶较大时采用多位点射频治疗,保证消融范围超过病灶边缘至少1 cm。
1.4 观察指标和随访 观察所有患者手术相关并发症情况。出院后采用复诊或电话方式进行随访。联合治疗后1个月进行肝脏MRI平扫+增强检查。完全反应(CR)定义为增强各期病灶完全不显影,肿瘤局部控制率以CR表示,以及全组患者半年、1年、2年、3年累积生存率,影响患者生存率的可能因素进行统计与分析。死亡为随访终点,失访或截至随访终点(2019年6月30号)仍存活的病例做统计学分析时均按截尾数据处理。
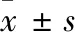
2 结果
2.1 手术并发症情况 所有患者TACE、RFA手术均顺利完成,成功率为100.0%。患者手术耐受性良好,仅出现恶心、呕吐、疼痛、发热等轻微并发症,经内科对症处理后缓解。
2.2 肿瘤局部控制率 观察组患者联合治疗后1个月,MRI提示64.8%(46/71)的病灶取得CR。与对照组相比,观察组患者病灶直径< 50 mm组CR率高于直径≥ 50 mm组,差异有统计学意义(P< 0.05),而病灶CR率与病灶数量、既往治疗史无相关关系(P> 0.05)。见表1、图1。
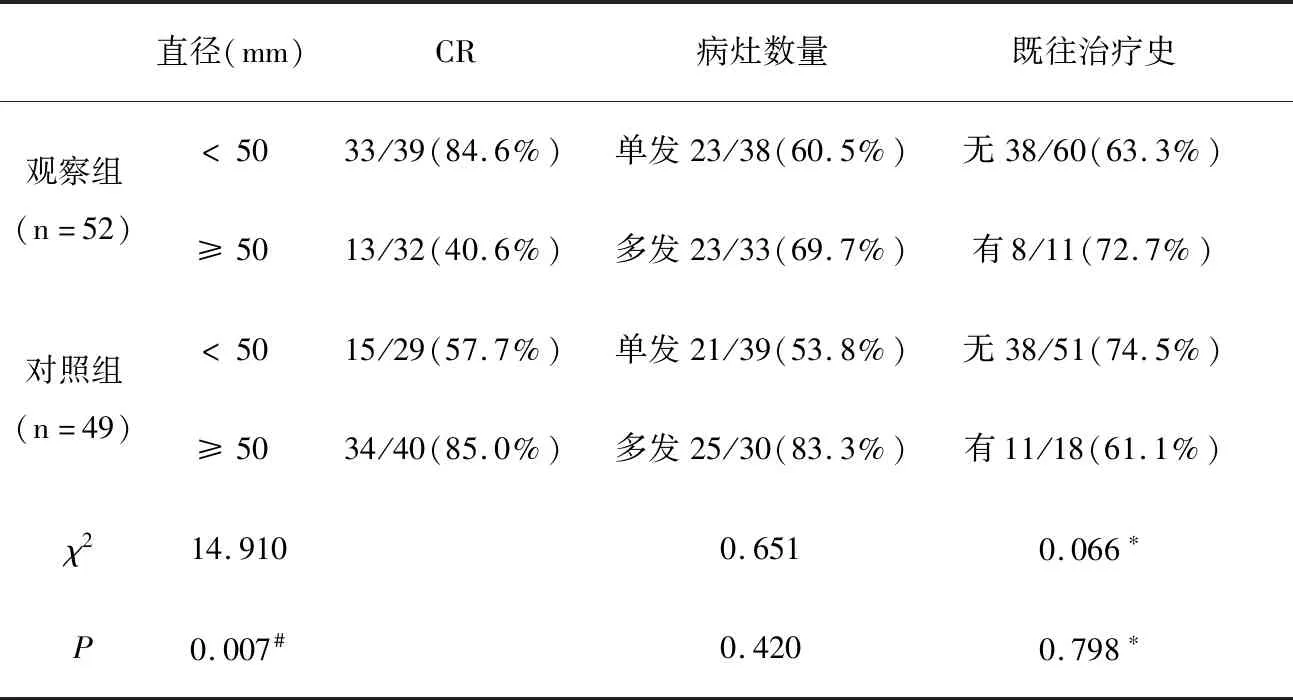
表1 两组患者治疗1月后病灶控制情况
2.3 患者生存情况 两组患者随访3~37个月,平均(15.1±8.0)个月。与对照组患者比较,观察组患者半年、1年、2年、3年累积生存率分别为96.2%、83.6%、48.1%、32.7%,差异有统计学意义(P<0.05),见表2。
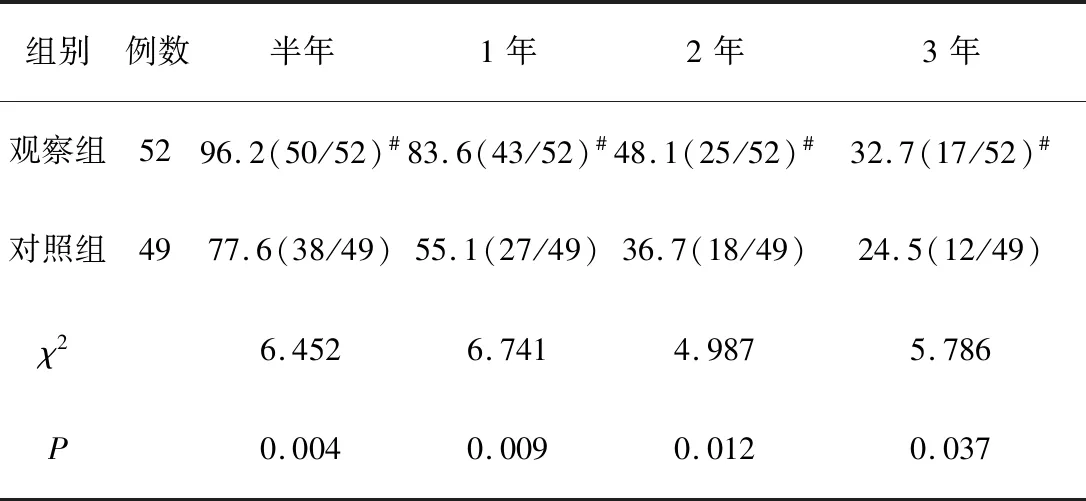
表2 两组患者短期生存率比较 (%,例)
2.4 观察组患者生存的单因素分析 Kaplan-Meier单变量分析显示,HCC患者不同性别、年龄、病灶数量、病灶部位、Child-Pugh分级、既往治疗史组间生存时间差异均无统计学意义(均P>0.05),见表3、图1。
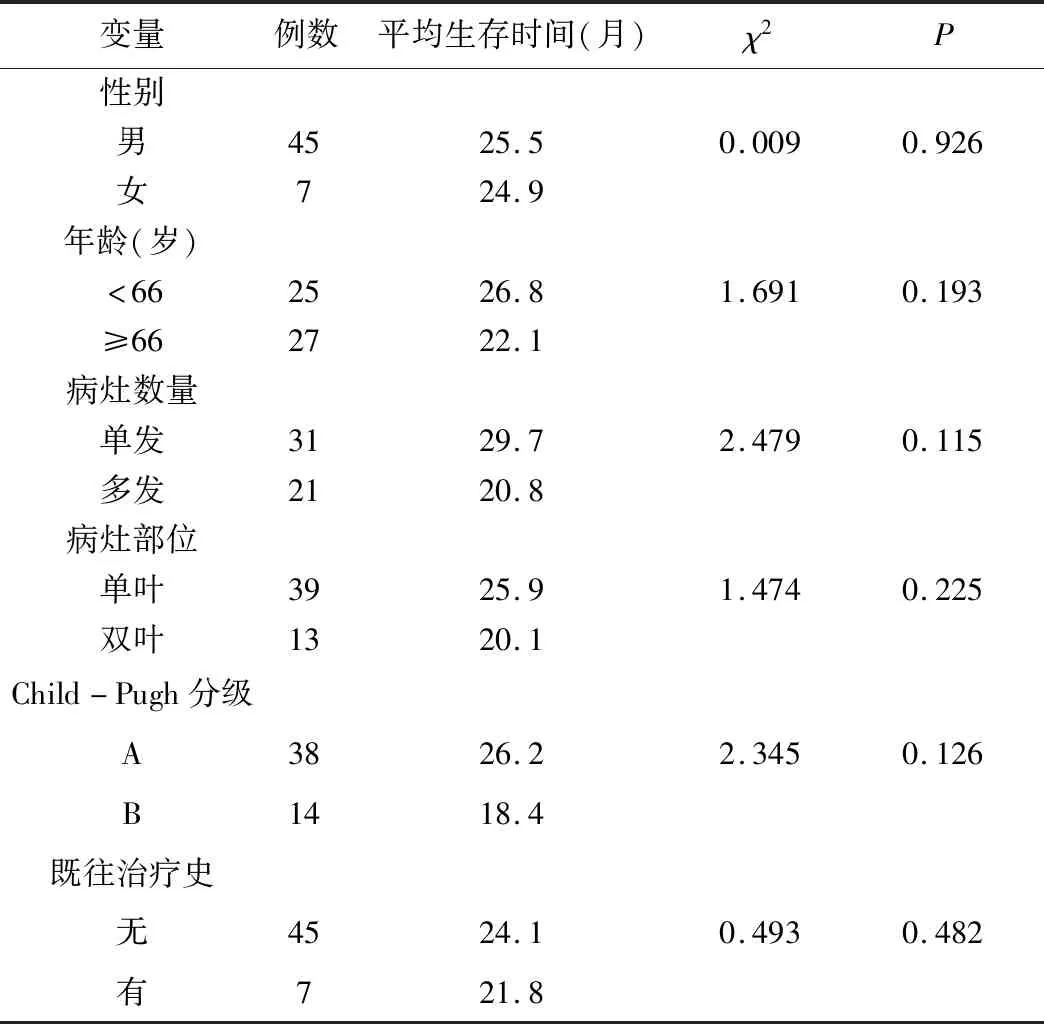
表3 观察组患者生存时间的单因素分析
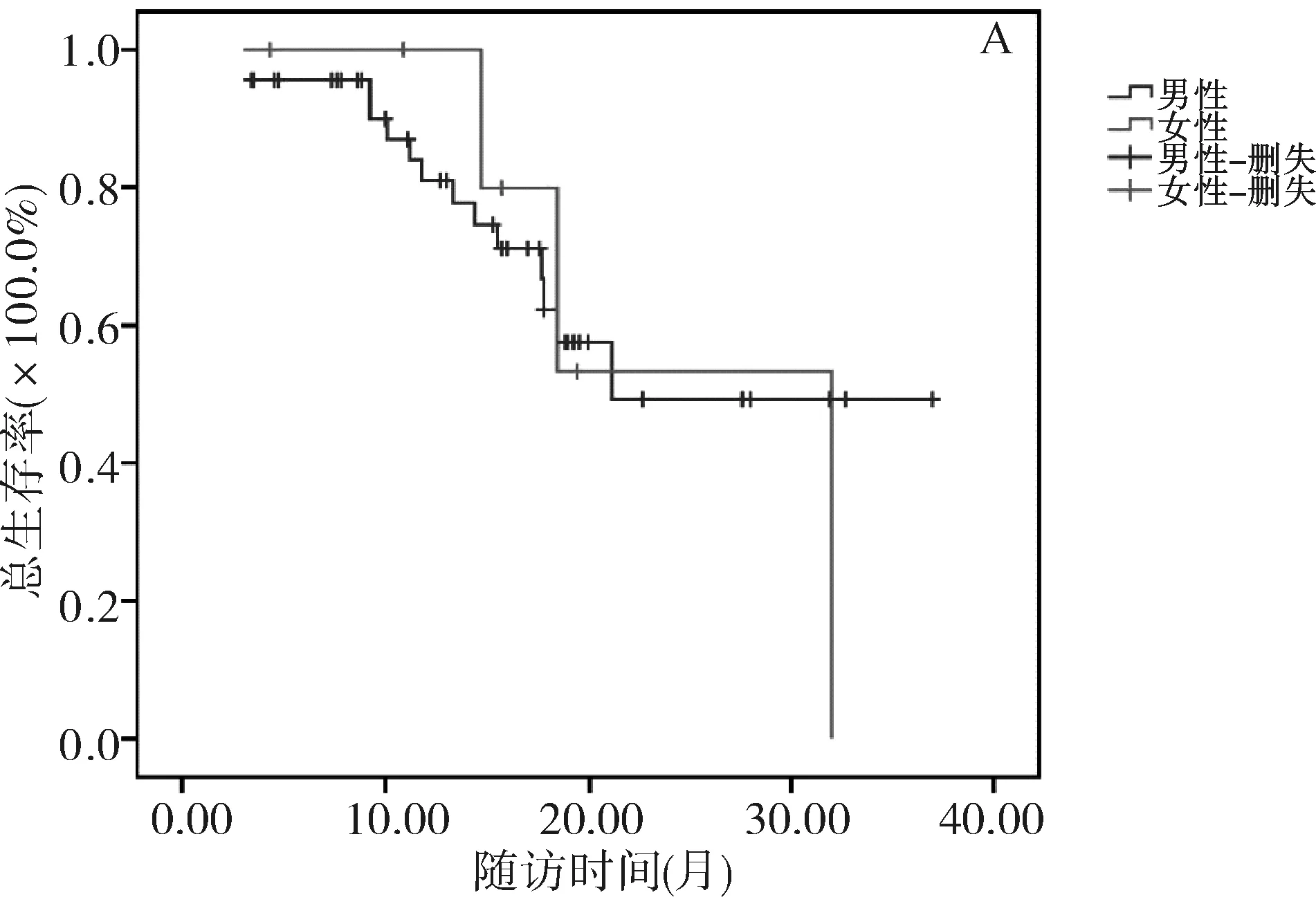
图1 观察组患者不同性别、年龄、病灶数、病灶部位、Child-Pugh分级、既往治疗史的生存曲线A.不同性别;B.不同年龄;C.单发灶与多发灶;D.病灶累及单叶与双叶;E.Child-Pugh A级和B级;F.既往有无治疗史
3 讨论
近年来,越来越多的研究表明多种疗法的联合应用是改善HCC患者预后的有效途径,肝癌治疗逐渐转变为多学科综合治疗模式[10]。TACE与RFA联合治疗HCC具有互补性。TACE可阻断肿瘤的血供,使肿瘤去血管化,在 RFA治疗时射频电极产生的热能不易随着血液循环带走,从而消除热沉降效应,升高肿瘤局部的温度,最终提高RFA的疗效。且TACE后碘化油在肿瘤内沉积,行 RFA 治疗时起到导引作用,大大缩短了射频治疗的时间,使肝癌的完全坏死率明显提高[11,12]。
Su等[13]比较TACE联合RFA和单纯TACE治疗早期HCC的近期疗效,结果显示,术后1个月时联合组治疗有效率明显高于TACE组(P<0.001),两组累积1年、2年、3年总生存率分别为100%、97%、93%和91%、79%、71%(P= 0.008)。Kim等[14]研究发现,TACE术后再进行RFA可以明显减少消融时的热扩散,从而增加消融的坏死范围;而TACE对肿瘤的栓塞和化疗作用,最终也会与RFA起协同作用,达到改善疗效的目的。TACE和RFA联合应用已逐渐得到认识,但两种疗法应用的顺序和间隔时间尚存在很大争议。笔者总结经验认为,根据两者的治疗原理和特点,合理的方案应该是先行TACE再行RFA。如果间隔时间过长(比如> 1个月),那么将会削弱两者的互补增益效果,而如果间隔时间过短(比如< 1周),则可能加剧患者的术后并发症,故本研究选定的时间间隔为2~3周。
多数研究发现,TACE联合RFA治疗HCC的并发症均可控制,未出现永久性不良后遗症或手术相关死亡[15]。本研究结果显示,大多数HCC患者手术耐受性良好,仅出现轻微并发症,经对症处理后缓解,表明联合治疗应用于不可切除HCC治疗具有较好的安全性,这与既往大多数研究结果相似[16,17]。Kim等[14]研究显示,TACE联合RFA治疗HCC的围手术期死亡率为0.1%~0.5%,其中肝功能衰竭和败血症是最常见的死亡原因。本组病例围手术期间无患者出现死亡,也说明了联合治疗的安全性。
杜娟琳等[17]研究显示,HCC患者行单纯TACE和单纯RFA术后1个月肿瘤完全消融率分别为50.0%和52.5%,均低于本研究的64.8%(46/71),表明联合治疗的疗效优于单纯TACE和RFA治疗。此外,本研究71个病灶中,直径< 50 mm组病灶CR率高于直径≥50 mm组,这与既往大多数研究结果一致[18]。程洪涛等[19]分析TACE联合RFA治疗HCC的疗效与肿瘤直径的关系,结果显示,< 30 mm组、30~50 mm组、50~70 mm组、≥ 70 mm组的CR率分别为100.0%、92.6%、53.8%、22.2%(P< 0.05)。Hsieh等[20]在单纯RFA治疗HCC的研究中也得出了相同的结论。较大HCC病灶疗效较差的原因:①大肝癌侧支循环丰富,常伴有异位动脉供血和门静脉供血,TACE后肿瘤CR率较低;②RFA治疗大肝癌时存在“热沉效应”,也限制了肿瘤的CR率。有研究显示单发肿瘤患者联合治疗后CR率显著高于多发肿瘤患者(84.8%vs50.0%,P<0.05)[21],而与此不同,本研究结果显示病灶数量与CR率的关系无统计学意义,结果不同的原因可能与本研究病例数较少有关。
中晚期HCC患者1年和2年的生存率分别约为55%和25%[22],而本研究结果显示,与对照组患者相比,观察组患者半年、1年、2年、3年累积生存率分别为96.2%、83.6%、48.1%、32.7%,表明TACE联合RFA治疗HCC具有较好的疗效,显著改善了患者的中短期预后。Tang等[23]探讨TACE联合RFA治疗不可切除HCC的疗效和安全性,根据不同疗法分为RFA组(n=49)、TACE组(n=43)及联合组(n=40),结果显示,联合组3年内肝内无复发生存率明显高于TACE组(42.5%vs20.9%,P=0.009)和RFA组(42.5%vs22.5%,P=0.011),3年总生存率也明显高于TACE组(45.0%vs26.5%,P=0.010)和RFA组(45.0%vs27.9%,P=0.005)。此外,本研究Kaplan-Meier单变量分析显示,不同性别、年龄、病灶数量、病灶部位、Child-Pugh分级、既往治疗史分组间生存时间均无统计学差异,原因可能为治疗产生的显著效果克服了HCC自然病史的常见预后因素,或者样本量和随访时间不足以检测不同患者分组间的微小差异。本研究中生存曲线显示高龄组、肿瘤单发组、肿瘤单叶组、Child-Pugh A组具有更好的预后趋势也支持了这一观点。
