动脉瘤性蛛网膜下腔出血患者脑脊液过氧化物酶2水平与预后的关系
2020-12-24方锦才安海龙杨欣刚张佳克
方锦才 安海龙 杨欣刚 张佳克
动脉瘤性蛛网膜下腔出血(aneurysmal subarachnoid hemorrhage,aSAH)是指动脉瘤破裂后,血液流入蛛网膜下腔[1]。aSAH发病较急,预后较差,常并发脑水肿、迟发性脑缺血及癫痫等[2,3]。研究表明20%~50%的重症aSAH可在手术或介入治疗中获益,但其余aSAH患者,即使采取积极治疗,预后仍较差[4]。因此,进行有效的术前评估,对于临床医生采取适当的治疗手段及评估患者预后均有重要意义。Hunt-Hess分级及WFNS分级均无法在术前准确评估aSAH患者预后,因此,需探寻敏感度和特异性更高的指标对aSAH患者预后进行评估[4]。过氧化物酶2(peroxisome 2,Prx2)是抗氧化蛋白超家族中的一员,广泛存在于原核及真核生物体内[5]。Prx2有清除氧自由基及抗炎的作用,可保护神经细胞免受损伤[6]。目前,已有研究表明Prx2与缺血性脑卒中、毕克病、帕金森病及阿尔茨海默病有关,但关于其与aSAH的关系还未可知[7~9]。因此,笔者开展本研究,以期探讨Prx2与aSAH患者预后的关系。
资料与方法
1.一般资料:选择2016年8月~2019年1月在武警海警总队医院就诊的93例aSAH患者作为研究对象。所有入组患者均根据《中国动脉瘤性蛛网膜下腔出血诊疗指导规范(2016年)》诊断及治疗[10]。纳入标准:(1)患者年龄18~80岁。(2)经CT动脉造影或数字减影血管造影检查确诊为aSAH。(3)患者直系亲属签署了知情同意书。(4)患者于发病12h内接受手术或介入治疗。排除标准:(1)非动脉瘤性蛛网膜下腔出血患者。(2)因感染、创伤等因素导致的动脉瘤破裂引发的SAH。(3)严重凝血功能障碍,血小板计数低于100×109/L,国际标准化比值>1.4或有明显出血征象者。(4)妊娠期或哺乳期女性。(5)合并严重心脏、肝脏、肾脏等脏器功能障碍者。(6)既往有SAH、脑卒中及其他神经功能疾病者。(7)生命体征不稳定者。本研究经笔者医院医学伦理学委员会批准。
2.资料收集:收集患者年龄、性别、体重指数(body mass index,BMI)、高血压病史、高脂血症史、糖尿病史、动脉瘤位置、动脉瘤直径、Hunt-Hess分级、Fisher分级、脑血管痉挛(大脑中动脉平均流速>120 cm/s,且同侧Lindegaard指数≥3)、C反应蛋白(C-reactive protein,CRP)、治疗方式[开颅夹闭术(手术)、血管内介入术(介入)]及格拉斯哥昏迷评分(Glasgow coma score,GCS)等资料。
3.脑脊液Prx2水平检测:采用腰椎穿刺采集aSAH发病12h内患者脑脊液,并在4℃环境下,3000r/min,离心10min,离心后提取上层清液。采用ELISA双抗夹心法检测aSAH患者脑脊液中Prx2水平。Prx2试剂盒购自南京恒渡医疗技术有限公司,批号为HD39879。
4.预后随访及预后结局评判:采用门诊、电话及视频等方式对aSAH患者进行为期3个月的随访,每月随访1次,随访起始时间为2016年9月10日,截止时间为2019年4月25日,了解患者的恢复情况并进行改良Rankin量表(mRS)评分。采用mRS评分评价aSAH患者发病治疗后3个月预后情况。mRS评分1分:症状轻微,无明显残疾,可独自完成日常活动;2分:轻度残疾,能独自料理日常生活,但不能完全从事发病前的活动;3分:中度残疾,可独自行走,但其他复杂日常活动需他人帮助;4分:重度残疾,不能独自行走,且其他日常活动需他人照拂;5分:严重残疾,患者持续卧床,大小便失禁,需持续床旁护理;6分:患者死亡。预后良好患者mRS评分为0~2分,预后不良患者mRS评分为3~6分[11]。

结 果
1.两组基线资料比较:93例aSAH患者,年龄22~64岁,平均年龄44.13±9.22岁,其中,男性37例,女性56例。根据患者预后结局将其分为预后良好组(n=44)和预后不良组(n=49)。两组在年龄、性别、BMI、动脉瘤位置、高脂血症、糖尿病治疗方式方面比较,差异均无统计学意义(P>0.05);在高血压、Hunt-Hess分级、Fisher分级、CRP、脑血管痉挛、GCS评分及动脉瘤直径方面比较,差异均有统计学意义(P<0.05,表1)。
2.两组脑脊液Prx2水平比较:预后不良组脑脊液Prx2水平为7.77±3.28,高于预后良好组(3.18±0.71),差异有统计学意义(t=9.567,P=0.000)。

表1 两组基线资料比较
3.脑脊液Prx2评价aSAH患者预后的效能:脑脊液Prx2评价aSAH患者预后的ROC AUC为0.983(95% CI:0.932~0.999),最大约登指数为0.916,其所对应的最佳截断点、敏感度和特异性分别为4.10、93.88%和97.73%(图1)。
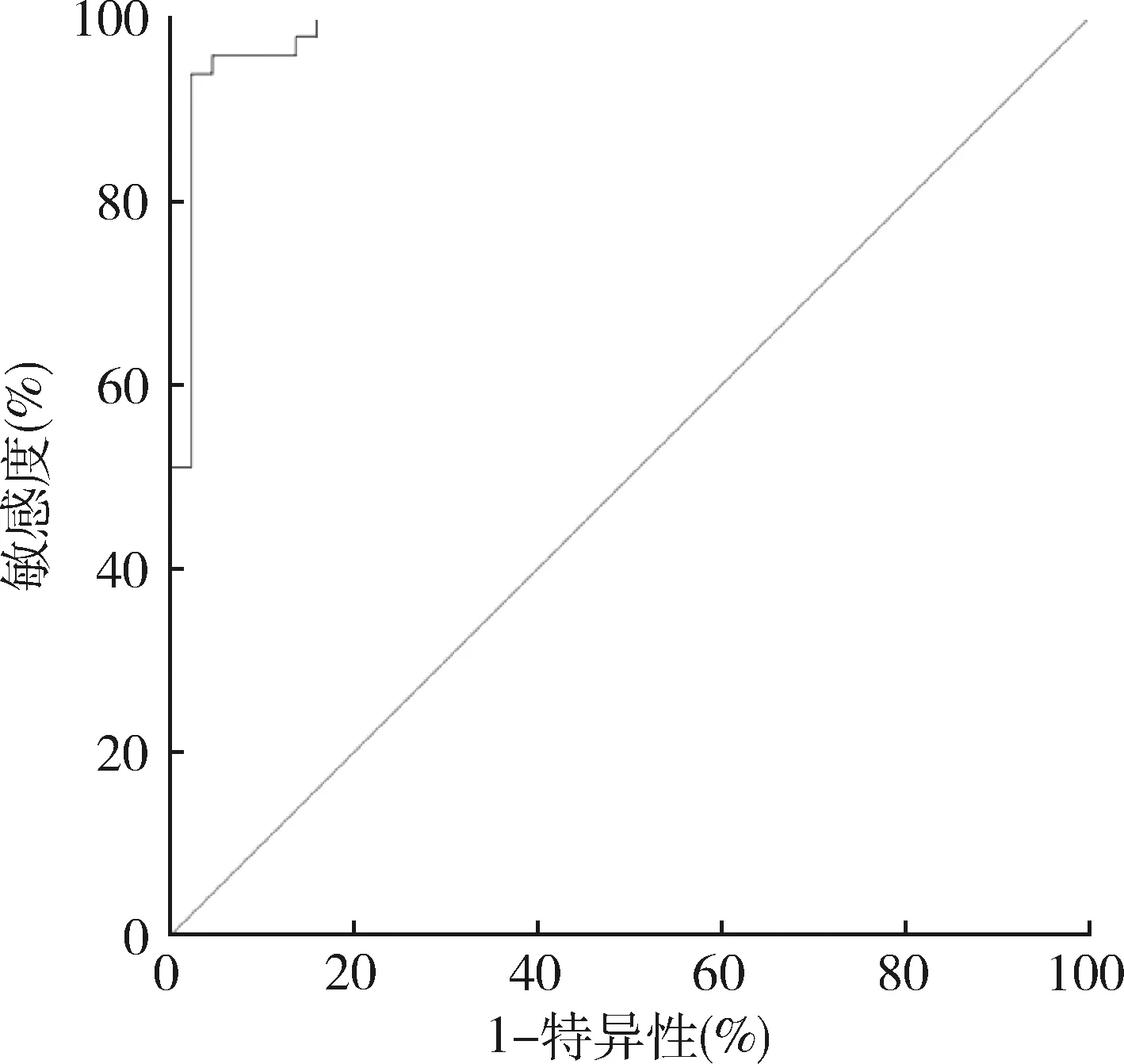
图1 脑脊液Prx2评价aSAH患者预后的ROC曲线
4.影响aSAH患者预后的相关因素:以CRP、GCS评分及脑脊液Prx2评价aSAH患者预后的最佳截断点为界,将其转换为二分类变量。将CRP(≤5.49mg/L=0,>5.49mg/L=1)、Hunt-Hess分级(Ⅰ~Ⅲ=0,Ⅳ~Ⅴ=1)、Fisher分级(Ⅰ~Ⅱ=0,Ⅲ~Ⅳ=1)、动脉瘤直径(≤1cm=0,>1cm=1)、脑血管痉挛(否=0,是=1)、高血压(否=0,是=1)、GCS评分(≤8分=0,>8分=1)及脑脊液Prx2(≤4.10=0,>4.10=1)作为自变量,将aSAH患者预后(预后良好=0,预后不良=1)作为因变量,纳入标准α≤0.1,纳入二元Logistic回归分析,aSAH患者Hunt-Hess分级(OR=8.244,95% CI:2.091~32.502,P=0.003)、Fisher分级(OR=1.453,95% CI:1.019~2.073,P=0.039)、动脉瘤直径(OR=8.701,95% CI:2.175~13.813,P=0.002)、脑血管痉挛(OR=3.528,95% CI:1.501~5.023,P=0.004)及脑脊液Prx2水平(OR=6.778,95% CI:2.733~12.366,P=0.005)与其预后密切相关(P<0.05,表2)。
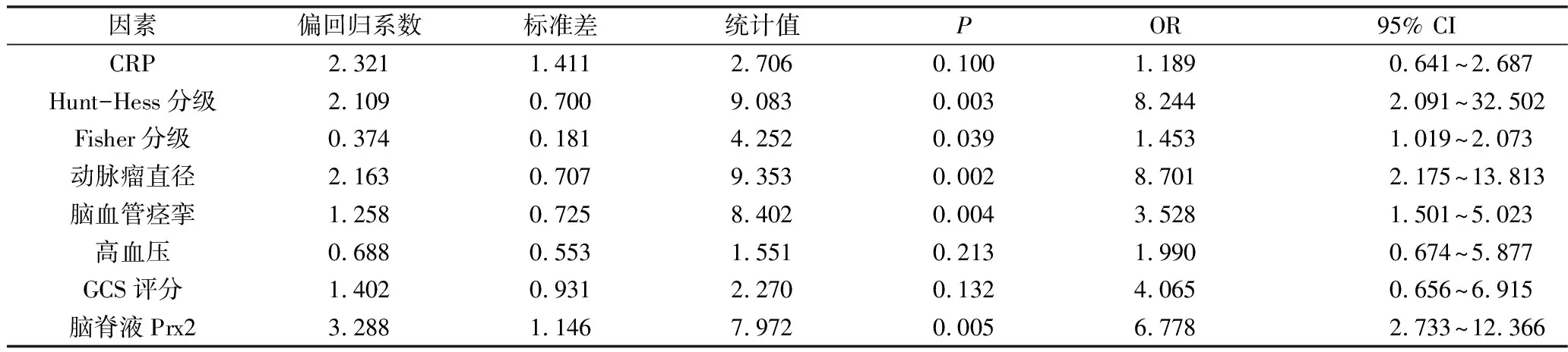
表2 影响aSAH患者预后的相关因素
讨 论
aSAH对机体是一个应激因素,当动脉瘤破裂,血液进入蛛网膜下腔后,脑病变区域将会产生大量自由基,在此条件下,脑神经元会受到氧化应激损伤,进而机体会发生各种变化,如脑水肿、癫痫、迟发性脑缺血等,甚至会发生脑死亡[12~15]。有基础研究证实Prx1在脑出血大鼠模型中特异性表达,其分布与疾病状态及病变部位有关,主要起保护脑神经元的作用[16]。Prx2在神经胶质瘤细胞中高表达,可通过调节细胞增殖周期保护脑细胞免受氧化应激损伤,此外,还可降低放、化疗的敏感度[17]。但关于Prx2在aSAH中的表达情况及其与预后的关系还未阐明。
本研究通过比较aSAH不同预后患者脑脊液Prx2水平,发现预后不良组脑脊液Prx2水平高于预后良好组,该结果表明脑脊液Prx2水平可能与aSAH病情进展有关,可反映aSAH患者预后结局。为证实上述猜想,笔者构建了脑脊液Prx2诊断aSAH患者预后结局的ROC曲线,结果显示其AUC为0.983,且敏感度和特异性均较高,该结果说明脑脊液Prx2水平对aSAH患者预后结局的判断有较高效能。笔者进一步采用Logistic回归分析与aSAH患者预后可能有关的因素,结果显示aSAH患者Hunt-Hess分级、Fisher分级、动脉瘤直径、脑血管痉挛与其预后密切相关,与已报道文献结果一致[18~20]。此外,本研究结果还发现脑脊液Prx2水平与aSAH患者关系密切。
aSAH发生后,血液进入蛛网膜下腔会引发急性脑积水、脑脊液流出道梗阻等,进而颅内压升高,致使脑血流量减小,最终导致脑水肿,诱发迟发性脑缺血[21]。在上述病理生理过程中,氧化应激及脑神经元细胞代谢均会产生大量过氧化氢及羟自由基,诱发DNA断裂、蛋白交联及脂质过氧化等,最终促使脑神经元细胞死亡[22]。Prx2是硫醇特异性抗氧化蛋白中的一种,在机体内主要以同源二聚体的形式存在,主要表达于脑组织中的小胶质细胞,可发挥抗氧化作用[23]。研究表明,Prx2具有较强的清除过氧化氢的能力,可保护细胞及组织免受氧化应激损伤[24]。此外,Prx2还可以抑制Ras-ERK-Nf-κB信号通路及抑制细胞衰老等[25]。近年来,有基础研究表明aSAH可通过TLR4/MyD88/Nf-κB信号通路激活脑小胶质细胞,当小胶质细胞被激活后会裂解红细胞及受损神经元细胞,使其释放Prx2[26]。因此,笔者推测Prx2在aSAH病理生理过程中发挥重要作用,检测脑脊液Prx2水平有助于了解aSAH病理生理机制及患者预后,但Prx2与aSAH疾病进展的关系仍有待于进一步开展基础研究证实。
本研究尚存在一定不足,由于人员及经费限制,仅选择了1名医生进行预后随访,对预后结果的判断可能存在主观偏倚,影响实验结果;其次,未动态观察患者脑脊液Prx2水平变化。此外,本研究为单中心研究,样本量有限,且无类似研究进行参考,无法准确计算该研究所需样本量。
综上所述,脑脊液Prx2水平与aSAH疾病进展存在一定关联,检测aSAH患者脑脊液Prx2水平有助于了解其预后。本研究下一步将动态观察aSAH患者脑脊液Prx2水平动态变化,旨在为aSAH患者治疗及预后评估提供更多参考。
