蒲公英甾醇对类风湿关节炎成纤维样滑膜细胞的增殖、迁移和凋亡及TLR4/NF-κB信号通路的影响
2020-12-24万海山代伟宏黄泽晓吴开弟曹国良何和与
万海山 代伟宏 黄泽晓 吴开弟 曹国良 何和与
类风湿关节炎(rheumatoid arthritis, RA)以滑膜增生、炎性关节、软骨和骨骼破坏为特征,是一种慢性炎性、全身性自身免疫疾病[1,2]。RA的病理机制是多方面的,涉及T细胞、B细胞、成纤维样滑膜细胞(FLS)以及许多促炎性细胞因子的复杂相互作用。因此,揭示影响免疫调节和炎症消退的途径是更好地了解RA的病理生理学和设计治疗这种严重关节疾病的新方法的主要关注点[3]。RA会导致关节畸形和破坏,导致人们失去工作能力,甚至导致死亡[4]。尽管现有疗法有一定效果,但部分RA患者对当前疗法仍无有效反应,而且治疗可能会引起严重的不良反应[5]。因此,有必要寻找治疗RA的新策略。
蒲公英是多年生草本植物,用于治疗急性结膜炎、皮肤溃疡和其他炎性疾病[6]。蒲公英甾醇是一种从蒲公英中提取的活性化合物,其分子结构类似于类固醇激素,并且已被证明在体内和体外均具有抗炎作用[7]。近年来研究发现,蒲公英甾醇在乳腺炎、胃炎等疾病中已有研究[8,9]。但是,目前关于蒲公英甾醇在RA中的研究报道很少。众所周知,TLR4/NF-κB通路在炎性反应的调节中起着重要作用[6]。此外,TLR4可以激活关键的炎性介质NF-κB来调节炎性反应[7]。TLR4/NF-κB在RA中已有研究,但是蒲公英甾醇对TLR4/NF-κB信号通路的研究甚少。
本实验研究蒲公英甾醇对体外培养的人类风湿关节炎成纤维滑膜细胞(MH7A细胞)增殖、迁移和凋亡及TLR4/NF-κB信号通路的影响,进一步探讨其作用机制,为未来蒲公英甾醇在临床上治疗RA提供新的理论依据。
材料与方法
1.细胞:人RA成纤维滑膜细胞系MH7A购自中国科学院上海细胞生物学研究所。
2.试剂:RPMI1640培养基、胎牛血清购自美国Hyclone公司。蒲公英甾醇(HPLC≥98%)购自成都瑞芬思生物科技有限公司。LPS购自美国Sigma公司。CCK-8试剂盒购自美国Gibco公司。5-乙炔基-2′-脱氧尿苷(5-Ethynyl-2′-deoxyuridine, EDU)试剂盒和Annexin Ⅴ-FITC/PI凋亡检测试剂盒购自瑞士Roche公司。Transwell小室购自美国Promega公司。RIPA裂解液和BCA试剂盒购自英国Abcam公司。兔抗p-TLR4抗体、兔抗TLR4抗体、兔抗p-NF-κB p65抗体、兔抗NF-κB p65抗体、兔抗β-actin抗体和山羊抗兔IgG二抗购自美国Cell Signaling Technology公司。
3.细胞培养:MH7A细胞用含10%胎牛血清的RPMI1640培养基,置于37℃、5% CO2的细胞培养箱中进行培养,2天更换1次培养基,以保证细胞所需的营养成分。传代3次后可以进行后续的实验。
4.CCK-8法检测蒲公英甾醇毒性:MH7A细胞以3×103个细胞接种到96孔板中,每孔100μl。根据蒲公英甾醇不同浓度将实验分为0μg/ml蒲公英甾醇组[Tar(0)组]、5μg/ml蒲公英甾醇组[Tar(5)组]、10μg/ml蒲公英甾醇组[Tar(10)组]、15μg/ml蒲公英甾醇组[Tar(15)组]、20μg/ml蒲公英甾醇组[Tar(20)组]和25μg/ml蒲公英甾醇组[Tar(25)组],每组3个复孔,置于37℃、5% CO2条件下孵育24h。将10μl CCK-8试剂加到每个孔中。2h后使用酶标仪在450nm处测量每孔细胞的吸光度(A)值,计算细胞活力。
5.细胞分组及培养:MH7A细胞以3×103个细胞接种到96孔板中,每孔100μl。细胞分为对照组(control组)、LPS组(1mg/ml)、LPS+蒲公英甾醇处理组(蒲公英甾醇质量浓度为5、10和15μg/ml),每组3个复孔。用药组相应剂量的蒲公英甾醇预处理24h后,再加入LPS,置于37℃、5% CO2条件下孵育24h。细胞培养结束后,进行后续的实验。
6.ELISA法检测:实验结束后收集各组细胞上清液,按照ELISA试剂盒说明书进行操作,用酶标仪在450nm波长依序测定各孔的吸光度(A)值,根据A值所绘制的标准曲线查出上清液中TNF-α和IL-6的表达水平。
7.EDU检测:MH7A按照1×105个/孔接种在6孔板中,按材料与方法3进行处理并置于37℃、5% CO2的细胞培养箱中孵育。实验结束后,每孔加入100μl含50μmol/L EDU溶液的RPMI1640完全培养基孵育2h。之后各组细胞在4%多聚甲醛中固定30min,将各组细胞与2mg/ml甘氨酸孵育10min。接下来,将细胞用PBS冲洗,然后使用500μl 0.5% Triton-X透化10min,然后在黑暗中与Apollo染色液孵育30min。最后,将细胞与Hoechst 33342孵育30min,并用0.5% Triton-X冲洗两次。在荧光显微镜下观察细胞并拍照。
8.Transwell迁移实验:收集各组处理48h细胞,胰酶消化后制成单细胞悬液,细胞密度为1×106个/毫升。将Transwell小室加入细胞悬液100μl,下室加入含10% FBS的完全培养基500μl。然后将Transwell小室置于37℃、5%CO2、饱和湿度的细胞培养箱中孵育8h。取出聚碳酸酯微孔膜, 用棉签轻轻擦去基底胶和上表面的细胞,然后中性甲醛固定,苏木精染色。显微镜下随机选取5个视野,计录穿膜细胞数。以穿膜细胞数代表细胞迁移能力。
9.细胞流式术:在各组细胞处理48h后,将细胞用冰PBS冲洗1次,并在加入5μl Annexin Ⅴ-FITC和10μl PI之后再用300μl结合缓冲液重悬将细胞在在避光的室温下孵育10min。进行流式细胞术以检测细胞凋亡,并使用CellQuest软件分析数据。
10.Western blot法:实验结束后,弃去细胞上清液,PBS冲洗2次。加入1ml制备好的RIPA裂解液提取蛋白,用BCA法测定总蛋白含量。用SDS-聚丙烯酰胺凝胶电泳分离蛋白,并转移到PVDF膜上。在室温下用5%脱脂奶封闭1h后,将PVDF膜与以下抗体在4℃孵育过夜:兔抗p-TLR4抗体(1∶1000)、兔抗TLR4抗体(1∶1000),兔抗p-NF-κB p65抗体(1∶1000)、兔抗NF-κB p65抗体(1∶1000)、兔抗β-actin抗体(1∶2000)。随后,将PVDF膜用TBST洗涤3次,持续5min,并与山羊抗兔IgG-HRP(1∶5000)孵育1h,用TBST洗涤3次,持续5min。最后显影曝光,用Image-Pro Plus图像分析系统对蛋白条带的灰度值进行分析。

结 果
1.蒲公英甾醇浓度的筛选:CCK-8结果表明,用不同浓度的蒲公英甾醇(0、5、10、15、20和25μg/ml)培养MH7A细胞24h时,0~15μg/ml时,MH7A细胞的细胞活力不受蒲公英甾醇处理的影响,但当蒲公英甾醇浓度在20和25μg/ml时,MH7A细胞的细胞活力受到影响(P=0.000),因此后续实验选择蒲公英甾醇的浓度为5、10和15μg/ml(图1)。

图1 不同浓度蒲公英甾醇对MH7A细胞活力的影响与Tar(0)组比较,*P=0.000
2.蒲公英甾醇对LPS诱导的MH7A细胞形态的影响:MH7A细胞经LPS诱导后,细胞增殖率增加,细胞密度增加,细胞排列紧密;与LPS组比较,不同浓度的蒲公英甾醇使MH7A细胞的增殖率降低,细胞密度减小(图2)。

图2 不同浓度蒲公英甾醇对LPS诱导的MH7A细胞形态的影响(EDU,×100)
3.蒲公英甾醇对LPS诱导的MH7A细胞炎性介质分泌的影响:ELISA法检测结果表明,与对照组比较,LPS组MH7A细胞上清中TNF-α和IL-6的含量显著增加(P均=0.000),造模成功;与LPS组比较,不同浓度的蒲公英甾醇均能使MH7A细胞上清中TNF-α和IL-6的含量降低(P<0.05,图3)。

图3 蒲公英甾醇对LPS诱导的MH7A细胞中TNF-α、IL-6分泌的影响与对照组比较,*P=0.000;与LPS组比较,#P<0.05,##P<0.01,###P=0.000
4.蒲公英甾醇对LPS诱导的MH7A细胞增殖能力的影响:EDU结果显示,与对照组比较,LPS组MH7A细胞中EDU阳性细胞数目比例显著增加(P=0.000);与LPS组比较,不同浓度的蒲公英甾醇使MH7A细胞中EDU阳性细胞数目比例减少(P均<0.05,图4)。
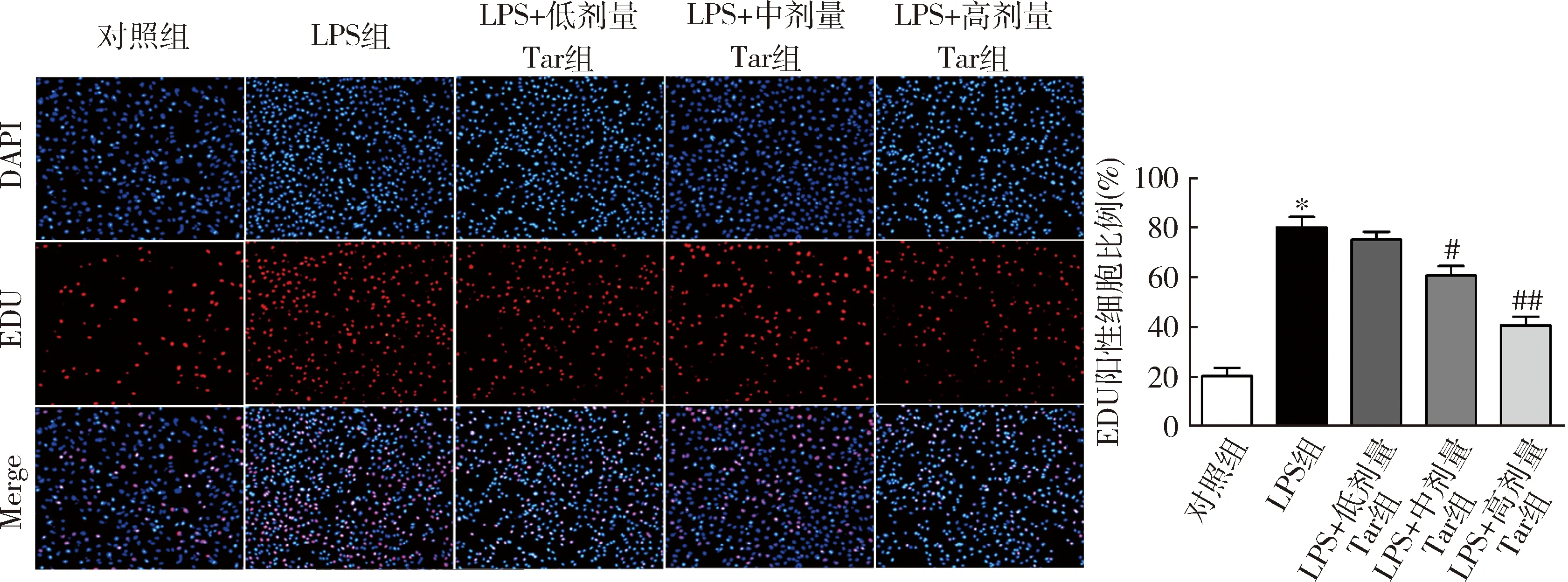
图4 蒲公英甾醇对LPS诱导的MH7A细胞增殖能力的影响(EDU,×200)与对照组比较,*P=0.000;与LPS组比较,#P<0.05,##P<0.01
5.蒲公英甾醇对LPS诱导的MH7A细胞迁移能力的影响:Transwell迁移实验结果显示,与对照组比较,LPS组MH7A细胞的迁移数目显著增加(P=0.000);与LPS组比较,不同浓度的蒲公英甾醇使MH7A细胞的迁移数目减少(P均<0.05,图5)。
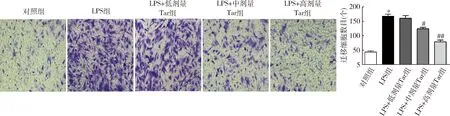
图5 蒲公英甾醇对LPS诱导的MH7A细胞迁移数目的影响(苏木精染色,×200)与对照组比较,*P=0.000;与LPS组比较,#P<0.01,##P=0.000
6.蒲公英甾醇对LPS诱导的MH7A细胞凋亡的影响:流式细胞术结果显示,与对照组比较,LPS组MH7A细胞的凋亡率显著减少(P=0.000);与LPS组比较,不同浓度的蒲公英甾醇使MH7A细胞的凋亡率增加(P均<0.05,图6)。
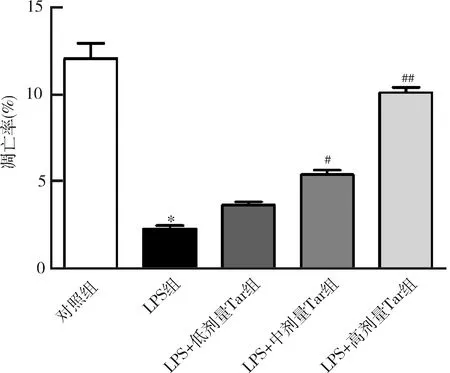
图6 蒲公英甾醇对LPS诱导的MH7A细胞凋亡的影响与对照组比较,*P=0.000;与LPS组比较,#P<0.01,##P=0.000
7.蒲公英甾醇抑制TLR4/NF-κB通路:Western blot法检测结果显示,与对照组比较,LPS组MH7A细胞中TLR4蛋白表达显著增加(P=0.000),NF-κB p65的磷酸化程度也显著增加(P=0.000);与LPS组比较,不同浓度的蒲公英甾醇使MH7A细胞中TLR4蛋白表达下降(P均<0.05),NF-κB p65的磷酸化程度也降低(P均<0.05,图7)。

图7 蒲公英甾醇抑制TLR4/NF-κB通路与对照组比较,*P=0.000;与LPS组比较,#P<0.05,##P<0.01,###P=0.000
讨 论
RA是最常见的慢性炎性关节疾病,全世界的发生率是0.5%~1.0%,其特征主要是关节滑膜炎症。反复滑膜炎可引起关节疼痛,关节强迫、僵硬和肿胀,疾病进展可导致关节软骨和骨骼的破坏,此外,它可能会逐渐引起关节畸形和功能障碍[12]。FLS是滑膜的重要组成部分,在RA的病理过程中起主要作用。RA的主要病理特征之一是FLS异常增生,表现为滑膜组织增生[13]。在RA中观察到FLS的凋亡不足和异常增殖,并且FLS的过量促进RA的各种病理过程[14]。因此,促进FLS的凋亡和抑制增殖是围绕RA治疗的当前研究的主要焦点。
本研究结果显示,人类风湿关节炎成纤维滑膜细胞MH7A细胞经LPS诱导后,细胞上清液中的炎性因子(TNF-α和IL-6)分泌增加,细胞异常增生,其增殖能力、迁移能力显著增强,凋亡率显著下降,与既往文献报道一致[15]。
Toll样受体是先天免疫系统的重要组成部分[15]。TLR4能够通过MyD88依赖性途径促进干扰素-β的表达并激活NF-κB。在缺血和缺氧等条件下,TLR4被激活,进一步提高了NF-κB的磷酸化程度并激活了TLR4/NF-κB途径,从而增加了炎性因子的含量[16]。NF-κB是炎性反应的关键转录因子,其可以在应激环境中被激活[17]。NF-κB主要通过动态核DNA /蛋白质结合发挥其生物学功能。各种炎性因子,例如TNF家族成员都是NF-κB依赖性基因。因此,抑制NF-κB可以有效地阻断炎症途径。研究发现,羟氯喹通过NF-κB信号通路抑制TNF-α诱导的MH7A细胞IL-6分泌和mRNA表达[18]。本研究发现,MH7A细胞经LPS诱导后,TLR4蛋白表达显著增加,NF-κB p65的磷酸化程度也显著增加,与既往文献报道一致[19]。
蒲公英甾醇为蒲公英的主要有效成分,具有清除自由基、消炎、防腐、抗氧化、抗肿瘤、抗动脉粥样硬化和保肝作用。蒲公英甾醇对乳腺炎具有发挥抗炎的作用[8]。本研究发现,蒲公英甾醇使LPS诱导的MH7A细胞上清中分泌的炎性因子表达量减少,细胞的增殖能力、迁移能力降低,凋亡率提高,TLR4蛋白表达下降,NF-κB p65的磷酸化程度也下降。
综上所述,蒲公英甾醇通过抑制TLR4/NF-κB信号通路抑制了RA的发生、发展,从而抑制了MH7A细胞的增殖、迁移,促进其凋亡。因此,蒲公英甾醇可能对RA的发生、发展有抑制作用,尚需开展进一步实验和临床研究予以证实。
