GITRL对肺癌移植瘤小鼠髓源性抑制细胞免疫抑制功能的调控及其分子机制
2020-12-22张蓓蓓朱秋钢芮棵王胜军田洁
张蓓蓓,朱秋钢,芮棵,王胜军,田洁
(1.江苏大学医学院,江苏 镇江 212013;2.江苏大学附属医院检验科,江苏 镇江 212001)
髓源性抑制细胞(myeloid-derived suppressor cells,MDSCs)是一群具有免疫抑制能力、未成熟的异质性髓系细胞[1]。MDSCs可分为两个亚群,多核细胞样MDSCs(PMN-MDSCs)和单核细胞样MDSCs(M-MDSCs)。在小鼠中,MDSCs两个亚群均高表达CD11b和Gr-1,Gr-1包含Ly-6G和Ly-6C两个抗原表位,PMN-MDSCs表型为CD11b+Ly-6G+Ly-6Clow,而M-MDSCs的表型则为CD11b+Ly-6G-Ly-6Chigh。研究表明,荷瘤小鼠和肿瘤患者体内存在大量MDSCs的浸润[2]。MDSCs在肿瘤免疫微环境中大量扩增,并参与肿瘤的病理过程[3]。一方面,肿瘤免疫微环境通过分泌粒细胞-巨噬细胞集落刺激因子、IL-6等细胞因子,促进MDSCs的增殖与功能;另一方面,MDSCs通过合成免疫抑制性效应分子如精氨酸酶-1(Arg-1)、活性氧和诱导型一氧化氮合酶(iNOS),抑制机体抗肿瘤免疫,从而促进肿瘤发展[4]。MDSCs的免疫抑制功能受多组信号的调控,包括JAK/STAT、PI3K/AKT等信号通路[5]。
糖皮质激素诱导的肿瘤坏死因子受体相关配体(glucocorticoid induced TNF receptor ligand,GITRL)是肿瘤坏死因子超家族成员,主要高表达于抗原提呈细胞和内皮细胞的表面,其受体GITR则高表达于活化的T细胞、B细胞和中性粒细胞[6]。在肿瘤中,GITRL可作为共刺激分子,促进效应T细胞的活化,并抑制调节性T细胞的功能,促进机体正向免疫应答,因此,GITRL可有效增强机体抗瘤免疫应答[7-8]。GITRL是否通过调控MDSCs的免疫抑制功能进而增强机体抗瘤免疫应答尚需进一步研究。本研究利用GITRL蛋白刺激Lewis肺癌移植瘤小鼠来源的MDSCs,检测GITRL处理后的MDSCs对野生型小鼠来源的CD4+T细胞增殖的影响以及胞内相关免疫抑制效应分子的表达,观察GITRL对肿瘤来源的MDSCs免疫抑制功能的调控作用,并探究其分子机制。
1 材料与方法
1.1 材料
8~10周龄SPF 级雄性C57BL/6小鼠,质量(24±2)g,购于江苏大学动物中心(合格证编号:NO.201905095)。小鼠Lewis肺癌细胞株购于上海生命科学研究院细胞库。
DMEM,1640培养液,小牛血清,胎牛血清(以色列BI公司);抗生物素磁珠,小鼠CD4+T细胞分选试剂盒(德国美天旎公司);生物素标记的抗小鼠CD11b抗体,PE/Cy5标记的大鼠抗小鼠CD11b抗体,PE标记的大鼠抗小鼠Gr-1抗体,FITC标记的大鼠抗小鼠GITR抗体,PE/Cy5标记的大鼠抗小鼠CD4抗体(美国BioLegend公司);哺乳动物蛋白提取液(北京康为世纪生物科技有限公司);精氨酸酶检测试剂盒(美国BioAssay systems公司);一氧化氮检测试剂盒(美国Promega公司);SDS-PAGE凝胶配制试剂盒(上海碧云天生物技术有限公司);兔抗小鼠p-JAK2、JAK2、p-STAT3、STAT3、β-肌动蛋白抗体,HRP标记的羊抗兔IgG抗体(美国Cell Signaling Technology公司)。
1.2 构建小鼠Lewis肺癌移植瘤模型
培养Lewis肺癌细胞至对数生长期,将细胞从培养瓶中消化下来,并重悬于磷酸盐缓冲液(PBS)中,细胞浓度为1×107/mL。于C57BL/6小鼠右侧背部皮下注射0.1 mL Lewis肺癌细胞悬液,即每只小鼠注射1×106Lewis肺癌细胞。
1.3 磁珠分选MDSCs
处死Lewis肺癌移植瘤小鼠,取脾脏研磨成细胞悬液,裂解红细胞后,加入生物素标记的抗小鼠CD11b抗体(10 μL/108细胞),弹匀后置于冰上孵育30 min;洗去多余抗体,加入抗生物素磁珠(12 μL/108细胞),置于冰上孵育30 min;洗去多余抗体,将细胞重悬于500 μL PBS-EDTA缓冲液中,将其加入分选柱中,再加入PBS-EDTA,待分选柱中的液体流尽后,向柱中加入5 mL PBS-EDTA,用推柱将液体从柱中用力推出,收集细胞。
1.4 流式细胞术检测MDSCs的纯度及表面GITR的表达
取1×106个MDSCs,重悬于100 μL PBS,加入PE/Cy5标记的大鼠抗小鼠CD11b抗体、PE标记的大鼠抗小鼠Gr-1抗体和FITC标记的大鼠抗小鼠GITR抗体(或同型对照抗体),于4℃孵育30 min。加入PBS洗涤,4℃、500 ×g离心5 min,用流式细胞仪检测细胞表面Gr-1、CD11b、GITR的表达。
1.5 磁珠分选CD4+ T细胞
取野生型C57BL/6小鼠脾脏,研磨成细胞悬液,裂解红细胞后,加入抗小鼠CD4磁珠(10 μL/108细胞),弹匀后置于冰上孵育30 min;PBS-EDTA洗去多余抗体,将细胞重悬于500 μL PBS-EDTA中,将其加入分选柱中,再加入PBS-EDTA,待分选柱中的液体流尽后,向柱中加入5 mL PBS-EDTA,用推柱将液体从柱中用力推出,收集细胞。
1.6 MDSCs对CD4+ T细胞增殖的抑制试验
取96孔U形底培养板,向孔中加入50 μL碳酸盐包被液和0.5 μL抗小鼠CD3单克隆抗体(1 μg/μL),4℃孵育过夜,洗去游离的抗体。将CD4+T细胞重悬于1 mL PBS中,加入羧基荧光素二醋酸盐琥珀酰亚胺酯(CFSE)染料,终浓度为5 μmol/mL,于37℃水浴锅中避光孵育10 min。立即向试管中加入5 mL预冷的1640培养液(含10% 胎牛血清)终止反应。用1640培养液(含10% 胎牛血清)洗涤3次。收集GITRL(5 μg/mL)处理48 h后的MDSCs,将MDSCs和CD4+T细胞按1 ∶1的比例种入96孔培养板中,每孔共5×105个细胞。阳性对照孔中加入5×105个CD4+T细胞。每孔加入0.5 μL抗小鼠CD28单克隆抗体(1 μg/μL),将培养板置于培养箱中,避光孵育72 h。收集细胞,加入PE/Cy5标记的大鼠抗小鼠CD4抗体,于4℃孵育30 min。加入PBS洗涤,4℃、500×g离心5 min,用流式细胞仪检测CD4+T细胞的增殖情况。
1.7 比色法检测MDSCs胞内Arg-1的活性
收集GITRL(5 μg/mL)处理48 h后的MDSCs,加入哺乳动物蛋白提取液提取蛋白。配置底物缓冲液、标准品、显色液,分别将标准品和待测样本加入检测孔中,并设置空白对照孔,每孔加入10 μL底物缓冲液,将检测板放入水浴锅中,37℃避光孵育2 h。每孔加入200 μL显色液,室温避光孵育10 min。用酶标仪读取520 nm波长处的光密度值,计算酶活性。
1.8 Griess偶联法检测MDSCs一氧化氮释放量
GITRL(5 μg/mL)处理MDSCs 48 h后,收集培养上清液。将标准品和待测上清液分别加入检测孔中,每孔50 μL,再加入50 μL对氨基苯磺酰胺缓冲液,室温避光孵育5 min,加入50 μL显色液,室温避光孵育5 min。用酶标仪读取520 nm波长处的光密度值,计算待测样本一氧化氮的含量。
1.9 蛋白质印迹法检测MDSCs胞内信号分子
将MDSCs接种于24孔培养板中,使每孔1×106个细胞,加入5 μg/mL GITRL蛋白,分别于0、30、60 min后收集细胞,加入哺乳动物蛋白提取液提取蛋白。配制10% SDS-PAGE凝胶,加入适量蛋白样本进行电泳,以350 mA恒流转膜1.5 h,将转有蛋白的PVDF膜置于5%牛血清白蛋白中室温封闭1 h。分别加入兔抗小鼠p-JAK2、JAK2、p-STAT3、STAT3(1 ∶1 000)和β-肌动蛋白抗体(1 ∶5 000),4℃孵育过夜。TBST缓冲液洗涤后,加入HRP标记的羊抗兔IgG抗体(1 ∶5 000)室温孵育1 h,TBST缓冲液洗涤后曝光。
1.10 统计学分析

2 结果
2.1 Lewis荷瘤小鼠脾脏MDSCs表达GITR
通过流式细胞术检测MDSCs的纯度,磁珠分选后CD11b+Gr-1+细胞达90%以上,可用于后续实验研究。流式细胞术检测结果显示荷瘤小鼠来源的MDSCs表面表达GITR。见图1。结果说明Lewis荷瘤小鼠脾脏浸润的MDSCs表达GITR。
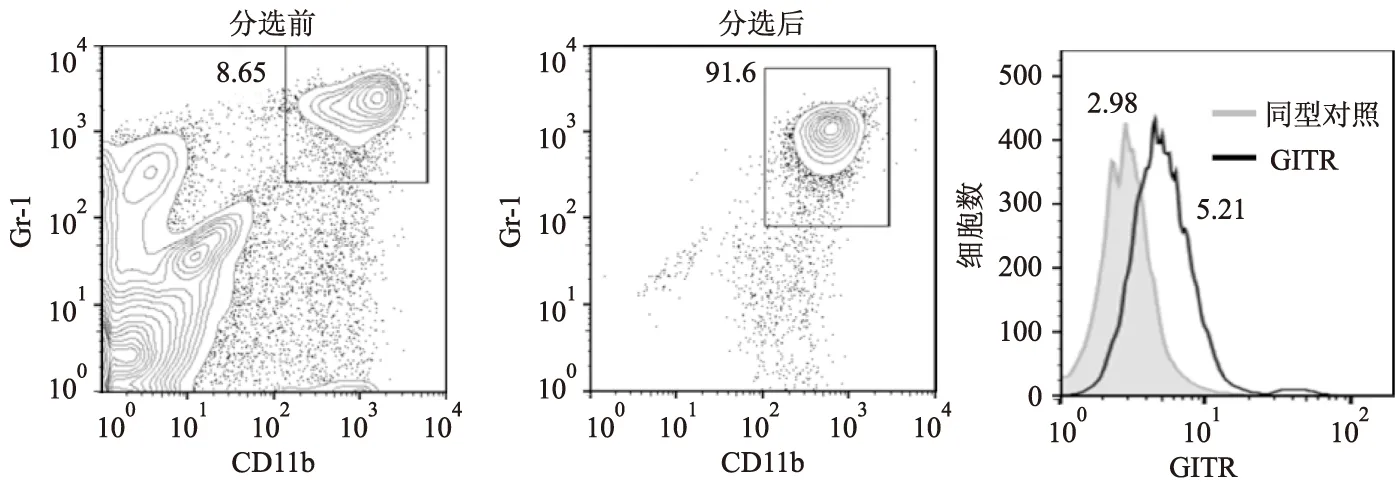
图1 荷瘤小鼠脾脏MDSCs分选纯度及表面GITR的表达
2.2 GITRL抑制荷瘤小鼠脾脏MDSCs的免疫抑制功能
GITRL蛋白(5 μg/mL)刺激MDSCs 48 h后,与CD4+T细胞共培养72 h。流式细胞术结果显示,与对照组相比,GITRL处理组的MDSCs对CD4+T细胞增殖的抑制能力明显减弱。此外,GITRL处理组MDSCs的Arg-1活性明显降低(t=4.208,P<0.05),一氧化氮释放量明显减少(t=5.355,P<0.01)。见图2。结果说明GITRL可抑制荷瘤小鼠脾脏MDSCs的免疫抑制功能。

图2 GITRL对荷瘤小鼠脾脏MDSCs免疫抑制功能的影响
2.3 GITRL调控MDSCs胞内信号分子的表达
蛋白质印迹结果显示,GITRL处理30 min后,MDSCs胞内JAK2(t=4.056,P<0.05)和STAT3(t=5.452,P<0.01)的磷酸化蛋白水平显著下降。GITRL处理60 min后,与0 min相比,MDSCs胞内JAK2(t=7.376,P<0.01)和STAT3(t=13.340,P<0.01)的磷酸化蛋白水平显著下降;与30 min相比,MDSCs胞内JAK2(t=3.539,P<0.05)和STAT3(t=4.169,P<0.05)的磷酸化蛋白水平显著下降。见图3。结果说明GITRL可下调MDSCs胞内JAK2和STAT3的活性。

图3 GITRL对MDSCs胞内信号分子的调控
3 讨论
研究表明,GITR/GITRL信号系统参与多种疾病的发生与发展过程,包括肿瘤、感染、炎症和自身免疫病[9]。在肿瘤微环境中,T细胞表面GITR的表达明显升高,GITR信号的触发除了能激活效应T细胞,抑制调节性T细胞的功能,还能促进辅助性T细胞的分化[10-11],促进树突状细胞的抗原提呈功能[12],参与巨噬细胞的活化过程[13],从而增强机体免疫应答。利用抗GITR单克隆抗体DTA-1可通过激活免疫系统增强机体抗肿瘤免疫反应,有效治疗肿瘤[14]。DTA-1通过促进效应T细胞的免疫应答,同时抑制调节性T细胞的免疫抑制功能,发挥治疗肿瘤的作用。有研究报道,DTA-1对IFN-γ基因缺陷的荷瘤小鼠无治疗作用[15]。此外,当小鼠体内的CD8+T细胞被清除时,DTA-1对荷瘤小鼠的治疗作用消失[16]。以上结果表明,DTA-1主要通过触发CD8+T细胞表面的GITR信号,增强抗肿瘤免疫。
MDSCs通过抑制宿主免疫反应影响肿瘤局部微环境。MDSCs作为肿瘤微环境中重要的免疫抑制性细胞,能有效对抗机体的抗肿瘤免疫反应,并削弱临床抗肿瘤治疗的效果[17]。研究表明,肿瘤局部浸润的MDSCs数量与疾病严重程度呈正相关,且抑制MDSCs的功能或直接清除体内MDSCs可有效抑制肿瘤的疾病进展[18]。因此,MDSCs是抗肿瘤免疫治疗的重要靶点。目前,临床上针对MDSCs的疗法主要包括抑制MDSCs的分化、迁移、扩增和免疫抑制功能,如通过吉西他滨、5-氟尿嘧啶耗竭体内的MDSCs,或通过小分子抑制剂和免疫检查点阻断剂阻断MDSCs发育所需的信号,以达到治疗肿瘤的目的[19]。本研究表明肿瘤微环境中的MDSCs表达GITR,且利用GITRL处理MDSCs可显著下调其免疫抑制功能,具体表现为MDSCs对野生型小鼠来源的CD4+T细胞增殖的抑制能力下降,相关免疫抑制效应分子Arg-1和一氧化氮表达降低,提示GITRL可通过激活MDSCs表面的GITR,抑制MDSCs的免疫抑制功能,从而增强抗肿瘤免疫应答。
JAK/STAT是调控MDSCs的免疫抑制功能的关键信号通路。研究表明,在肝脏转移性肿瘤模型中,粒细胞-巨噬细胞集落刺激因子通过激活MDSCs胞内JAK2/STAT3信号通路促进MDSCs的免疫抑制功能,且阻断JAK2/STAT3信号通路可增强抗肿瘤免疫治疗效果。因此,JAK2/STAT3信号通路可调控MDSCs免疫抑制功能[20]。在本研究中,我们发现GITRL通过激活MDSCs表面的GITR,抑制胞内JAK2/STAT3信号通路。
综上,荷瘤小鼠来源的MDSCs表面表达GITR,GITRL处理可抑制MDSCs胞内与其功能相关的JAK2/STAT3信号通路。因此,GITRL可能通过抑制MDSCs胞内JAK2/STAT3信号通路下调肿瘤微环境中MDSCs的免疫抑制功能。本研究进一步阐释了GITRL抗瘤免疫机制,为临床肿瘤的治疗提供了新的思路和理论基础。
