加速康复外科围术期营养管理对胃切除术后肠黏膜屏障的影响
2020-12-22吕季阳李红韩贺冯乐陈吉祥
吕季阳,李红,韩贺,冯乐,陈吉祥
(1.江苏大学附属医院普外科,江苏 镇江 212001;2.江苏大学医学院,江苏 镇江 212013)
加速康复外科(enhanced recovery after surgery,ERAS) 理念由丹麦Kehlet教授于1997年提出[1],最早应用于结直肠手术中。随后,ERAS理念逐步拓展应用于普外科的几乎所有脏器手术,而关于胃切除术的ERAS研究起步稍晚。目前已有的研究多以说明ERAS理念应用于胃切除术安全、有效,可促进肠蠕动,有利于术后肠功能恢复且并不增加术后并发症等[2-3],而有关胃切除术对肠屏障结构的影响尚不清楚。本文通过检测全胃切除术实施ERAS营养管理患者的肠屏障功能,再制作大鼠胃切除模型并按ERAS营养管理要求进行营养管理,观察其肠黏膜屏障的形态学结构变化,以期探讨ERAS围术期营养管理对胃切除术肠屏障结构和功能的影响。
1 资料和方法
1.1 临床资料
1.1.1 研究对象 选择2017年9月至2019年10月江苏大学附属医院普外科收治的42例胃癌患者,均行腹腔镜全胃切除术,随机分成两组:ERAS组(按ERAS理念进行围术期营养管理)22例,47~69岁;传统组(按传统理念进行围术期营养管理)20例,39~70岁。入选标准:年龄≤70岁;术前未接受过化疗;均接受择期D2手术治疗;患者接受并签订知情同意书。排除标准:姑息、急诊手术;需要联合切除脾或胰腺的患者;胃肠梗阻者;有心功能不全、肝硬化、胆囊炎、胆结石和糖尿病病史。本研究经江苏大学附属医院医学伦理委员会审批,审批号2016-035。
两组患者年龄、性别、肿瘤大小、位置及TNM分期比较,差异无统计学意义(P>0.05),具有可比性。见表1。
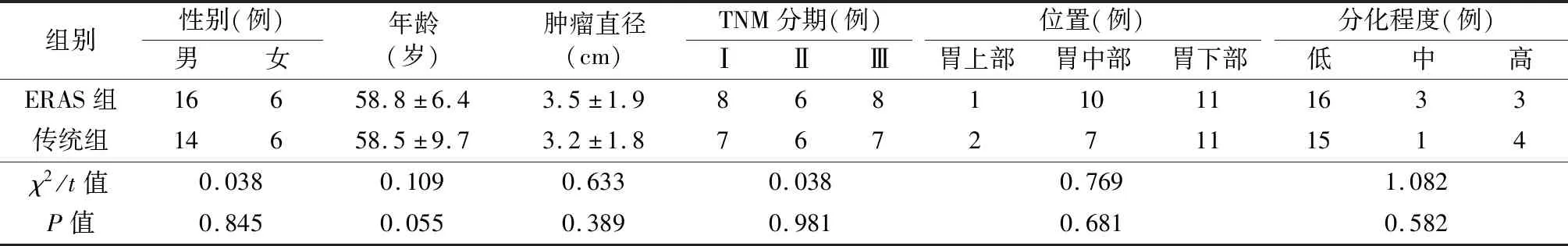
表1 两组患者临床资料比较
1.1.2 主要药品、试剂和仪器 肠内营养液,纽迪希亚制药有限公司(无锡);肠外营养液(1 440 mL,1 000 kcal),华瑞制药有限公司(无锡);麦芽糊精果糖饮品,商品名素乾,江苏正大丰海制药有限公司(连云港)。人二胺氧化酶(diamine oxidase,DAO)、人D-乳酸及人肠脂肪酸结合蛋白(IFABP)ELISA试剂盒为博智科生物(苏州)产品。微量输液泵ZD-50F6(苏州泽德医疗器械有限公司);全波长酶标分析仪Multiskan GO(上海巴玖实业有限公司);透射电子显微镜(型号JEM-1400 PLUS)为日本电子株式会社(东京)产品。
1.1.3 围术期营养管理 ERAS组按文献[4]进行营养管理。术前未常规进行肠道准备;术前12 h禁食,术前6 h及2 h分别口服素乾400 mL和200 mL。术后麻醉清醒后即可饮水(饮水量小于25 mL/h)。术后12 h从鼻肠管滴注5%葡萄糖氯化钠注射液,20~40 mL/h,24 h后如肠道能适应,给予鼻肠管注入肠内营养液,开始20 mL/h逐日增至80~100 mL/h,维持7 d过渡至正常饮食。热量开始500~600 kcal/d,逐渐增加至30 kcal/(kg·d)。术后前几天由肠内营养供给的热量和液体量不足,可由静脉补充10%葡萄糖和复方氨基酸溶液,直至全胃肠内营养。总液体量2 300~2 500 mL。传统组按传统围术期管理理念进行处理。术前一天晚间灌肠,术前12 h禁食禁饮。术后禁食禁饮,术后第1天行静脉营养,输入肠外营养液,静脉供给热量30 kcal/(kg·d),总液体量2 300~2 800 mL,术后7 d过渡至正常饮食。
1.1.4 样本采集 患者于术前、术后1、3、5 d取空腹肘静脉血4 mL于EDTA抗凝管;2 h内离心,3 000 r/min离心10 min,取血浆分装,-70 ℃保存。
1.2 动物分组和胃切除模型制备
1.2.1 实验动物 健康成年雄性清洁级SD大鼠,体重250~300 g,由江苏大学实验动物中心提供,动物许可证号为SCXK(苏)2019—0021,于普通实验室适应性饲养1周,自由进食饮水。
1.2.2 动物分组 50只大鼠随机分为3组。ERAS组:大鼠全胃切除+肠内营养,20只;传统组:大鼠全胃切除+肠外营养,20只;对照组:10只,常规饲养,自由进食饮水。
1.2.3 胃切除模型制备 ERAS组:腹腔注射氯胺酮(10 mg/100 g)后,腹部正中切口逐层进腹腔,取下胃组织,吻合食管和十二指肠断端。在空肠壁(距十二指肠悬韧带15 cm处),用丝线作环状荷包缝合,置入采血针塑料导管(用作肠内营养管),插入空肠内约2 cm,缝合固定。在距腹部切口外侧0.5 cm的腹肌处剪一小洞,导管另一端由此出腹腔,并由此钝性分离皮肤与皮下组织成一条通道至颈背部,切一小口,导管经通道从颈背部引出。腹肌及皮下组织单纯连续缝合,皮肤单纯间断缝合关闭腹腔。作为假手术损伤,于颈部正中切口,分离大鼠右侧颈内静脉约0.5 cm,将颈内静脉结扎,分层缝合颈部切口。将术后大鼠安置于鼠笼,并连接塑料管与微量注射泵。
传统组:行全胃切术后,缝合食管和十二指肠断端。作为假手术损伤,在空肠壁(位置同ERAS组)作一小切口,丝线缝合,同时缝合腹部切口。再作颈前区切口,分离右侧颈内静脉约1 cm,结扎远心端,在近心端置入充满肝素液的静脉留置针(22 G)至上腔静脉,用丝线将置管固定并由颈部切口引出,缝合切口。将术后大鼠置于笼内,将静脉管连接微量输液。
1.2.4 营养供给方案 两组大鼠均于术前12 h禁食,ERAS组于术前6 h供给素乾3 mL。两组均于术后6 h供给营养,热能按每天30 kcal/kg计算。ERAS组每天注入肠内营养液量(mL)=30 kcal·kg-1×体重(kg)/(1 kcal·mL-1),传统组每天注入肠外营养液量(mL)=30 kcal/kg×体重(kg)/(0.69 kcal·mL-1)。每天液体供给量30 mL,不足部分加注射用水补充,以微量注射泵匀速于24 h内输入。其间大鼠禁食不禁饮。为防止营养管堵塞,肠内营养管坚持每天用0.9% NaCl溶液冲洗,肠外营养管每12 h予肝素生理盐水冲洗。
1.2.5 标本采集 两组于术后24 h、72 h分两批处理并取肠组织,每批10只。对照组10只,于常规饲养1周后腹腔注射氯胺酮(10 mg/100 g)麻醉,打开腹腔,于距离回盲部5 cm处切取回肠肠管约2 cm,用0.9% NaCl注射液冲洗,取一段放入甲醛固定液,用于光镜病理切片;另一段用刀片在黏膜侧切取约1 mm3组织3块,放入2.5%中性戊二醛中固定,用于电镜切片。另两组肠组织采集同对照组。
1.3 检测项目及方法
1.3.1 ELISA法测定患者血浆DAO、D-乳酸及IFABP 操作步骤按试剂说明书进行,先测定不同浓度标准品的光密度(D)值,绘制浓度—光密度标准曲线,再测定样品光密度并根据标准曲线换算成相应的浓度。若样品浓度超过标准曲线范围则将样品成倍稀释。
1.3.2 肠黏膜病理切片制作及观察 从固定液中取出肠组织,梯度乙醇脱水、二甲苯透明、浸蜡、包埋、切片机切片,再行HE染色。光镜下每个切片先低倍镜后高倍镜分别观察,以病变最严重者作该组织的病理评分。
肠黏膜病理以Chiu氏评分[5]评估:5 分,固有膜结构消失并有明显组织出血及溃疡;4 分,固有膜和绒毛组织脱落,伴随固有膜细胞结构模糊;3 分,肠黏膜与黏膜下层分离,绒毛呈现倾倒、部分绒毛顶端脱落;2 分,肠上皮层与固有层分离;1分,绒毛处肠黏膜上皮下间隙增大;0分,正常小肠黏膜绒毛组织形态学结构。
1.3.3 肠组织电镜制片及观察 从电镜固定液中取出肠组织,漂洗后置于1% 锇酸固定液1.5~2 h;漂洗3次,每次10 min;经30%、50%、70%、90%及100%乙醇逐级梯度脱水;纯树脂进行树脂渗透,每级3~4 h;用包埋模具、Epon 812纯树脂包埋;在电热鼓风干燥箱中加热聚合固化;超薄切片机切片;双蒸水冲洗、干燥;电镜观察、采集图像。
1.4 数据处理与分析
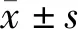
2 结果
2.1 患者血浆DAO、D-乳酸及IFABP水平比较
ERAS组和传统组术后1 d血浆DAO、D-乳酸及IFABP水平显著高于术前(P均<0.01)。与传统组相比,ERAS组术后1、3、5 d DAO水平,术后3、5 d D-乳酸水平,术后1、3 d血浆IFABP水平均明显降低(P<0.01或0.05)。ERAS组术后1 d血浆DAO升高,至术后5 d仍高于术前(P<0.05或0.01);术后5 d D-乳酸与术前比较无统计学差异(P>0.05),传统组仍明显高于术前(P<0.05);血浆IFABP水平,ERAS组术后3 d与术前比较无统计学意义(P>0.05),传统组术后3 d仍明显高于术前(P<0.05)。见图1。
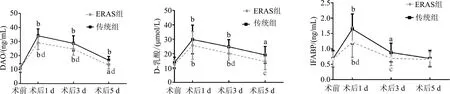
a:P<0.05,b:P<0.01,与同组术前比较;c:P<0.05,d:P<0.01,与同时间点传统组比较图1 两组患者血浆DAO、D-乳酸和IFABP水平比较
2.2 大鼠肠黏膜病理变化
由图2可见,术后两组大鼠肠黏膜损伤程度不同。传统组术后24 h显示绒毛倾倒、脱落,术后72 h绒毛部分修复,但肠黏膜上皮细胞下间隙增大;ERAS组术后24 h显示肠系膜上皮细胞层与固有层分离,术后72 h绒毛组织结构已完整,但淋巴细胞浸润增多。对照组的肠黏膜绒毛组织结构正常。
对照组肠黏膜病理评分为0分。ERAS组术后24 h及72 h肠黏膜病理评分均明显低于传统组(P<0.05)。见表2。
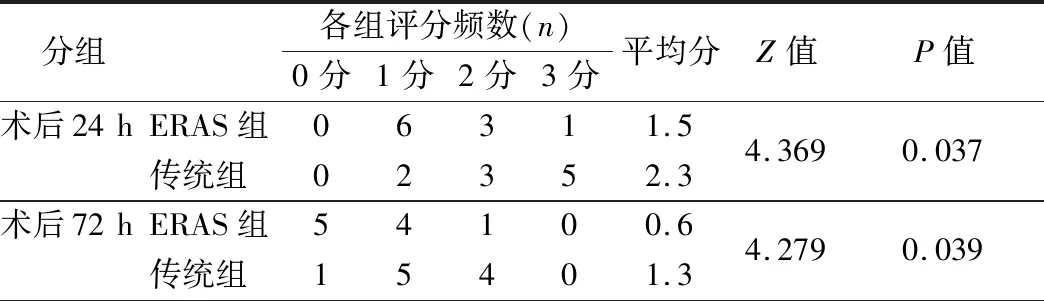
表2 两组大鼠回肠黏膜病理评分
2.3 大鼠肠黏膜上皮细胞超微结构变化
超微结构显示,两组大鼠肠上皮细胞以及紧密连接破坏程度不同。传统组术后24 h上皮细胞坏死,微绒毛脱落;72 h微绒毛部分恢复,但微绒毛很短,紧密连接仍消失。ERAS组术后24 h上皮细胞大体结构及细胞器清晰,只微绒毛部分脱落和上皮细胞间连接线模糊;术后72 h微绒毛稍短,已可见部分紧密连接。对照组细胞间界线清晰,细胞微绒毛细长、排列整齐,紧密连接完整,细胞间连接复合体结构清晰。见图3。
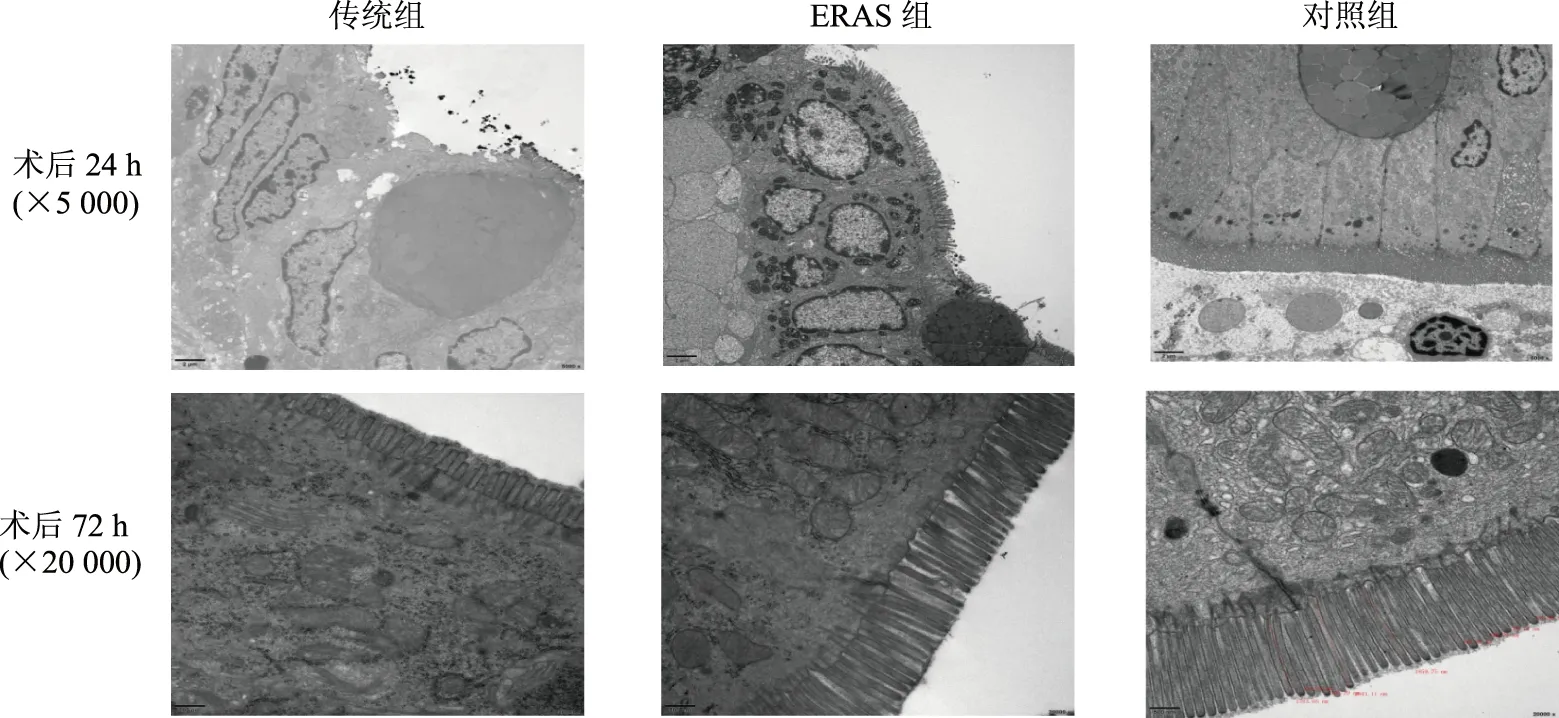
图3 各组大鼠肠上皮细胞超微结构
3 讨论
临床上多种因素可导致肠黏膜屏障不同程度损伤,腹部大手术患者更有不同程度的肠屏障受损[6]。DAO主要存在于肠黏膜绒毛上皮细胞中,是一种胞内酶[7],IFABP亦主要存在于肠上皮细胞,多位于细胞胞质,二者都能较好地反映肠上皮细胞损伤[8]。
在哺乳动物中,D-乳酸是肠道许多细菌的代谢产物,且在体内不能再被降解、代谢,当肠黏膜屏障受损时,D-乳酸则以最终产物进入血液,检测其外周血水平亦可反映肠黏膜屏障受损程度[9]。有研究比较腹腔镜与开腹胃癌手术患者术前1 d及术后第1、3、7 d的血浆DAO和L-乳酸水平,结果显示上述各时间点二者水平均无差异,因此腹腔镜胃切除手术亦可造成肠屏障功能损伤[10]。本研究病例均采用腹腔镜行胃切除术,结果显示,ERAS组和传统组术后1 d血浆DAO、D-乳酸及IFABP水平均显著高于术前,提示胃切除术可损害肠屏障功能。近年来,研究认为在反映肠黏膜细胞破坏的指标中,IFABP特异性和敏感性高,因其半衰期短,在血液中的峰值时间较短,是反映肠屏障功能障碍的早期指标,更具临床应用价值[11]。本研究亦发现术后1 d血浆IFABP水平明显增高,其后下降速度较DAO和D-乳酸快,ERAS组在术后3 d已接近正常,因此IFABP易早期检测。
肠黏膜的组织学结构是肠屏障的结构基础,主要包括肠上皮细胞、上皮细胞间的紧密连接、黏膜固有层等,其中上皮细胞间的紧密连接对肠屏障功能影响最大,它可以封闭细胞之间的间隙,防止肠道中的共生微生物和致病微生物的侵袭[12]。本研究ERAS组及传统组胃切除术后肠黏膜均有不同程度损伤,表现为肠黏膜上皮细胞下间隙增大、上皮细胞层与固有层分离,严重者有绒毛破坏、脱落;超微结构显示肠上皮细胞可发生变性、坏死,肠上皮细胞间紧密连接完整性受损。
ERAS的主要目的是尽快实现术后机体生理状态和全身多器官功能包括肠道功能康复。2014年欧洲制定首个《胃切除术加速康复外科指南》[13],该指南有关ERAS围术期营养管理的要素亦提倡术前口服碳水化合物及术后早期肠内营养。有研究将术前口服碳水化合物大鼠与术前单纯饮水大鼠作比较,前者在缺血再灌注情况下肝、肾和肠系膜淋巴结中细菌含量降低[14];胃切除术后第1天进食有助于促进术后肠蠕动、动力恢复,且不增加术后并发症和病死率[15]。上述研究结果表明,术前碳水化合物及术后早期肠内营养对肠功能恢复有益。本研究中ERAS组按围术期营养管理要求,术前6 h和术前2 h口服碳水化合物,术后早期肠内营养,结果显示ERAS组血浆DAO水平术后1、3和5 d均低于传统组,血浆D-乳酸水平术后3 d和5 d低于传统组,血浆IFABP水平术后1 d和3 d低于传统组,提示ERAS围术期营养管理有利于肠道功能快速康复。
此外,本研究显示ERAS组术后24 h肠黏膜病理评分明显低于传统组,上皮细胞超微结构及紧密连接破坏程度较轻;术后72 h两组肠黏膜超微结构均有改善,且ERAS组病理评分亦明显低于传统组,上皮细胞超微结构及紧密连接改善亦较明显,说明ERAS组肠黏膜损伤恢复更快,提示ERAS围术期营养管理有利于减轻肠黏膜病理及上皮细胞紧密连接的损伤并促进其修复。早期肠内营养能直接为肠道黏膜提供营养物质、刺激肠蠕动增加、尽快恢复肠黏膜血流、减少肠道原籍菌移位、刺激肠腺分泌,因而能减轻肠黏膜应激损伤并能促进肠黏膜增生和修复[16]。
综上所述,ERAS围术期营养管理能减轻肠道黏膜物理屏障损伤,有利于肠道屏障结构和功能的尽早恢复。
