张力蛋白1抑制非小细胞肺癌细胞增殖和侵袭
2020-12-22任琎曹一鑫王德强庄秀芬李小琴
任琎,曹一鑫,王德强,庄秀芬,李小琴
(江苏大学附属医院肿瘤内科,江苏 镇江 212001)
非小细胞肺癌(non-small cell lung cancer,NSCLC)是最主要的肺癌类型,复发率高,预后差[1-2]。抑癌基因的缺失与肺癌细胞的增殖、转移密切相关[3-4]。张力蛋白(tensin,TNS)家族是一种多结构域蛋白,可与细胞膜交互作用,是联系细胞外基质、肌动蛋白骨架的重要成分,亦可结合酪氨酸激酶受体,影响细胞信号转导,在细胞黏附、运动、生长等细胞生物学活动中发挥着重要的作用[5]。TNS1是一种定位于胞质灶性黏附区域的磷酸蛋白[6]。已有研究报道,TNS1与乳腺癌、胃癌转移有关,并显著影响乳腺癌、胃癌患者的预后[7-8]。然而,TNS1在NSCLC发病过程中是否发挥作用目前并不清楚。本研究通过比较TNS1在NSCLC组织和细胞中的表达,分析其与NSCLC患者临床病理特征及预后的关系;探讨外源性上调TNS1表达对NSCLC细胞生物学功能的影响。
1 材料与方法
1.1 材料
1.1.1 病例 收集2010年1月至2015年12月于江苏大学附属医院胸外科行部分肺叶切除的56例NSCLC患者肺癌组织及癌旁组织(距离肿瘤边缘>5 cm)。其中,男35例,女21例。年龄18~78岁,所有患者术前均未行放疗、化疗,所有标本均经过病理证实。其中,鳞癌23例,腺癌33例。本研究通过江苏大学附属医院伦理学委员会批准,患者均知情同意。
1.1.2 试剂及仪器 人正常支气管上皮16HBE、人肺腺癌A549和H1299细胞均购自中国科学院上海细胞生物研究所;RPMI 1640培养基、DMEM、小牛血清(美国Hyclone公司);MTT(美国Sigma公司);过表达TNS1的质粒(pcDNA3.1/TNS1)及相应的空载质粒(pcDNA3.1)购自上海英骏生物技术有限公司;脂质体Lipofectamine 2000转染试剂(美国Invitrogen公司);荧光实时定量PCR(qRT-PCR)试剂盒(日本TaKaRa公司);羊抗人TNS1单抗(美国Abcam公司);兔抗人E-钙黏蛋白、波形蛋白单抗(美国BD Biosciences公司);羊抗兔HRP耦联二抗(美国Santa Cruz公司)。
1.2 方法
1.2.1 A549和H1299肺癌细胞培养、分组与转染 在37 ℃、5% CO2条件下,将A549和H1299细胞置于含10%小牛血清的1640培养液中培养;16HBE细胞置于含10%小牛血清的DMEM中培养。取对数生长期A549和H1299细胞,并于转染前24 h 接种至6孔板(3×105个/孔),待细胞生长融合度达70%~80%时进行转染。依照转染说明书,将4 μg过表达质粒转染入A549和H1299细胞中(分别命名为A549/pcDNA3.1/TNS1和H1299/pcDNA3.1/TNS1),另转染空载质粒pcDNA3.1作为阴性对照组(分别命名为A549/pcDNA3.1和H1299/pcDNA3.1),用于后续相关实验检测。
1.2.2 qRT-PCR检测TNS1mRNA表达 通过Tri-zol提取组织和细胞总RNA,行反转录获得cDNA,然后对产物进行扩增。GAPDH引物序列上游:5′-GCAAATTCCATGGCACGTC-3′,下游:5′-TCGCCCCACTTGATTTTGG-3′;TNS1引物序列上游:5′-GTGCAAAGGGGACTGAATTCG-3′,下游:5′-GGCTACAAGACTCTCCAAGTGG-3′[9]。PCR 反应条件:90 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环。以GAPDH作为内参,采用2-ΔΔCt法计算TNS1mRNA相对表达量。根据NSCLC组织中TNS1mRNA相对表达量的中位数,将NSCLC 患者分为TNS1低表达组(≤中位数)和高表达组(>中位数)。
1.2.3 MTT比色法实验检测细胞抑制率 取“1.2.1”转染后各组细胞,接种于96孔板,每孔2×103个,每组6个复孔,置于37 ℃、5% CO2培养箱培养72 h;每孔加MTT 10 μL,37 ℃孵育4 h;弃上清液,加DMSO 150 μL/孔,振荡溶解10 min;待紫色结晶完全溶解后,于酶标仪490 nm处检测各孔光密度(D)值,计算细胞抑制率。细胞抑制率(%)=(1-实验组D值/对照组D值)×100%。
1.2.4 细胞集落形成实验检测细胞增殖能力 取“1.2.1”细胞,按1×103个/孔接种于6孔板中,置于37 ℃、5%CO2细胞培养箱中孵育10~14 d;纯甲醇固定10 min;加入0.1%结晶紫染液,室温染色10~15 min;孔板洗净并干燥后,肉眼计数克隆数。
1.2.5 细胞划痕实验检测细胞迁移能力 取“1.2.1”转染后细胞,接种于6孔板,每孔5×105个细胞,于37 ℃、5% CO2条件下培养过夜;待细胞融合度为80%~90%时,弃培养基并用灭菌的200 μL加样枪头在单层细胞上中间纵向垂直划痕;用PBS轻柔清洗细胞3次,去除划下的细胞;每孔加入含10 %胎牛血清的1640培养液2 mL;分别于0、24和48 h在高倍镜下(100×)随机取6个视野划痕处拍照。迁移率=(迁移前两线间的长度-迁移后两线间的长度)/迁移前两线间的长度×100%。
1.2.6 Transwell实验检测细胞的侵袭能力 取“1.2.1”转染后细胞,以无血清1640培养液重悬,Transwell培养板上室内加入300 μL细胞悬液(5×104个),下室加入1 mL含10%胎牛血清的1640培养液;培养48 h后取出小室,用湿棉签擦去内部基底膜上表面的细胞,预冷甲醇固定30 min,苏木精染色1 min,在高倍镜下(400×)随机取6个视野计数,取平均数。
1.2.7 蛋白质印迹法检测细胞TNS1、E-钙黏蛋白和波形蛋白表达 用全蛋白裂解液提取待测细胞总蛋白,冰浴30 min,离心后取上清液,BCA法行蛋白定量;分别取50 μg样品行SDS-PAGE,60 mA电泳4 h;电压80 V将蛋白转移至PVDF膜;5%脱脂奶粉室温封闭1 h;加入相应一抗TNS1 (1 ∶100)、E-钙黏蛋白(1 ∶250)、波形蛋白(1 ∶200)、GAPDH(1 ∶1 000,内参),4 ℃孵育过夜;TBST漂洗4次,每次10 min;加入相应二抗(1 ∶3 000)室温孵育2 h;ECL敏感发光试剂(美国Invitrogen公司),曝光显影。采用Image J软件处理结果图像。
1.3 统计学方法

2 结果
2.1 TNS1 mRNA在NSCLC癌组织中的表达及其与临床病理特征的关系
如图1所示,与癌旁组织相比,NSCLC癌组织中TNS1mRNA表达明显下降(t=-2.195,P<0.05)。由表1可见,TNS1mRNA表达量与NSCLC 患者淋巴结转移及术后远处转移相关(χ2=4.45和7.42,P均<0.05),淋巴结转移及术后出现远处转移的患者TNS1mRNA呈低表达,而性别、年龄、吸烟史、肿瘤直径、病理分型、术后TNM分期与TNS1mRNA表达水平未见明显相关(P均>0.05)。

表1 TNS1 mRNA表达与NSCLC患者临床病理特征的关系
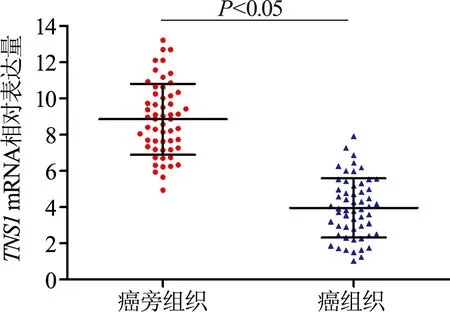
图1 qRT-PCR检测NSCLC癌旁组织和癌组织中TNS1 mRNA表达
2.2 NSCLC癌组织中TNS1表达与患者预后的关系
在TCGA数据中,TNS1mRNA高表达肺腺癌患者的总体生存率显著优于TNS1mRNA低表达肺腺癌患者(P=0.019),见图2。
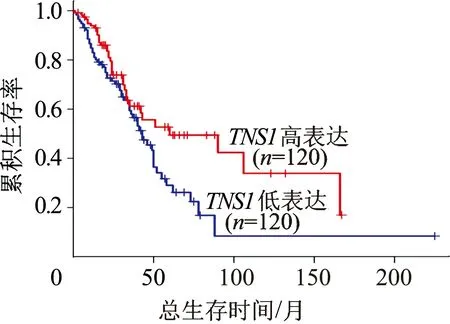
图2 TCGA数据库中TNS1 mRNA高表达与低表达肺腺癌患者的总体生存曲线
进一步对我院56例肺腺癌术后患者进行随访,随访时间为3.5~47.3个月,中位随访时间为21.3个月。TNS1mRNA高表达患者3年累积无病生存率和累积总体生存率明显优于TNS1mRNA低表达患者(χ2=5.770和3.950,P=0.016和0.047)。见图3。
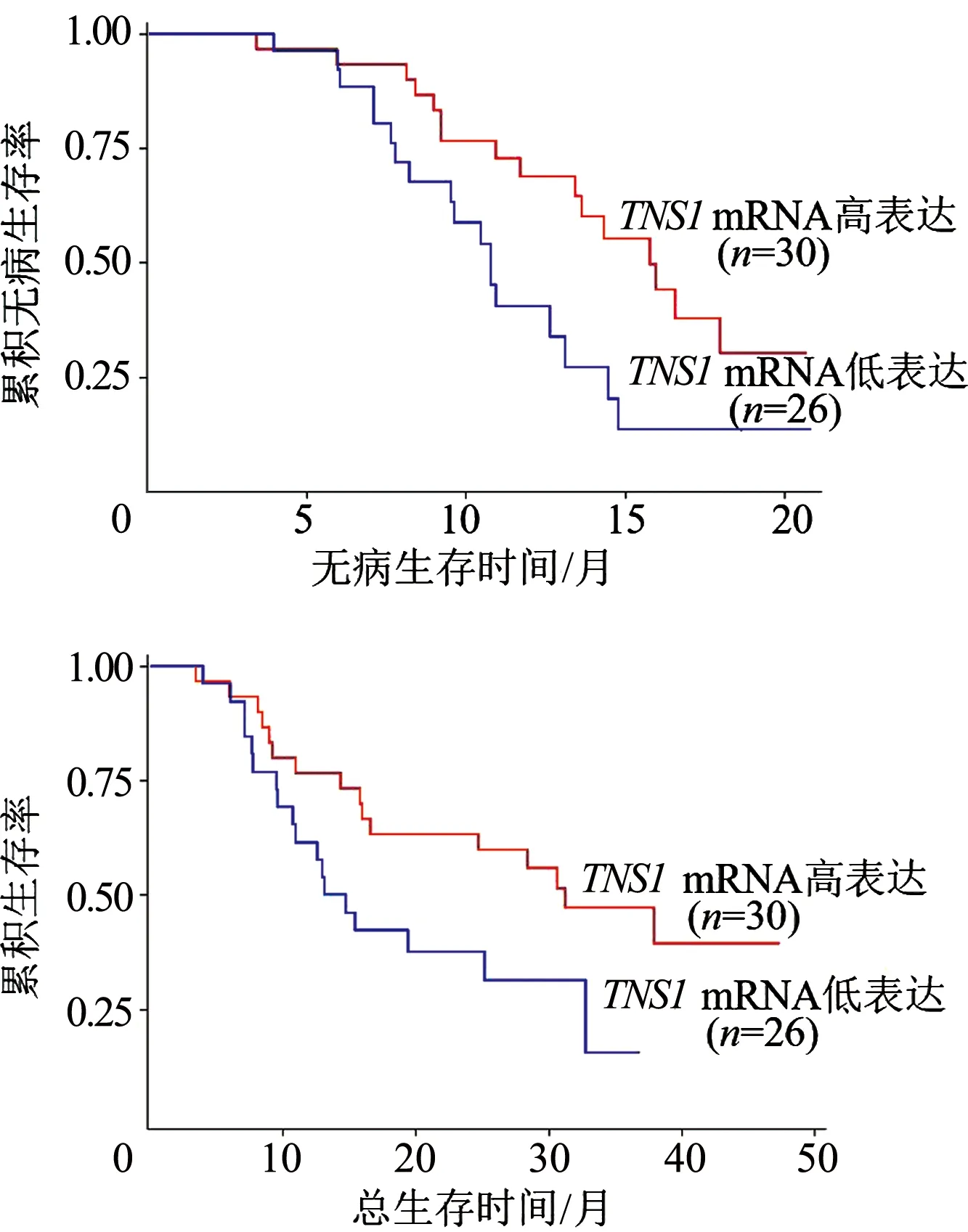
图3 NSCLC癌组织中TNS1 mRNA高表达与低表达患者的累积无病生存曲线和累积总体生存曲线
2.3 TNS1在不同肺癌细胞中的表达
由图4可见,A549和H1299细胞中TNS1mRNA和蛋白表达量明显低于16HBE细胞(P均<0.01)。质粒pcDNA3.1/TNS1转染A549和H1299细胞48 h后,qRT-PCR检测显示,A549/pcDNA3.1/TNS1和H1299/pcDNA3.1/TNS1组细胞TNS1mRNA和蛋白表达量明显高于相应对照组 (P均<0.01)。

①:A549/pcDNA3.1;②:A549/pcDNA3.1/TNS1;③:H1299/pcDNA3.1;④:H1299/pcDNA3.1/TNS1图4 qRT PCR和蛋白质印迹法检测不同细胞中TNS1 mRNA和蛋白表达
2.4 TNS1对A549和H1299细胞增殖能力的影响
由图5可见,在48、72 h,A549/pcDNA3.1/TNS1和H1299/pcDNA3.1/TNS1组细胞增殖能力均明显低于对照组(P<0.05和P<0.01),表明pcDNA3.1/TNS1转染组细胞生长受到抑制。克隆形成实验显示转染pcDNA3.1/TNS1组A549细胞和H1299细胞克隆形成能力均明显低于对照组(t=-7.865和-8.877,P均<0.01),见图6。由此可见,TNS1可抑制A549和H1299细胞的增殖能力。

a:P<0.05,b:P<0.01,与同时间点A549/pcDNA3.1比较;c:P<0.05,d:P<0.01,与同时间点H1299/pcDNA3.1比较图5 MTT法检测A549和H1299细胞增殖能力

图6 克隆形成实验检测A549和H1299细胞增殖能力
2.5 TNS1对A549和H1299细胞迁移能力的影响
细胞划痕实验结果显示,在24、48 h,与对照组相比,A549/pcDNA3.1/TNS1和H1299/pcDNA3.1/TNS1组细胞迁移细胞数量明显减少,迁移速度明显减慢(P均<0.01) ,见图7。由此说明,上调TNS1表达可明显抑制A549和H1299细胞的迁移能力。

①:A549/pcDNA3.1;②:A549/pcDNA3.1/TNS1;③:H1299/pcDNA3.1;④:H1299/pcDNA3.1/TNS1图7 划痕实验检测A549和H1299细胞迁移能力
2.6 TNS1对A549和H1299细胞侵袭能力的影响
Transwell实验结果显示,与对照组相比,A549/pcDNA3.1/TNS1和H1299/pcDNA3.1/TNS1组穿透基膜的细胞数明显减少(t=-6.585和-7.637,P<均0.01)。由此说明,上调TNS1表达可明显抑制A549和H1299细胞的侵袭能力。见图8。

图8 Transwell实验检测A549和H1299细胞的侵袭能力(×200)
2.7 TNS1 mRNA对E-钙黏蛋白和波形蛋白的调控作用
蛋白质印迹法结果显示,与对照组相比,A549/pcDNA3.1/TNS1和H1299/pcDNA3.1/TNS1组细胞中E-钙黏蛋白表达水平明显增加(t=3.112和3.579,P均<0.01),波形蛋白表达明显降低(t=-4.757和-3.187,P均<0.01)。见图9。

①:A549/pcDNA3.1;②:A549/pcDNA3.1/TNS1;③ H1299/pcDNA3.1;④ H1299/pcDNA3.1/TNS1图9 蛋白质印迹法检测E-钙黏蛋白和波形蛋白表达
3 讨论
以往研究表明,TNS参与调节多种肿瘤细胞生物学活动,包括细胞黏附、迁移、增殖等,与肿瘤患者预后相关[10]。Zhan等[7]研究发现,TNS1在转移性乳腺癌组织中表达显著降低,且TNS1高表达患者无转移生存时间显著长于低表达患者。曹一鑫等[8]报道胃癌肿瘤转移患者TNS1蛋白表达率低于未发生转移患者,是胃癌独立的保护性预后因素。本研究发现,TNS1mRNA在NSCLC组织中的表达低于癌旁组织,且与NSCLC患者淋巴结转移及术后肿瘤转移相关;淋巴结转移与远处转移是预后不良的表现,由此提示TNS1可能参与NSCLC细胞增殖与转移。此外,TNS1mRNA高表达患者3年累积无病生存率和累积总体生存率均优于低表达患者。由此表明,TNS1mRNA低表达促进肺癌患者术后复发,与患者不良预后有关。
此外,本研究体外实验结果证实,上调TNS1表达可显著抑制肺癌A549和H1299细胞增殖、迁移和侵袭能力。有研究发现,携带TNS1特定突变基因型的乳腺癌MDA-MB231细胞系迁移和侵袭能力增强[6],提示TNS1可抑制乳腺癌细胞转移。Zhan等[7]研究亦证实,干扰TNS1表达可增强多种乳腺癌细胞系的侵袭能力,与乳腺癌细胞增殖及侵袭活性密切相关。上皮间质转化(epithelial-mesenchymal transition,EMT)与肿瘤细胞的原位侵袭和远处转移有着密切关系[11]。当肿瘤细胞发生EMT,表现为上皮表型如角丝蛋白、E-钙黏蛋白逐渐丧失,而间质表型如波形蛋白、纤维连接蛋白、N-钙黏蛋白的表达增加,与周围细胞和基质接触减弱,导致肿瘤细胞迁移和运动能力增强[12]。EMT是肿瘤侵袭转移的关键机制,本研究结果显示,TNS1高表达可引起NSCLC细胞E-钙黏蛋白表达上调和波形蛋白表达下降,从而推测TNS1高表达可抑制EMT过程,负性调控NSCLC细胞侵袭和转移。肿瘤细胞的增殖和迁移涉及多种细胞因子和多条信号传导通路,Shinde 等[13]研究表明,转谷氨酰胺酶-2和TNS1共同参与乳腺癌细胞EMT的过程。Zhan等[7]研究证实,乳腺癌细胞中TNS1表达下降促进Rho-GTP酶家族成员Cdc42基因活化,Cdc42可能是TNS1影响乳腺癌肿瘤细胞增殖能力的靶基因。关于TNS1对NSCLC细胞转移具体的调控机制尚有待进一步研究。
综上所述,TNS1在NSCLC组织中呈低表达,且与肺癌患者淋巴结转移、术后远处转移及患者的不良预后有关,其可抑制肺癌细胞增殖和迁移,提示TNS1可作为NSCLC转移发生的潜在指标。
