阻断TIM- 4分子对M1/M2型巨噬细胞极化及同种异体免疫排斥反应的影响
2020-12-22陶佳玲樊慧敏唐涛邵启祥丁庆
陶佳玲,樊慧敏,2,唐涛,邵启祥,丁庆
(1.江苏大学医学院,江苏 镇江 212013;2.江苏大学附属人民医院检验科,江苏 镇江 212002)
T细胞免疫球蛋白及黏蛋白结构域蛋白-4(T-cell immunoglobulin and mucin domain containing protein-4,TIM-4)表达于巨噬细胞和B细胞等细胞表面,在抗原免疫或感染过程中促进抗原特异性T细胞扩增,但在免疫应答后期通过清除抗原特异性T细胞调节适应性免疫应答[1]。此外,TIM-4在炎症期间促进效应T细胞增殖分化,介导自身免疫应答和移植排斥反应[2]。抗TIM-4单克隆抗体通过阻断TIM-4分子,可诱导体内初始CD4+T细胞转化为Foxp3+调节性T细胞,从而提高同种异体移植物存活时间[3]。TIM-4作为跨膜蛋白,因其胞质内部分缺失酪氨酸残基,所以并不能直接传导胞内信号[4]。因此,抗TIM-4单克隆抗体与TIM-4结合后,不能直接激活或抑制其细胞内信号传导,所以抗TIM-4单克隆抗体可理解为阻断性抗体。在已有的报道中,通常利用抗TIM-4单克隆抗体治疗实验性移植物排斥和自身免疫性疾病模型[5-6]。
微小RNA(microRNA,miRNA)是一类内源性长度约22 nt的单链非编码RNA,通常与靶基因mRNA的3′UTR互补结合,抑制翻译或降解靶mRNA[7]。研究表明,在肿瘤和自身免疫性疾病患者中miR-21表达上调[8-9]。miR-21可靶向结合p35 mRNA,抑制其表达,发挥免疫调节功能[7]。我们前期研究证实,敲低miR-21可诱导调节性B细胞产生IL-10,有效抑制同种异体移植排斥反应[10]。巨噬细胞根据活化状态可分为M1和M2型:M1是经典活化的巨噬细胞,具有杀伤微生物和抗肿瘤的作用;M2是旁路活化的巨噬细胞,与抗炎、组织重塑和修复有关[11]。miR-21是巨噬细胞中含量最丰富的一种miRNA[12]。研究表明,通过抑制miR-21表达可抑制M1型炎性巨噬细胞,促进向调节性M2型巨噬细胞极化,减轻同种异体移植排斥反应[13]。但是,TIM-4是否能够通过调控miR-21诱导巨噬细胞极化,减轻免疫排斥反应尚不清楚。因此,本研究通过抗TIM-4单克隆抗体阻断TIM-4后,检测脾脏和腹腔中M1/M2极化情况以及miR-21、炎症性和抑制性细胞因子的表达,探讨TIM-4信号通路对同种异体免疫排斥的影响。
1 材料与方法
1.1 实验动物
6~8周龄C57BL/6雄性小鼠12只(No.201907363);6~8周龄BALB/c雄性小鼠2只(No.201907408),购于江苏大学实验动物中心。
1.2 主要试剂仪器
胎牛血清(美国Gibco公司);Trizol、逆转录试剂盒、SYBR Green试剂盒均为日本TaKaRa公司产品;异丙醇、无水乙醇和三氯甲烷购自上海国药集团;S1000TMThermal Cycler PCR仪和CFX-96定量PCR仪均为美国Bio-Rad公司产品;F4/80-FITC、CD11b-APC、CD38-PE和CD206-PE均为美国eBioscience公司产品;同型对照免疫球蛋白(兔抗鼠Fc抗体)和抗TIM-4单克隆抗体均为美国Bioxcell公司产品;ND-1000紫外分光光度计(美国Nanodrop公司);Accuri C6流式细胞仪(美国BD公司)。所有引物序列均由生工生物工程(上海)股份有限公司合成。
1.3 同种异体小鼠免疫排斥模型构建及分组
将BALB/c小鼠断颈处死,分离脾脏,加入含2%胎牛血清的DMEM,用无菌眼科剪剪成1 mm3组织块,然后过200目无菌钢筛网。加入红细胞裂解液裂解5 min;加入5 mL无菌PBS轻轻吹打混匀;4 ℃,1 000 r/min离心5 min;弃上清液,加入5 mL PBS重悬,计数备用。取3×107个脾细胞注射至C57BL/6小鼠腹腔中。
将注射脾细胞的C57BL/6小鼠分为抗TIM-4组(n=6)和同型对照组(n=6),分别腹腔注射抗TIM-4单克隆抗体和同型对照免疫球蛋白抗体,300 μg/只;第5天,重复注射1次;第10天,处死两组小鼠进行后续相关实验。
1.4 小鼠腹腔细胞和脾细胞的制备
将C57BL/6小鼠置于75%乙醇中浸泡1 min;将其固定于解剖板,取5 mL无菌PBS注射于腹腔,轻揉腹部5 min;打开腹腔并剪一个小口,用一次性塑料滴管吸取腹腔液于离心管中;用PBS重复灌洗腹腔5次,获得腹腔细胞悬液,置4 ℃备用。
取C57BL/6小鼠脾脏,按“1.3”制备脾细胞悬液,计数。
1.5 流式细胞术检测腹腔和脾中M1和M2型巨噬细胞
取“1.4”获得的腹腔细胞和脾细胞,每管加入1×106个单细胞悬液,每种细胞分2管,分别用于M1和M2型巨噬细胞检测。检测M1型巨噬细胞为F4/80、CD11b和CD38组合;检测M2型巨噬细胞为F4/80、CD11b和CD206组合。细胞于4 ℃行1 000 r/min离心5 min;用60 μL PBS重悬细胞,分别加入3种荧光抗体(F4/80、CD11b、CD38或CD206),每种抗体各0.25 μL,4 ℃避光染色30 min;加入1 mL PBS轻轻吹打混匀,1 000 r/min离心5 min;洗去未结合的游离抗体;最后再加入400 μL PBS重悬,流式细胞仪进行检测并用FlowJo 10.0软件分析。
1.6 qRT-PCR检测脾和腹腔细胞中miR-21、促炎和抑炎相关因子等mRNA表达水平
取“1.4”腹腔和脾细胞提取总RNA,检测纯度,行逆转录合成cDNA。逆转录反应程序:42 ℃ 2 min除去基因组DNA,然后 37 ℃ 15 min,85 ℃ 5 s合成cDNA。以cDNA为模板,对上述基因表达水平行PCR反应。miR-21和U6采用专用引物行逆转录,以U6作为检测miR-21内参基因;IL-10、p35、p40和EB病毒诱导基因3(Epstein-Barr virus-induced gene-3,EBi-3)采用逆转录试剂盒中的Oligo dT 引物行逆转录,以β-肌动蛋白作为其内参基因。qRT-PCR反应体系为10 μL,包括2×SYBR Premix ExTaq5.0 μL,正向和反向引物各0.2 μL,cDNA 1 μL,无RNA酶双蒸水3.6 μL。qRT-PCR主要实验步骤:95 ℃ 30 s;95 ℃ 5 s,退火30 s;40个循环。采用2-ΔCt方法计算结果。引物序列如表1所示。

表1 引物序列
1.7 统计学分析

2 结果
2.1 抗TIM-4单克隆抗体处理同种异体免疫小鼠对其脾脏和腹腔M1和M2型巨噬细胞组成的影响
流式结果显示,与同型对照组相比,抗TIM-4处理组小鼠脾脏中M1、M2和M1/M2百分比差异均无统计学意义(P均>0.05);腹腔M1型巨噬细胞百分比无明显变化(t=0.667,P>0.05),但M2型巨噬细胞所占比例显著升高(t=3.317,P<0.05),腹腔细胞中M1/M2显著降低(t=5.331,P<0.01)。由此说明,抗TIM-4单克隆抗体阻断TIM-4分子后,在腹腔中诱导产生有利于免疫耐受的M2型巨噬细胞。见图1。
2.2 抗TIM-4单克隆抗体降低腹腔中miR-21表达
qRT-PCR结果表明,与同型对照组相比,抗TIM-4组小鼠脾细胞中miR-21表达呈下降趋势,但差异无统计学意义(t=2.131,P>0.05),而腹腔细胞中miR-21表达水平显著降低(t=3.251,P<0.05)。见图2。
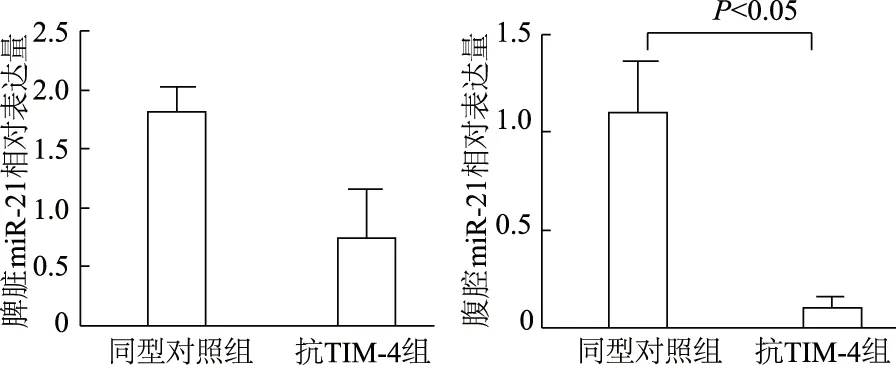
图2 qRT-PCR检测脾脏和腹腔细胞中miR-21表达水平
2.3 抗TIM-4单克隆抗体上调脾细胞中IL-10和p35的mRNA表达,下调EBi-3 mRNA表达
qRT-PCR结果显示,与同型对照组相比,抗TIM-4组脾细胞促炎因子p40 mRNA表达水平无明显变化(t=0.311,P>0.05),但抑炎因子IL-10 和p35 mRNA表达水平显著升高(t=3.049,5.027,P<0.05或0.01),而抑炎因子EBi-3 mRNA表达水平明显降低(t=2.507,P<0.05)。由此可见,抗TIM-4单克隆抗体促进具有免疫抑制作用的IL-10和p35 的mRNA表达。见图3。
2.4 抗TIM-4单克隆抗体促进腹腔细胞中IL-10,p40和EBi-3的mRNA表达
如图4结果显示,与同型对照组相比,抗TIM-4组腹腔细胞中促炎因子p40,抑炎因子IL-10和EBi-3等mRNA表达水平显著升高(P<0.05),但抑炎因子p35 mRNA表达差异无统计学意义(P>0.05)。由此说明,抗TIM-4促进腹腔细胞抑炎因子IL-10,EBi-3和促炎因子p40等mRNA表达。
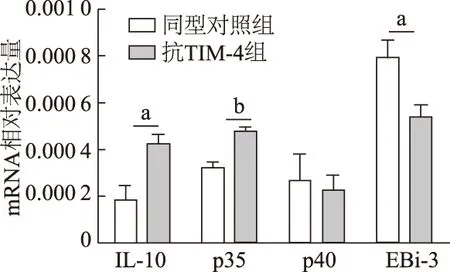
a:P<0.05;b:P<0.01图3 qRT-PCR检测脾细胞中促炎和抑炎因子mRNA表达
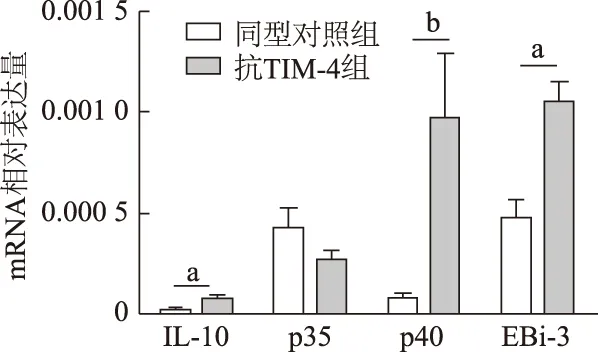
a:P<0.05;b:P<0.01图4 qRT-PCR检测腹腔细胞中促炎和抑炎因子mRNA表达
3 讨论
巨噬细胞是介导移植物排斥的主要细胞[13]。在同种异体移植物中,巨噬细胞是造成组织浸润,急性和慢性排斥的一类主要免疫细胞,其受到不同组织微环境和炎症因子的刺激,具有不同的功能表型[13-14]。M2型巨噬细胞在局部先天性和获得性免疫中均发挥重要作用[15]。研究发现,巨噬细胞通过向M2极化,诱导免疫耐受,提高移植物存活率[13]。已有报道,腹腔中巨噬细胞高表达TIM-4,通过阻断TIM-4分子可促进移植物存活[14]。本研究结果显示,在同种异体免疫排斥模型中,通过TIM-4单克隆抗体处理,小鼠腹腔中M1型巨噬细胞百分比无明显变化,而M2百分比显著升高;脾脏中,M1和M2比例无显著变化。这可能与巨噬细胞的可塑性和异质性的特点有关。此外,可能由于免疫部位不同造成小鼠不同组织中巨噬细胞比例变化不一致。本实验采取的是经典腹腔注射,腹腔中存在大量的巨噬细胞,注射的供体细胞首先与腹腔中巨噬细胞等相互作用,这也可能是腹腔中M1/M2平衡变化明显,而脾脏中变化不明显的原因。
研究发现,miR-21作为调节炎症反应的关键微小RNA,可调控多个靶基因[8]。本研究结果显示,抗TIM-4单克隆抗体降低腹腔细胞中miR-21表达。由此说明,阻断TIM-4分子下调miR-21表达水平,可抑制炎症反应,从而减轻免疫排斥反应。p35和IL-10作为miR-21靶基因,负向调控炎症反应[16]。IL-12是由p40和p35组成的炎症性细胞因子,在炎症中起重要作用[17]。IL-35是由p35和EBi-3作为独立的亚基分泌形成,炎症条件下结合形成具有免疫抑制活性的异二聚体分子,通过诱导免疫耐受减轻小鼠的心脏移植排斥反应[18]。游离p35和EBi-3均可发挥免疫抑制作用,有效抑制同种异体移植排斥反应,诱导同种异体移植物的免疫耐受[18-19]。本实验结果显示,抗TIM-4单克隆抗体可促进脾脏中抑炎因子IL-10和p35 mRNA表达,而抑制抑炎因子EBi-3 mRNA表达。由此说明,阻断TIM-4分子造成脾脏细胞中抑炎因子表达水平升高。此外,本实验结果显示,抗TIM-4组腹腔细胞中抑炎因子IL-10和EBi-3 mRNA表达水平明显升高。以上实验结果显示,腹腔和脾脏中抑炎因子EBi-3表达水平不一致。这可能是由于小鼠脾脏和腹腔免疫细胞组成不同,脾脏主要有T、B细胞组成,巨噬细胞约占2%,而腹腔存在大量巨噬细胞,这种不同的细胞组成可能引起不同的免疫反应[20]。然而,腹腔细胞中促炎因子p40 mRNA表达水平升高,这与抑炎因子IL-10和EBi-3 mRNA表达水平升高相矛盾。有文献报道p40通过调节T细胞的活化,可发挥免疫抑制作用,减缓炎症反应[21]。由此可见,在免疫排斥反应中,促炎和抑炎因子呈动态变化。研究表明,miR-21抑制M2型巨噬细胞极化,下调miR-21表达促进M2极化,有利于诱导移植物存活[13,22]。由此说明,miR-21是参与巨噬细胞极化的关键分子。本实验结果显示,腹腔细胞中miR-21表达水平降低,M2型巨噬细胞百分比升高。由此说明,抑制腹腔细胞中miR-21表达,促进巨噬细胞向M2极化,可诱导机体产生免疫耐受。
综上所述,阻断TIM-4分子可促进抑炎功能的M2型巨噬细胞产生和IL-10、EBi-3和p35等抑炎因子分泌,并且降低miR-21表达水平,减轻同种异体免疫排斥反应。然而促炎因子p40和抑炎因子IL-10、EBi-3和p35等变化的机制有待进一步研究。
