流动注射法测定血红蛋白与过氧化物酶对H2O2/愈创木酚反应体系的动态催化性能
2020-12-17杜璞李永生
杜璞 李永生

摘 要: 辣根过氧化物酶(HRP)已被广泛应用于各个领域,但其价格昂贵且不易保存,所以寻找一种可替代HRP的模拟酶意义重大。本研究初步选择血红蛋白(Hb)作为模拟酶,利用流动注射光度系统(SP-FIA),在非平衡状态下对比了Hb与HRP对H2O2/愈创木酚(GA)反应的动态催化性能。结果表明:Hb在弱酸性及高温环境下其稳定性强于HRP;Hb对H2O2/GA反应体系的催化作用符合米氏方程,可作为一种过氧化物模拟酶使用;在动力学研究中发现,Hb对GA和H2O2的催化活性不及HRP,对GA的亲和力强于HRP,对H2O2的亲和力弱于HRP。干扰实验表明,Hb的催化性能可被Co2+、Cu2+、Pb2+、Fe3+、Zn2+ 激活;EDTA和抗坏血酸可抑制Hb,柠檬酸的酸性环境利于Hb催化;EDTA、抗坏血酸及柠檬酸均能抑制HRP。
关 键 词:血红蛋白;辣根过氧化物酶;流动注射光度法;非平衡态;催化活性
中图分类号:TQ426.97 文献标识码: A 文章编号: 1671-0460(2020)11-2467-05
Determination of Dynamic Catalytic Activities of Hemoglobin and
Peroxidase for H2O2/Guaiacol Reaction System by Flow Injection Analysis
DU Pu, LI Yong-sheng
(School of Chemical Engineering, Sichuan University, Chengdu 610065, China)
Abstract: Horseradish peroxidase (HRP) has been widely used in various fields. But it is expensive and hard to preserve, so it will be important to search for an alternative mimetic enzyme. In this paper, taking hemoglobin (Hb) as a mimetic enzyme, dynamic catalytic properties of Hb and HRP to H2O2/guaiacol (GA) reaction under non-equilibrium state were compared by a special flow-injection photometric system (SP-FIA). The results showed that under weak acidity and high temperature environments, Hb was stronger than HRP in the stability; the catalysis of Hb to the H2O2/GA reaction conformed to Michaelis equation, this proved that it could be used as a simulation enzyme. In the study of dynamics, it was found that its catalytic activity to H2O2 and GA was lower than HRP, the affinity of Hb to GA was stronger than that of HRP, and the affinity of Hb to H2O2 was weaker than that of HRP. The interference tests showed that the catalytic activity of Hb could be activated by Co2+, Cu2+, Pb2+, Fe3+ and Zn2+; EDTA and ascorbic acid would lower the catalytic activity of Hb, but the acidity of citric acid was conducive to the Hb catalysis.
Key words: Hemoglobine; Horseradish peroxidase; Flow-injection analysis; Non-equilibrium state; Catalytic activity
過氧化物酶(peroxidase, POD)存在于真菌、细菌、陆生生物中[1-2],在有机合成[3]、污水处理[4]、医学[5]等领域其催化活性被广泛利用。商用的POD多为辣根过氧化物酶(Horseradish peroxidase,HRP),但HRP价格昂贵且不易保存,所以寻找一种来源丰富、可替代POD的模拟酶就显得尤为重要。血红蛋白(Hemoglobine,Hb)是脊椎动物红细胞内的呼吸蛋白,其结构上具有铁卟啉辅基(血红素),与HRP结构相似[6],因此有类似POD性质。HRP只能来源于辣根,而Hb可从猪、牛等脊椎动物血液中提取,其价格仅为HRP的0.2%,所以Hb是一种很好的POD替代酶。
在用Hb替代POD的研究中,蔡汝秀[7]等首次用其测定了H2O2和葡萄糖;席永清[8]等也利用Hb催化L-酪氨酸/H2O2反应用荧光检测器测定了果蔬中的葡萄糖;王全林[9]等研究了铬黑-T/Hb/H2O2的显色反应体系;杨涛[10]等利用固体电极伏安法研究了邻氨基酚/Hb/H2O2反应体系行为。但Hb相对于HRP的催化性能,很少有人报道。另外,Hb替代HRP的研究多基于手工操作,有人为误差大、操作繁琐的不足。
基于流动注射光度法(SP-FIA)的准确度高且重现性好[11-12]的特点,将其用于Hb与HRP的催化性能对比的研究中,以达到实验数据准确可靠、实验效率高的目的。本研究首先设计了一种新的SP-FIA系统,并选择被广泛应用的愈创木酚 (GA)/H2O2反应体系作为Hb与HRP的催化对象,得到的结果为Hb替代HRP提供了理论根据。
1 实验部分
1.1 仪器与试剂
使用的试剂主要有GA、H2O2 (30%,质量分数)、磷酸氢二钠(Na2HPO3·12H2O)、柠檬酸、浓盐酸(36%~38%,质量分数)、EDTA、柠檬酸及抗坏血酸(AsA),均为分析纯,购于成都科龙化学试剂公司;Hb和HRP, ≥250 U·mg-1,购于Sigma公司;实验用水为脱气纯水。
使用的仪器主要是FIA-3110流动注射装置、紫外-可见分光光度计、SHZ-D(Ⅲ)循环/水式多用真空泵、KL-UP-IV-20超纯水仪、CP224S电子天平、800-1离心机及pXJ-1C+型离子活度计。
1.2 试剂配制
磷酸盐-柠檬酸缓冲液(pH=5.6):分别称取71.2 g的磷酸氢二钠和19.2 g的柠檬酸,溶解后分别移入1.0 L容量瓶中,用水定容,得到0.2 mol·L-1的磷酸氢二钠、0.1 mol·L-1柠檬酸的两种溶液;然后,取580 mL的磷酸氢二钠溶液与420 mL的柠檬酸溶液混合。
GA母液(45 mol·L-1):移取446 μL GA于100 mL容量瓶中,用纯水定容。
H2O2母液(15 mol·L-1):移取165 μL H2O2 (30%)于100 mL容量瓶中,用纯水定容。
HRP溶液(10 kU·L-1):准确称取0.001 0 g HRP干粉,溶解后移入25 mL 容量瓶中,用纯水定容。
Hb溶液(0.6 mol·L-1):称取1.0 g Hb,溶解后转移至25 mL容量瓶中,用纯水定容。
1.3 酶活性测定原理
在过氧化物酶的催化下,H2O2与GA反应生成3,3′-二甲氧基-4,4′-联苯二醌(2-GA),该棕色产物在470 nm处有最大吸收[13] (2GA + 2H2O2 + POD → 2-GA + 4H2O)。根据酶活性定义[14],得到酶活性浓度公式:EPOD = (nV/εvL)(ΔA/Δt);在本研究的SP-FIA系统中n =2,是棕色产物与GA的摩尔比;ε = 0.006 L·(μmol·cm)-1,是2-GA的表观摩尔吸光系数;L = 1 cm,是流通池光程;ΔA为峰高;Δt为从样品注入到最高峰出现的留存时间 (0.67 min);V/v = 5.921,是样品分散度。因此,当这些参数给定时,Ec值仅与ΔA/Δt相关。
1.4 SP-FIA系统及测定过程
SP-FIA流路见图1,由蠕动泵(P)、多功能阀(V)、流通式光度检测器和计算机组成。其测定过程为:当多功能阀处于“采样”位时两个泵同时运行,酶样和GA/H2O2试剂在P2抽吸下充满样品定量环(SL)和试剂定量环(RL),多余液体排废(W),载流磷酸盐-柠檬酸缓冲液将定量环中“清洗液塞”推入反应盘管(RC)和流通池,此时得到空白吸光度值(A0);当该阀转到“注入”位,P2停止,P1推动注入同一载流中的“酶试样塞”和“GA/H2O2试剂塞”进行追赶渗透,进入RC中反应,生成棕色产物,流通检测器给出其吸光度值(A);最后根据吸光度差(ΔA=A-A0)定量酶活性。
RC—反应盘管; SL—样品定量环; RL—试剂定量环; CL—清洗剂定量环。
2 结果与讨论
2.1 FIA系统的参数优选及其性能的考察
在文献基础上[15],用HRP標液作为测试样品,进一步考察了SP-FIA系统流速、样品及试剂的注入体积、反应盘管长度对Hb催化生成的棕色产物吸光度的影响,得到的结果是:流速为1.91 mL·min-1,样品注入体积为40 μL,试剂注入体积为150 μL,反应盘管长度为150 cm,清洗液浓度为0.4 mol·L-1 HCl,注入量为150 μL。
考察了系统的重复性和线性。在上述优选条件下,GA(4.5 mol·L-1)+H2O2(1.5 mmol·L-1)混合液作为试剂,10、30 μmol·L-1 Hb作为测试样品,进行了11次重复检测,得到的RSD小于4%,这证明本系统重现性良好。随后用一系列Hb标液作为测试样品考察了系统的线性,结果表明在 5~40 μmol·L-1 Hb范围内,系统线性响应良好(ΔA = 0.019CHb + 0.037 6,R2=0.992),检出限能达到 0.47 μmol·L-1,可以用该系统对Hb和HRP进行比较研究。
2.2 pH对Hb和HRP催化活性和稳定性的影响
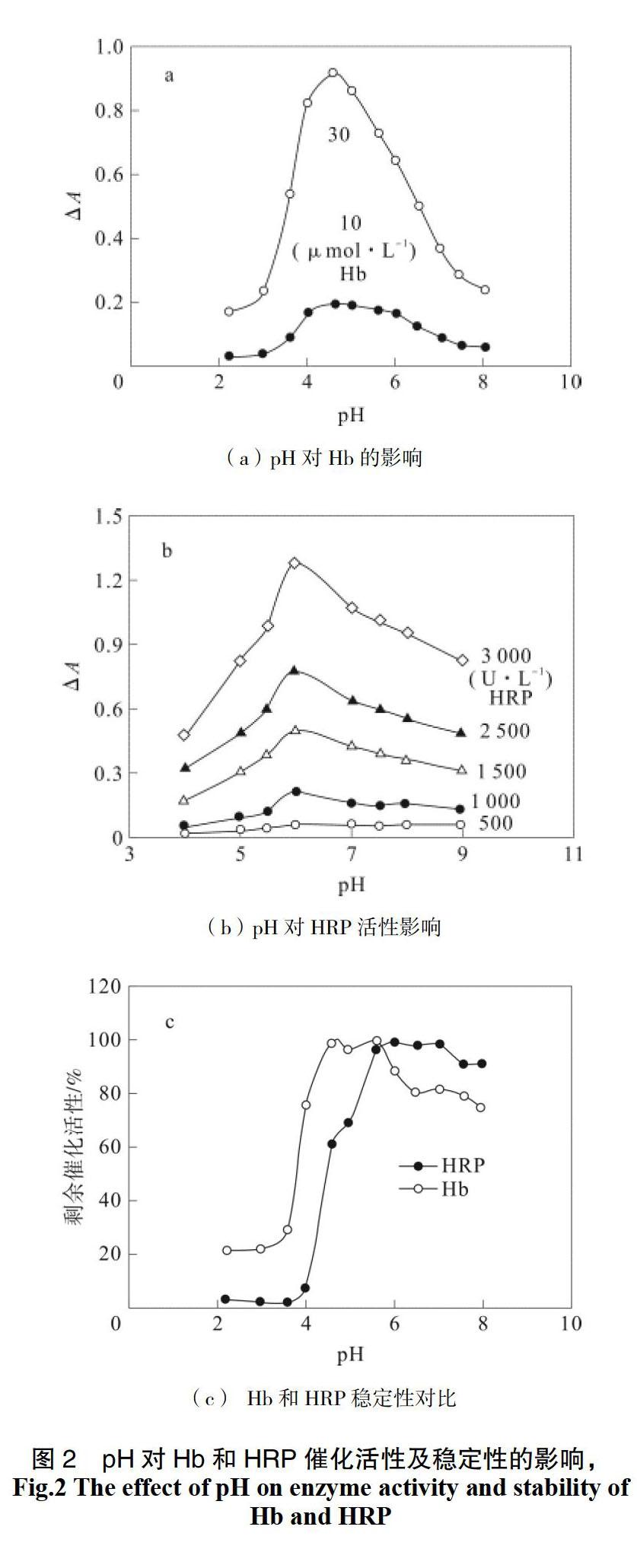
酶蛋白分子侧链的解离状态受到酸碱环境影响,会使酶本身失活或影响与底物的结合。因此,其他条件不变,磷酸盐-柠檬酸缓冲液(pH=2.2~8.0)作为系统的载流,考察了Hb和HRP 的最适pH值,到的结果见图2。结果表明,Hb和HRP催化GA/H2O2反应形成的棕色产物吸光度均随pH增加先增大后减小,在pH=4.6时Hb催化产物吸光度最大(图2a),pH=6.0时HRP催化产物吸光度最大(图2b)。这表明,Hb在偏酸性时、HRP在中性时具有较高的催化活性,但两者在偏碱性环境中催化活性很低。
继续考察了不同酸度环境下Hb和HRP的稳定性。将20 μmol·L-1 Hb及300 U·L-1 HRP标液与不同酸度的缓冲液按1∶1混合后,在4 °C下保存24 h,然后作为测试样品,注入SP-FIA系统进行测定,原始混合液的催化活性定为100%,结果见图2c。结果表明,Hb的相对催化活性在pH=2.2~3.0环境中约为20%,当pH>3.0时Hb的催化活性随pH增加而急增,在pH=4.6~5.6时达到95%~100%,当pH>5.6时Hb活性急剧下降;对于HRP,在pH =2.2~3.6时完全失活,当pH >3.6时HRP活性随pH增加而增大,当pH=5.6~7时活性稳定在95%~100%之间,当pH >7时其活性降低。得到的结论是:在中性、碱性环境中HRP稳定性强于Hb,在pH=5.6时Hb及HRP稳定性均好。因此,在研究Hb和HRP酶学性质时,缓冲液酸度定为pH=5.6。
2.3 温度对Hb和HRP催化活性和稳定性的影响
高温会改变酶蛋白质的空间结构,从而影响其催化活性。因此,本实验考察温度对Hb和HRP的催化活性的影响。pH=5.6的缓冲液作为载流,其他条件不变,400 U·L-1 HRP及10 μmol·L-1 Hb作为测试样品,SP-FIA系统的RC置于恒温水浴,得到的结果见图3a。在25~85 ℃范围Hb及HRP受温度的影响趋势类似,在44 ℃时催化产物的吸光度最高,所以在动态反应下Hb和HRP的最适温度为44 ℃。
在不同温度下Hb及HRP保留1 h后,考察了Hb和HRP的热稳定性。将装有Hb和HRP溶液的试管放在恒温水浴内1 h后,取出冷却至室温。未加热的原始Hb、HRP的催化活性定为100%,实验结果如图3b。在35~85 ℃范围Hb的催化活性为95%~100%,当超过85 ℃时Hb活性开始降低;在35~45 ℃范围,HRP的催化活性约为95%,当超过45 ℃后催化活性迅速下降,95 ℃时HRP完全失活。因此得出结论:Hb的温度耐受性远高于HRP,在35~85 ℃下Hb稳定性良好;HRP在45 ℃以下稳定性较好,高于45 ℃其稳定性明显变差。
2.4 底物浓度对Hb和HRP催化活性的影响
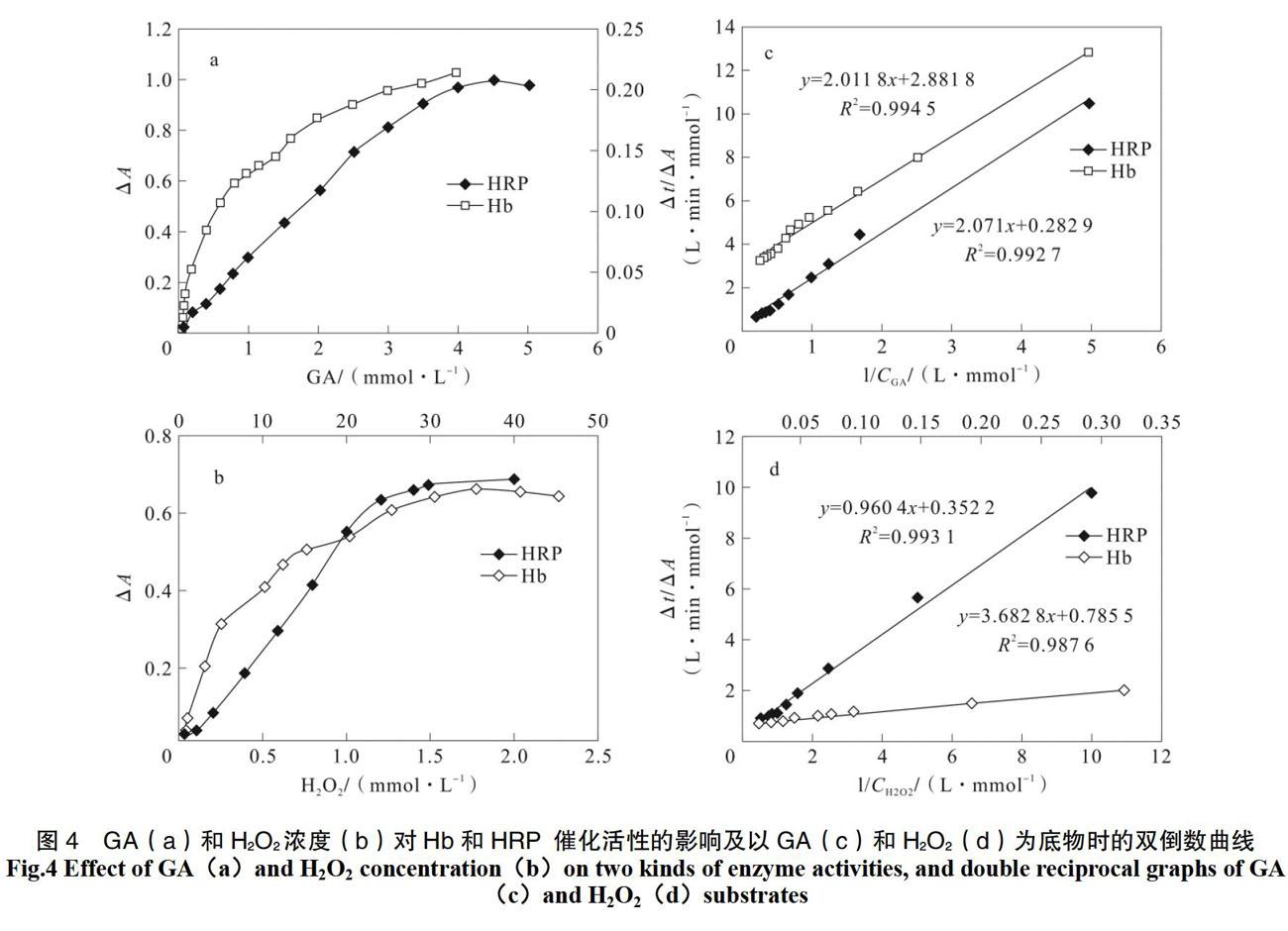
利用GA/H2O2/POD反应体系定量酶的催化活性时,GA/H2O2浓度会影响定量Hb或HRP催化性能的响应信号,因此首先固定注入的Hb或HRP样品浓度及H2O2浓度(1.5 mmol·L-1),改变GA/H2O2混合液中的GA浓度(0.1~4.5 mmol·L-1),评价了GA浓度的影响。图4a结果表明,Hb催化产物的吸光度值随GA浓度增加而增大,超过3 mmol·L-1时产物吸光度趋于稳定;HRP的催化产物吸光度在0~3 mmol·L-1GA范围内,线性增加,超过 4.5 mmol·L-1后产物吸光度不再变化。
GA浓度定为1.5 mmol·L-1,改变GA/H2O2混合液中的H2O2浓度(0~50 mmol·L-1),其他条件如上,评价了H2O2浓度的影响。图4b结果表明,Hb催化产物的吸光度随H2O2浓度线性增加而增大,超过40 mmol·L-1时产物吸光度不再变化;在 0~1 mmol·L-1 H2O2的范圍内,HRP的催化产物吸光度线性增加,超过1.5 mmol·L-1后,产物吸光度不再变化。这说明以GA和H2O2为底物时Hb和HRP催化反应均符合Michaelis-Menten动力学规律。
在此实验中,进一步考察了GA/H2O2/Hb (HRP)反应体系相关的动力学参数Km和vm。在Hb催化下GA 为底物时得到的 Lineweaver-Burk 双倒数图见图4c,由曲线 (y = 2.011 8x + 2.881 8,r =0.993 8)得到KmHb为0.698 mmol·L-1,vmHb为0.347 mmol·(L·min) -1;HRP催化下以GA为底物时的双倒数曲线见图5c,由曲线(y = 2.071x + 0.282 9,r = 0.996)得到KmHRP为7.37 mmol·L-1,vmHRP为3.56 mmol l·(L·min) -1。由于KmHb < KmHRP,所以Hb对GA的亲和力强于HRP;由于vmHRP > vmHb,所以当GA为底物时,Hb的催化活性小于HRP。
在Hb催化下以H2O2为底物时得到的双倒数曲线见图4d,由曲线(y = 3.682 8x + 0.785 5,r = 0.999)求出以H2O2为底物时Hb的KmHb为4.68 mmol·L-1,vmHb为1.27 mmol·(L·min) -1。在HRP催化下H2O2为底物时的双倒数曲线见图4d,由曲线(y = 0.960 4 x+0.352 2,r =0.997)求出HRP的KmHRP为2.73 mmol·L-1,vmHRP为2.84 mmol·(L·min)-1。由于KmHb > KmHRP,所以Hb对H2O2的亲和力弱于HRP;vmHb 3 干扰实验 在Hb和HRP样品中分别加入Co2+、Cu2+、Fe3+、Pb2+、Zn2+ (0.1 mmol·L-1),考察了它们的影响。结果表明,Co2+、Cu2+及Pb2+对Hb和HRP均有激活作用,对Hb的激活作用相对较大;Fe3+和Zn2+对Hb催化有激活作用,而对有HRP催化抑制作用,抑制作用由大到小顺序为Fe3+、Zn2+;针对Hb的激活作用由大到小顺序为Zn2+、Pb2+、Cu2+、Fe3+、 Co2+;针对HRP的激活作用由大到小顺序为Pb2+、 Cu2+、Co2+。 在Hb和HRP样品中又添加EDTA (0~0.8 mmol·L-1)、柠檬酸(0~0.2 mmol·L-1)及AsA(0~0.2 mmol·L-1),考察了这3种抑制剂对Hb和HRP催化活性的影响。结果表明,这3种物质都抑制HRP的催化活性,抑制强度由大到小顺序为柠檬酸、AsA、EDTA。HRP催化活性降低是由于EDTA及柠檬酸可螯合HRP活性中心Fe2+,AsA可与催化产物反应,导致计算结果呈负偏差;EDTA和AsA也抑制Hb催化活性,表现为浓度增加,Hb催化活性减小;但在0~0.2 mmol·L-1范围内,柠檬酸浓度增加会使Hb催化活性增强,因为Hb的最适pH为4.6,柠檬酸浓度增大使反应体系pH接近了此值,即氢离子对Hb催化活性的正影响大于柠檬酸螯合造成的负影响。AsA浓度对Hb、HRP的催化活性是负影响,并与催化产物的信号呈负的线性相关(ΔAHb = -0.017CAsA + 0.219,R2=0.999 5;ΔAHRP = -0.456CAsA + 0.214,R2 = 0.991 5)。
4 结 论
Hb在弱酸性及高温环境下其稳定性强于HRP;Hb催化H2O2/GA反应体系符合米氏方程,可作为一种过氧化物模拟酶使用;Hb对GA的亲和力强于HRP,對H2O2的亲和力弱于HRP,Hb对GA和H2O2催化活性低于HRP。Hb的催化性能可以被Co2+、Cu2+、Pb2+、Fe3+、Zn2+激活;Fe3+、Zn2+对HRP的酶活性起抑制作用;柠檬酸的酸性环境利于Hb催化。综上所述,Hb可作为一种HRP的替代物使用。
参考文献:
[1]PASSARDI F, COSIO C, PENEL C, et al. Peroxidases have more functions than a Swiss army knife[J]. Plant Cell Rep., 2005, 24(5): 255-265.
[2]ALMAGRO L, G?MEZ ROS L V, BELCHI-NAVARRO S, et al. A.Class III peroxidases in plant defence reactions[J]. J. Exp. Bot., 2009, 60(2): 377-390.
[3]WANG S, WANG Q, FAN X, et al. Synthesis and characterization of starch-poly (methyl acrylate) graft copolymers using horseradish peroxidase[J]. Carbohyd. Polym., 2015, 136(9): 1010-1016.
[4]程龙.辣根过氧化物酶在多壁碳纳米管/堇青石复合载体上的固定化及含油污水处理[D].北京:北京化工大学,2015.
[5]SAA L, GRINYTE R. Blocked enzymatic etching of gold nanorods:application to colorimetric detection of acetylcholine- sterase activity and its inhibitors[J]. ACS Appl. Mater. Inter., 2016,8(17):11139-11146.
[6]ZWART A, BUURSMA A, VAN K E J, et al. Multicomponent analysis of hemoglobin derivatives with reversed-optics spectrophotometer.[J]. Clin. Chem.,1984,30(3):373-379.
[7]黄应平,蔡汝秀.血红蛋白作为过氧化物模拟酶催化显色体系的研究与应用[J].分析化学,2001,49(4):378-382.
[8]席永清,邱海鸥,杨明,等.血红蛋白模拟酶催化荧光法测定葡萄糖[J].分析化学,2008, 36(10):40-45.
[9]王全林,吕功煊.基于血红蛋白的过氧化物酶特性测定其在血浆中游离态含量[J].分析化学,2003,31(8):945-949.
[10]杨涛,王增健,焦奎,等.血红蛋白模拟过氧化物酶催化H2O2氧化邻氨基酚的固体电极伏安法研究[J].分析试验室,2006, 25(3):1-4.
[11]张吉良.气体扩散—流动注射分光光度法测定水中氟[J]. 沈阳化工(当代化工), 1994(3):53-55.
[12]赵珍义,马成龙,陈华. FIA—双光束分光光度法测定天然水中微量铁[J]. 沈阳化工(当代化工),1992(5):32-34.
[13]HWANG S, LEE C H, AHN I S. Product identification of guaiacol oxidation catalyzed by manganese peroxidase[J]. J. Ind. Eng. Chem. , 2008, 14(4): 487-492.
[14]IUB N C. Nomenclature committee of the international union of bio- chemistry (NC-IUB)-units of enzyme-activity-recommendations 1978 [J]. Eur. J. Biochem. , 1979, 97(2): 319-320.
[15]李永生,郑巍,高秀峰.基于流动注射光度法的吸光度/留存时间比自动测定过氧化物酶活性方法[J].分析化学,2015, 43(10):1580-1588.
