高铁酸钾同时去除废水中砷(III)与4-羟基-3-氨基苯砷酸的技术
2020-12-17臧淑艳胡静娴王娟高嵩李波蔚蓝董译李文龙
臧淑艳 胡静娴 王娟 高嵩 李波 蔚蓝 董译 李文龙
摘 要:有机砷和无机砷因各种人为和自然因素导致它们常常在土壤/废水中共存,并通过物理、化学和微生物过程发生各种交互作用,对生态环境造成极大威胁。以有机砷[4-羟基-3-氨基苯砷酸(HAPA)]和无机砷[As(Ⅲ)]为研究对象,探讨了多功能氧化剂高铁酸钾同时去除有机砷与无机砷复合污染废水的技术与机理。结果表明:当复合污染废水的pH值为5.5,温度为25.0 ℃,铁砷质量比为5∶1,反应时间为4 h时,As(Ⅲ)和HAPA的综合处理效果最好。利用SEM 和红外光谱协同阐释了高铁酸钾同时高效去除有机砷与无机砷复合污染废水的机理。
关 键 词:高铁酸钾;HAPA;As(Ⅲ);化学氧化;吸附
中图分类号:TQ013 文献标识码: A 文章编号: 1671-0460(2020)11-2375-05
Simultaneous Removal of As(Ⅲ)and 4-Hydroxy-3-aminophenylarsenate
From Wastewater by Potassium Ferrate
ZANG Shu-yan, HU Jing-xian, WANG Juan *, GAO Song*, LI Bo, WEI Lan, DONG Yi, LI Wen-long
(Liaoning Province Industrial Emissions Heavy Metals Treatment and Recycling Technology Engineering Research Center, Shenyang University of Chemical Technology, Shenyang 110143, China)
Abstract: Organic arsenic and inorganic arsenic often coexist in the soil and wastewater due to various human and natural factors, and interact with each other through physical, chemical and microbial processes, which poses a great threat to the ecological environment. In this paper, the organic arsenic 4-hydroxy-3-aminophenylarsenic acid (HAPA) and inorganic arsenic [As(Ⅲ)] were taken as the research object, the removal technology and mechanism of As(Ⅲ) and HAPA in polluted wastewater by potassium ferrate were discussed. The results showed that the optimal removal conditions were determined as follows: pH value 5.5, the temperature 25.0 ℃, iron-arsenic mass ratio 5∶1,the reaction time 4 h. The mechanism of efficiently removing organic arsenic and inorganic arsenic by potassium ferrate was explained by SEM and infrared spectroscopy.
Key words: Potassium ferrate; HAPA; As(Ⅲ); Chemical oxidation; Adsorption
隨着工农业的飞速发展, 与日俱增的有机砷与无机砷类污染物在未经处理或处理不达标的情况下排放到环境中,造成土壤/地表水的持续污染,导致我国大约有五百多万人口正面临着较高质量浓度含砷废水的威胁[1],由此引发的地下水和食品安全风险已引起人们高度关注。洛克沙胂砷(3-硝基-4-羟基苯胂砷酸,即ROX)作为一种广泛应用的畜禽养殖业饲料添加剂,在动物体内基本不被降解,一般随畜禽粪便和养殖废水进入土壤和水环境中,导致潜在的砷污染[2-3]。ROX 在厌氧环境中很容易被初步降解生成3-氨基-4-羟基苯胂砷酸(HAPA),而一般条件下HAPA在环境中较难降解,降解后生成毒性很强的无机砷[4]。GARBARINO[5]等在研究家禽排泄物中的ROX的转化过程中发现,在室温和厌氧条件下,48 h内ROX就被完全转化为其他含砷化合物,而且转化过程明显受水分、温度的影响,转化产物包括HAPA和As(Ⅲ)等,造成了As(Ⅲ)和HAPA的复合污染,对生态安全造成极大的威 胁[6-7]。目前,科学家们已经对无机砷污染废水的治理技术与机理进行了广泛和深入的研究[8-11],但是对无机砷和有机砷复合污染废水的去除技术与机理研究尚鲜有报道。因此,探索砷类复合污染废水的治理技术与机理十分重要。
在水净化处理中,吸附降解是一种常见的途径,并受到学术界的欢迎[12]。高铁酸钾作为价格便宜、无二次污染的绿色水处理剂,具有良好的氧化、絮凝和杀菌作用[13]。高铁酸钾的水解产物/还原产物能与液体中砷酸盐反应生成砷酸铁共沉淀。而高铁酸钾溶于水后有着极强的氧化性,不仅可以使有机砷HAPA氧化降解,也能够将As (Ⅲ)氧化为As (Ⅴ),而其自身将被还原生成羟基氧化铁,该含铁氧化物依旧有着较强的絮凝吸附性能。因此,高铁酸钾在污染废水治理方面一直是受科研工作者青睐的研究对象,尤其是在对砷污染废水治理方面获得了较理想的效果[14-16]。然而,目前有关利用高铁酸钾同时去除各种含砷复合污染废水/土壤的研究鲜有报道。
本文主要以厌氧或者兼性厌氧环境为背景,以ROX的主要降解产物HAPA与As(Ⅲ)为研究对象,运用高铁酸钾作为氧化剂处理HAPA和As (Ⅲ)复合污染废水,考察了最佳反应参数对复合污染废水治理效果的影响,并初步探讨去除技术与机理。研究结果将为有机砷与无机砷复合污染废水/土壤的治理技术与机理的深入探索提供理论依据。
1 实验部分
1.1 儀器与试剂
主要仪器:日立高效液相色谱仪(Primaide);AFS-2202E型双道原子荧光光度计(北京海光仪器公司)。
主要试剂:高铁酸钾、HAPA、亚砷酸钠等,均为分析纯。
1.2 实验方法
配置质量浓度为100 mg·L-1 HAPA + 10 mg·L-1 As(Ⅲ)的砷复合污染混合溶液,其中As(Ⅲ)质量浓度为亚砷酸钠中砷的单一元素质量浓度。取100 mL上述母液加入到250 mL锥形瓶中,调节溶液pH,加入一定量的高铁酸钾固体,迅速混匀后,再次调节pH至初始pH,放入振荡器,在室温下匀速震荡,适时取样测试上述污染物质的残留质量浓度,并分别计算污染物的去除率。
2 结果与讨论
2.1 高铁酸钾处理蒸馏水与废水后固体的SEM
图1 a与图1 b分别为高铁酸钾投加到蒸馏水和砷复合污染废水反应后生成的固体电镜图。图1 b物质外貌与图1 a明显不同,且颗粒尺寸比较均匀,尺寸较小。这可能是因为高铁酸钾与砷复合污染废水中的砷发生反应生成了新的沉淀,新物质形貌与原物质不同,且颗粒大小相对均匀。
2.2 高铁酸钾处理砷复合污染前后的红外光谱
图2中的两条线a和b,分别为高铁酸钾与蒸馏水、高铁酸钾处理砷复合污染废水后生成的固体的红外光谱谱图。可以看到,高铁酸钾-砷复合污染废水在2 926 cm-1处有两个区别于高铁酸钾-水的峰,对应于芳环和醛基的C-H伸缩振动峰;在1 383 cm-1处也多出一个明显峰,对应于为硝基吸收峰。而HAPA应有的砷酸根在850 cm-1处左右的峰没有出现在b曲线上,说明废水中去除掉的HAPA并没有被吸附,而是基本被高铁酸钾降解。
2.3 反应时间对砷复合污染废水的影响
在锥形瓶中加入铁砷质量比5∶1的高铁酸钾后立即摇匀,调节pH为5,在30.0 ℃下进行恒温振摇,分别在0.5、1.0、2.0、3.0、4.0 h取样测定溶液中残留HAPA和As(Ⅲ)的质量浓度,反应时间对复合污染废水的去除效果见图3。
由图3可知,HAPA与As(Ⅲ)的去除过程可以近似的分为两个阶段,即氧化阶段和吸附阶段[17]。0~0.5 h内两种污染物质的去除率随反应时间增加而快速提高;而在1.0 h时后,两种污染物质的去除率随反应时间的增加逐渐趋缓,这是由于0.5 h内高铁酸钾迅速将HAPA与As(Ⅲ)氧化,导致这两种母体污染物迅速减少,因此HAPA与As(Ⅲ)其去除率明显增加,与此同时高铁酸钾被还原成多羟基氧化铁。1.0 h后HAPA与As(Ⅲ)的去除主要是依赖于高铁酸钾被还原后所生成的多羟基氧化铁的吸附作用,包括化学吸附和物理吸附。
HAPA与As(Ⅲ)被氧化的终极产物主要是As(V)。在0~0.5 h,As(V)质量浓度随着反应时间的增加快速增大。As(V)在溶液中的残留质量浓度主要取决于两方面:一方面是随着HAPA与As(Ⅲ)的氧化而逐渐增大As(V)在液相中的质量浓度,但HAPA被高铁酸钾氧化可能还有其他中间产物而未完全转化成As(V),这一点已经在预实验中通过理论计算(即HAPA的初始质量浓度、残留质量浓度以及As在HAPA分子中所占比例)证明;另一方面是As(V)容易与体系中的羟基氧化铁反应生成砷酸铁沉淀而降低其在液相中质量浓度。4 h后,3种污染物[HAPA、As(Ⅲ)和As(V)]的去除率均趋近于平衡。因此,我们取样时间确定为4 h。
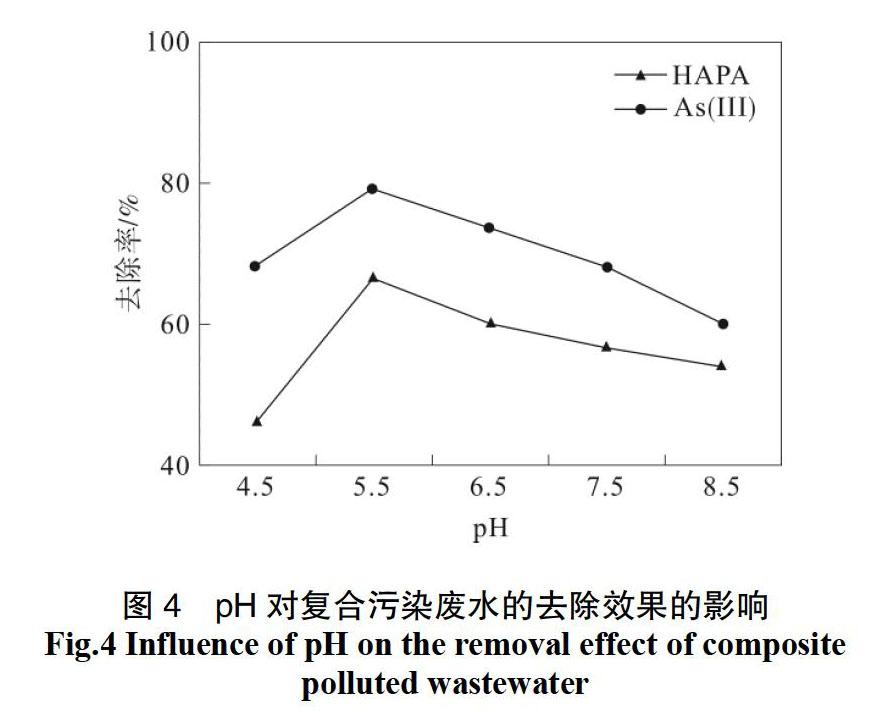
2.4 pH对HAPA与As(Ⅲ)复合污染废水的影响
在实验瓶中加入高铁酸钾后立即摇均,再次将pH分别调节为4.5、5.5、6.5、7.5和8.5,振摇4 h后取样测定溶液中HAPA与As(Ⅲ)的残留质量浓度,从而计算HAPA与As(Ⅲ)去除率,其他条件同2.3。pH对复合污染废水的去除效果见图4。
由图4可知,在pH值为4.5~8.5范围内,随着pH值的升高,HAPA与As(Ⅲ)的去除率先升高后降低。这可能是因为在不同pH下高铁酸钾的氧化能力和稳定性不同[18]。据报道,pH越小的条件下高铁酸钾氧化性越强[19-21], 因此HAPA与As (Ⅲ)在低pH时迅速被氧化,去除率高;但另一方面,pH越小,酸性越强,高铁酸钾越易发生自分解反应,而导致其有效质量浓度降低,最终影响污染物的去除率。当pH值为5.5时,复合污染物的去除率最高。这是同时考虑了氧化性与稳定性的综合结果。
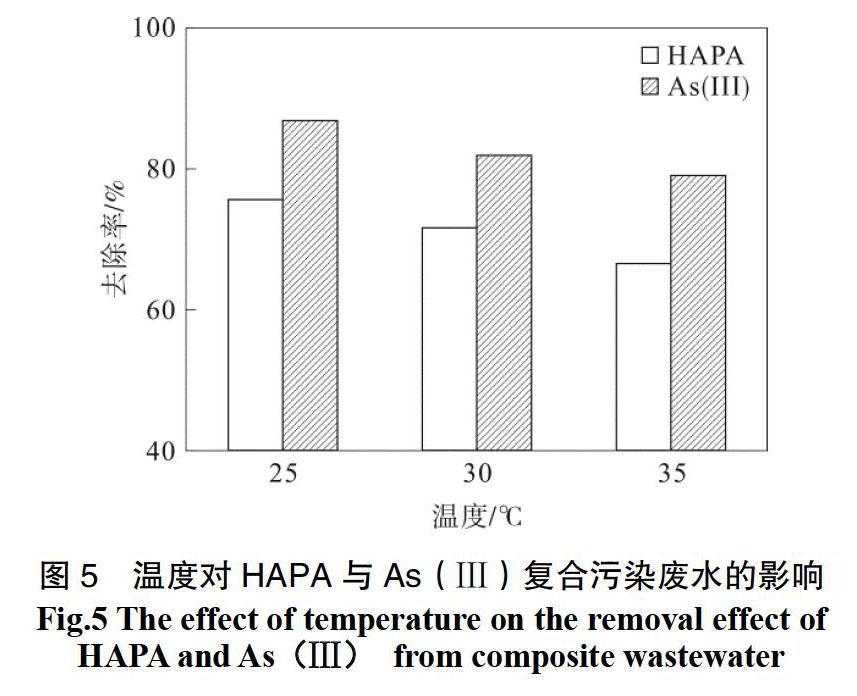
2.5 温度对砷复合污染废水的影响
在装有适量上述复合污染物的锥形瓶中加入高铁酸钾迅速摇匀后,调节pH为5.5,取样时间为4 h,分别在25.0 ℃,30.0 ℃,35.0 ℃温度下进行恒温振摇,其他条件同上,结果如图5所示。
由图5可知,随着温度的升高,HAPA与As(Ⅲ)的去除率均呈下降的趋势,并且在25.0 ℃时去除率最大。这可能是一方面由于温度升高,加快了高铁酸钾与HAPA与As(Ⅲ)的反应; 另一方面,由于高铁酸钾本身不稳定,温度越高自分解越快,从而导致体系中有效高铁酸钾质量浓度降低,氧化作用减弱。由图5可知,温度对高铁酸钾的自分解作用大于对污染物氧化作用,从而导致温度越高,两种污染物去除率逐渐降低。因此,以下实验温度选用25.0 ℃。
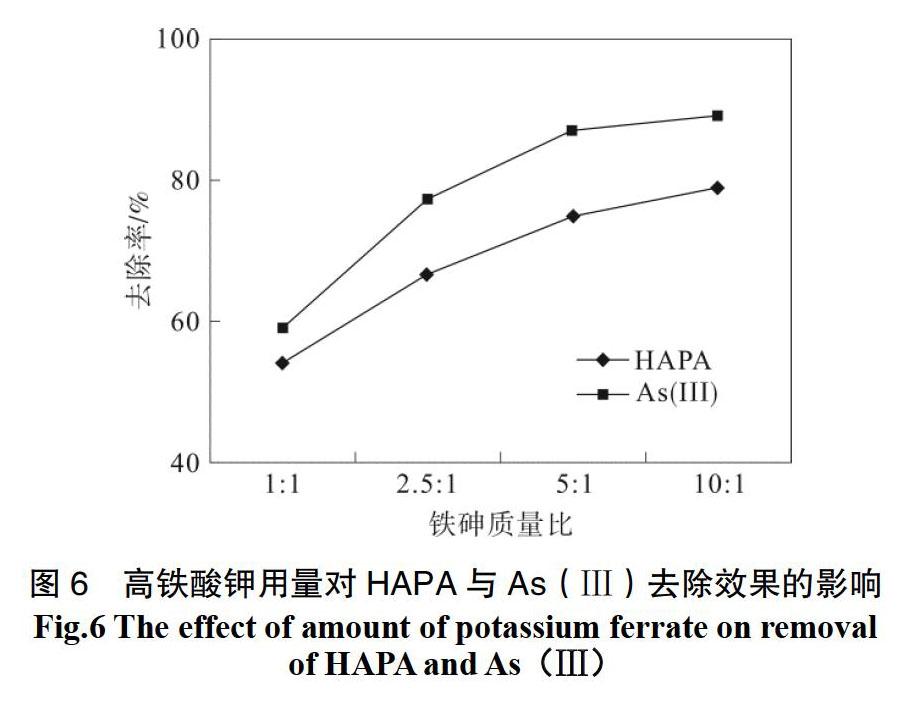
2.6 氧化剂用量的选择
取固体高铁酸钾(其与两种砷污染物质总量质量比为0.5∶1、2.5∶1、5∶1、10∶1)加入废水后迅速摇匀,调节pH为5.5,在25.0 ℃下进行恒温振摇,4 h后取样,高铁酸钾用量对HAPA与As(Ⅲ)的去除结果如图6所示。
从图6中可以看出,随着高铁酸钾与砷质量比的逐渐增大,HAPA与As(Ⅲ)的去除率明显升高。在投加量为5∶1之后,HAPA与As(Ⅲ)的去除率虽然继续增大,但是增幅较小,曲线较平稳。众所周知,高铁酸盐去除As(Ⅲ)的机理就是将As(Ⅲ)氧化为As(Ⅴ)后,进行化学吸附和者物理吸附来去除。在高铁酸钾与污染物的比例为5∶1时As(Ⅲ)去除率显著增大。残留液中As(Ⅴ)质量浓度明显减少,说明污染物质质量浓度不变的情况下,此时的氧化剂的投加量能够在有效氧化As(Ⅲ)同时吸附氧化过程中所生成的As(Ⅴ)。从图6中能够观察到投加量为5∶1与10∶1时,残留砷的质量浓度相差不大,说明了在投加量为10∶1时,HAPA被氧化量已经接近于饱和。当高铁酸钾增多,虽然产生的有吸附作用的Fe3+更多,但是高铁酸钾质量浓度越大,自分解越严重,导致其有效质量浓度低于理论质量浓度。综合上述高铁酸钾对此复合污染物的氧化能力、吸附能力以及自身分解等多因素的影响,本次实验选用的氧化剂投加量为 5∶1。
3 结 论
本文以含HAPA(100 mg·L-1)和As(Ⅲ) (10 mg·L-1)的复合污染废水为研究对象,探讨了不同条件对高铁酸钾氧化和吸附两种复合污染物(HAPA 和 As(Ⅲ))的影响。结果表明:在pH为5.5左右,温度在25 ℃,铁砷质量比达到5∶1,反应时间为4 h时,此复合污染废水中HAPA和As(Ⅲ)的综合去除效果最好,As(Ⅲ)与HAPA的去除率分别达到86.9% 和74.5%。由影响条件、SEM 以及红外光谱协同阐释了高铁酸钾同时去除有机砷与无机砷复合污染废水的机理,即多功能强氧化剂高铁酸钾加入上述含砷复合污染废水后,其极强的氧化性快速将HAPA与As(Ⅲ)氧化,同时高铁酸钾的还原产物FeOOH与Fe2O3将HAPA与As(Ⅲ)的次级氧化产物高效吸附。另一方面,高铁酸钾的还原产物羟基氧化铁能与As(Ⅲ)的氧化产物As(V)反应生成砷酸铁沉淀,这一点在我们的预实验以及很多学者的研究中均已证明[22]。
参考文献:
[1]RODR?GUEZ-LADO L, SUN G F, BERG M, et al. Groundwater Arsenic Contamination Throughout China[J]. Science, 2013, 341: 866-868.
[2]YUJI A,LANZIROTTI A,SUTTON S,et al. Arsenic speciation and reactivity in poultry litter[J]. Environmental science & technology, 2003, 37(18): 4083-4090.
[3]IRAIL C,FIELD J A, MIKE K,et al. Anaerobic biotransformation of roxarsone and related N-substituted phenylarsonic acids[J]. Environmental science & technology,2006,40(9):2951-2957.
[4] 毛静静. HAPA对污泥高温厌氧降解的影响研究[J]. 现代农业科技,2014(7):230-231.
[5]GARBARINO J R,BEDNAR A J,RUTHERFORD D W,et al. Enviromental fate of roxarsone in poultry litter. L Degradaion of roxarsone during composting[J]. Environmental Science &Technology, 2003,37(8): 1509-1514.
[6]CHEN N,WAN Y,AI Z,et al. Fast transformation of roxarsone into toxic arsenic species with ferrous iron and tetrapolyphosphate[J]. Environmental Chemistry Letters,2019,17(2):1077-1084.
[7]趙书婷,王素华,王海玲. 砷遗传毒性作用与机制[J]. 包头医学学报,2016,32(10):164-165.
[8]LIU H,WANG G,GE J, et al. Fate of roxarsone during biological nitrogen removal process in wastewater treatment systems[J]. Chemical Engineering Journal, 2014, 255:500-505.
[9]FAN H T, SUN T, XU H B, et al. Removal of arsenic(V) from aqueous solutions using 3-[2-(2-aminoethylamino)ethylamino] propyl-trimethoxysilane functi -onalized silica gel adsorbent[J]. Desalination, 2011, 278(1-3): 238-243.
[10]FAN H T, LI J, GUO M M, et al. Removal of arsenic from ammoniacal etchingwaste liquor by 3-(2-aminoethylamino)Propyltrimethoxysil- ane functionalized silica gel sorbent[J]. Desalination and Water Treatment, 2012, 50(1-3): 51-58.
[11]FAN H T, FAN X L, LI J, et al.Selective Removal of Arsenic(V) from Aqueous Solution Using A Surface-Ion-Imprinted Amine- Functionalized Silica Gel Sorbent[J]. Industrial & Engineering Chemistry Research, 2012, 51(14): 5216–5223.
[12]王彬蔚.活性污泥對污水中有机物的吸附降解实验[J].当代化工,2019,48(12):2813-2816.
[13]张静,李亚男,王乐心,等.高铁酸钾氧化降解间甲酚的动力学分析[J].工业水处理,2020,40(3):73-77.
[14]YANG J N,LIU X Y,LIU X R,et al. Enhanced Dark ermentative hydrogen production from waste activated sludge by combining potassium ferrate with alkaline pretreatment.[J]. The Science of the total environment,2020,707:1-8.
[15]GONG H, CHU W, XU K H,et al. Efficient degradation,mineral -ization and toxicity reduction of sulfamethoxazole under photo- activation of pep-ASAymonosulfate by ferrate(VI)[J]. Chemical Engineering Journal,2020,389:1-12.
[16]SHARMA V K, MISHRA S K. Ferrate(VI) oxidation of ibuprofen: A kinetic study[J]. environmental chemistry letters, 2006, 3(4): 182-185.
[17]YAO L X, HUANG L X, BAI C H, et al. Effect of roxarsone metabolites in chicken manure on soil biological property[J]. Ecotoxicology and environmental safety,2019,171:493-501.
[18]杨滨,应光国,赵建亮.高铁酸钾氧化降解三氯生的动力学模拟及反应机制研究[J]. 环境科学,2011,32(9):2543-2548.
[19]GHERNAOUT D.NACEUR M W. Ferrate(VI): In situ generation andwater treatment–A review[J]. Desalination and WaterTreatment, 2011, 30(1-3): 319-332.
[20]JIANG Y J, GOODWILL J E, TOBIASON J E, et al. Effect of different solutes, natural organic matter, and particulate Fe(III) on ferrate(VI) decomposition in aqueous solutions[J]. Environ. Sci. Technol., 2015, 49: 2841.
[21]RAI P K, LEE J, KAILASA S K, et al.A critical review of ferrate (VI)-based remediation of soil and groundwater[J].Environ. Res.,2018, 160:420.
[22]JIA Y F, ZHANG D N, PAN R R,et al. A novel two-step coprecipitation process using Fe(Ⅲ) and Al(Ⅲ) for the removal and immobilization of arsenate from acidic aqueous solution[J]. Water Research, 2012, 46(2):500-508.
