弥漫大B细胞淋巴瘤组织中PCDH10的表达
2020-12-17薛伍君陈清江张旭东张明智陈国荣吴少璇尹美凤杨万秋王进隆吴晓爽唐灿伟
薛伍君,陈清江,张旭东,张明智,陈国荣,吴少璇,尹美凤,杨万秋,王进隆,吴晓爽, 唐灿伟,李 冲
1)新乡医学院第三附属医院肿瘤科 河南新乡453000 2)郑州大学第一附属医院肿瘤科 郑州450052
弥漫性大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)是最常见的非霍奇金淋巴瘤,约占所有恶性淋巴瘤的30%,具有高度侵袭性、异质性等特点,约60%的患者经过一线标准治疗方案R-CHOP(利妥昔单抗、环磷酰胺、阿霉素、长春新碱和泼尼松)治疗后可达到临床治愈,但仍有近40%的患者治疗效果较差[1-3]。因此,探索新的治疗相关靶点成为研究的热点。
原钙黏蛋白10(protocadherin 10,PCDH10)属于非聚集原钙黏蛋白家族δ2型,其在细胞黏附、细胞凋亡、细胞周期、集落形成和信号传导等过程中发挥重要的调控功能[4-5]。最新研究[6-8]显示PCDH10可抑制肿瘤细胞的生长、迁移、侵袭和集落形成等生物学行为,可能作为抑癌基因参与肿瘤的发生发展。PCDH10表达下调是成熟B细胞淋巴瘤发生发展的重要早期事件[9],且部分淋巴瘤细胞系中PCDH10表达下调会促进化疗耐药[10-11]。 此外,研究[12]还发现在B细胞淋巴瘤细胞系中,野生型P53可诱导PCDH10表达上调,上调PCDH10表达可抑制肿瘤细胞迁徙和转移。本研究采用免疫组化染色法检测DLBCL组织及炎性增生淋巴结组织中PCDH10蛋白的表达情况,并结合患者临床资料进行分析,探讨PCDH10在DLBCL组织中的表达情况及临床意义。
1 对象与方法
1.1研究对象收集2014年1月至2016年12月新乡医学院第三附属医院和郑州大学第一附属医院诊断为DLBCL的石蜡包埋组织55例(DLBCL组),其中男30例,女25例,年龄16~85岁。骨髓侵犯12例;Ⅰ、Ⅱ期24例,Ⅲ、Ⅳ期31例;国际预后评分指数(IPI)0~2分29例,3~5分26例;乳酸脱氢酶(lactate dehydrogenase,LDH)≥281 U/L 32例, <281 U/L 23例;Ki-67≥60% 26例, <60% 29例。另收集此期间23例炎性增生淋巴结组织(炎性组)作为对照。
1.2DLBCL组织及炎性增生淋巴结组织中PCDH10蛋白表达的检测采用免疫组化SP法。兔抗人PCDH10多克隆抗体购自三鹰生物技术公司,免疫组化SP染色试剂盒和DAB显色剂购自中杉金桥生物技术公司。石蜡包埋组织切片,常规脱蜡,高温修复后PBS冲洗3次,暴露抗原,H2O2处理,加兔抗人PCDH10多克隆抗体(1∶100稀释),4 ℃孵育过夜(PBS代替一抗作阴性对照);加二抗孵育30 min后DAB显色,苏木精复染,盐酸乙醇分化,透明,最后中性树胶封片。细胞核和细胞质内出现淡黄色至棕褐色染色为阳性细胞。每张切片均在高倍镜下选取5个视野,计数阳性细胞数,每个视野至少计数200个细胞。结果判定参照文献[13]:无着色0分,淡黄色1分,棕黄色2分,棕褐色3分;阳性细胞百分比<25% 1分,25%~50% 2分,>50% 3分。两项结果相乘得分≥2分为阳性, <2分为阴性。
1.3统计学处理采用SPSS 20.0处理数据。采用χ2检验比较两种组织中PCDH10蛋白阳性表达率的差异,采用χ2趋势检验分析PCDH10阳性表达率随肿瘤分期和IPI评分变化的趋势,检验水准α=0.05。
2 结果
2.1两种组织中PCDH10的表达情况PCDH10蛋白主要表达于细胞核与细胞质(图1)。DLBCL组PCDH10的阳性表达率为29.1%(16/55),低于炎性组[65.2%(15/23)](χ2=8.838,P=0.003),提示PCDH10在DLBCL组织中低表达。
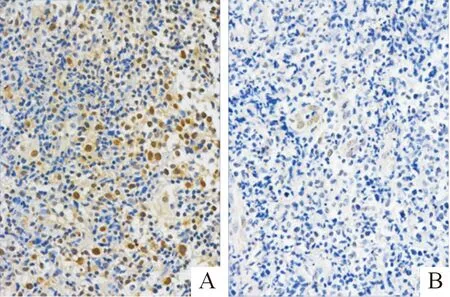
A:炎性组PCDH10高表达;B:DLBCL组PCDH10低表达
2.2DLBCL组织中PCDH10的表达与患者临床病理特征之间的关系DLBCL组织中PCDH10的表达与LDH水平、Ki-67表达水平、Ann Arbor分期和IPI有关(P<0.05),而与患者性别、年龄、有无骨髓侵犯均无关(P>0.05)(表1)。
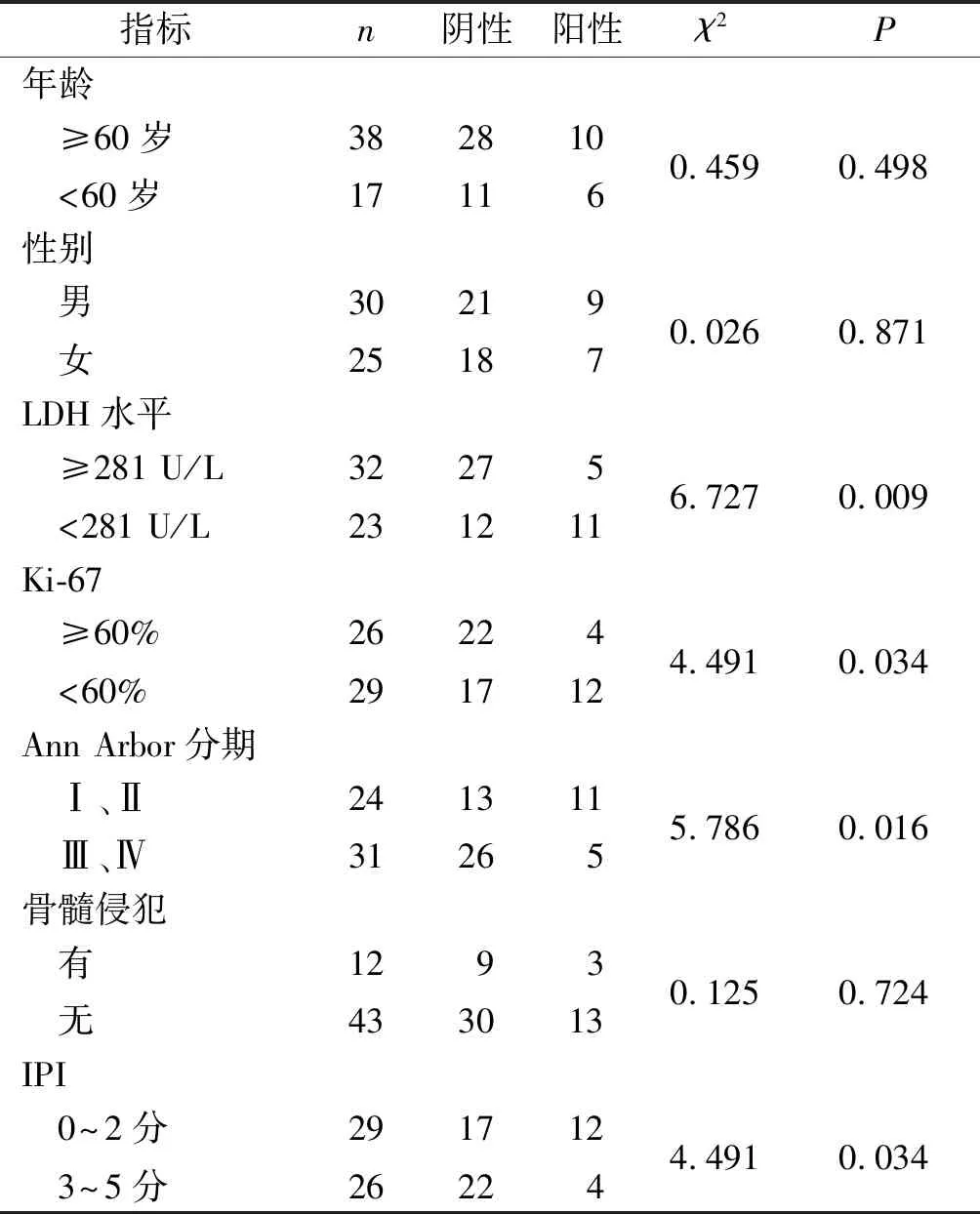
表1 PCDH10的表达与DLBCL患者一般和临床指标之间的关系 例
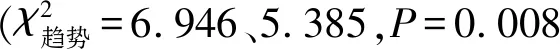
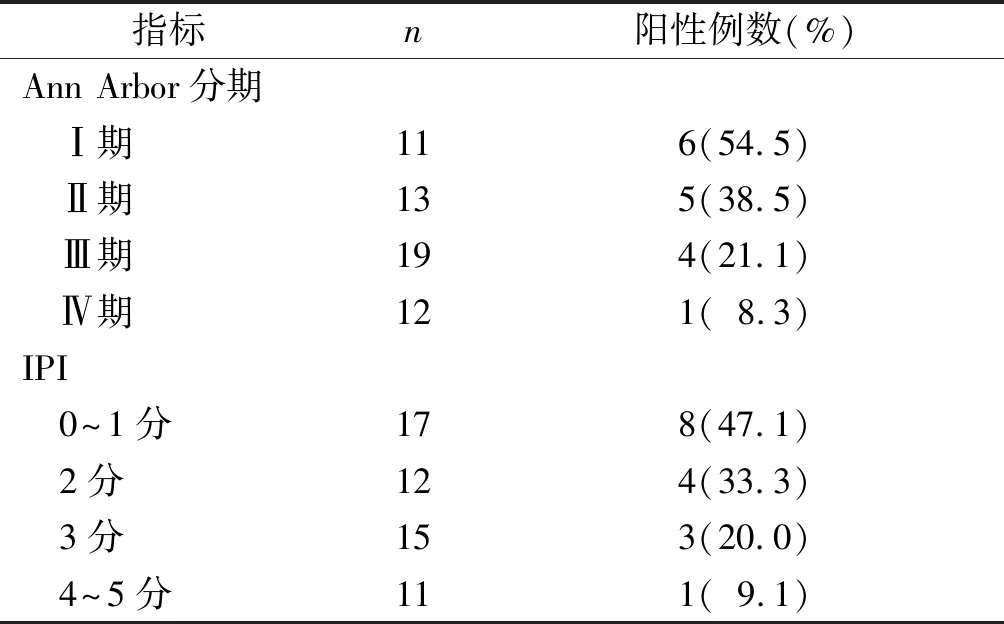
表2 不同Ann Arbor分期和IPI患者DLBCL组织中PCDH10表达的变化
3 讨论
PCDH10基因又称OL-protocadherin(OL-PCDH),位于4q28.3,其编码的PCDH10蛋白属于非聚集原钙黏蛋白家族δ2型,是一种钙黏蛋白相关的跨膜蛋白,广泛表达于成人和胎儿组织中,在细胞-细胞连接、细胞迁移和轴向引导等方面发挥重要作用[14]。早期研究[15-16]发现,PCDH10是与自闭症相关的候选基因,在自闭症的形成中发挥重要作用。
研究发现,PCDH10在子宫内膜癌[17]、胃癌[18]、乳腺癌[5]等癌组织中低表达,在肿瘤发生发展中发挥抑癌基因作用,且PCDH10可以通过调控PCDH10-DEPDC1-caspase调控轴激活caspase凋亡信号通路促进肿瘤细胞凋亡[17]。研究[19]报道,肝癌患者PCDH10低表达与高TNM分期、较大肿瘤尺寸等病理特征之间具有显著相关性。本研究结果显示,DLBCL组织中PCDH10蛋白的表达低于增生淋巴结组织,提示其可能发挥抑癌基因功能而参与DLBCL的发生。此外,PCDH10在Ann Arbor分期Ⅲ、Ⅳ期组织中的表达低于Ⅰ、Ⅱ期,且PCDH10阳性表达率随Ann Arbor分期进展呈下降趋势,提示PCDH10低表达可能参与了DLBCL的恶性化进展过程。PCDH10可以与Nap1/WAVE1相互作用形成PCDH10/Nap1/WAVE1复合物从而调节细胞迁移[14],DLBCL中PCDH10表达异常可能会导致其调节细胞迁移功能紊乱而加速疾病恶性化进程。
此外有研究指出,PCDH10低表达可作为预测肝癌[19]、胃癌[20]、肺癌[21]患者不良预后的指标。本研究显示,PCDH10阴性表达的DLBCL患者普遍具有较高LDH水平、Ki-67和IPI等不良预后指标,且PCDH10阳性表达率随IPI增加呈下降趋势,提示其低表达可能与DLBCL不良预后相关。另据文献[22]报道,PCDH10是一种人端粒酶逆转录酶(human telomerase reverse transcriptase,hTERT)相互作用蛋白,其与hTERT相互作用并通过负调节端粒酶活性来发挥抑癌作用,因此推测DLBCL中PCDH10表达异常可能会导致肿瘤细胞端粒酶活性失调从而促进患者不良预后的发生。
综上所述,PCDH10在DLBCL组织中低表达,与肿瘤细胞恶性行为及不良预后有关,可能作为抑癌基因参与DLBCL的发展。检测PCDH10有望为DLBCL患者病情评估及预后分析提供帮助,在DLBCL发病机制研究和临床诊疗中具有潜在价值。
