急进高原对人体循环系统机能的影响
2020-12-17马进举仓宝成娄云霄毛学超孙庆国陈圆圆丁在亮孙立东
马进举,仓宝成,岳 玮,娄云霄,陈 涛,毛学超,孙庆国,陈圆圆,丁在亮,杨 明, 孙立东,谢 峻
1)联勤保障部队第九八八医院开封医疗区神经内科 河南开封475003 2)联勤保障部队第九八八医院卫勤处 郑州 450007 3)联勤保障部队第九八八医院科训办 郑州 450007 4)联勤保障部队第九八八医院开封医疗区急重症医学科 河南开封475003 5)联勤保障部队第九八八医院全军精神疾病防治研究所精神科 河南焦作 454003 6)联勤保障部队第九八八医院开封医疗区心胸外科 河南开封475003 7)联勤保障部队第九八八医院开封医疗区检验科 河南开封475003 8)联勤保障部队第九八八医院开封医疗区护理部 河南开封475003 9)解放军95982部队卫生连 河南开封 475000 10)联勤保障部队第九八八医院 郑州 450007
当快速从平原地区进入高原地区(海拔≥2 500 m)[1],由于低压低氧等环境因素的作用[2],机体会出现一系列症状,如头痛、头晕、恶心、呕吐、腹泻、心率增快等[3],影响人体机能的正常运转,可发展为急性高原反应(acute mountain sickness,AMS),极少部分人甚至会发展成高原脑水肿(high altitude cerebral edema,HACE)[4]或高原肺水肿(high altitude pulmonary edema,HAPE)[5],威胁生命。本文从循环系统变化特点以及HAPE和HACE等急性重症高原病的发病特点及机制等方面,阐述急进高原对人体机能的影响,并简单介绍常见的AMS预防药物。
1 急进高原对循环系统的影响
急进高原会因低压低氧对人体的循环系统产生重要影响(图1[6])。对于心率的影响,文献[7-10]报道的结果比较一致,认为急进高原后心率会明显增快。这是由于缺氧导致动脉血氧饱和度降低,通过外周化学感受器激活交感神经,从而使心率增加。但对于血压影响的认识分歧比较大,这可能是由于血压的调节机制更加复杂。经典生理学认为在模拟高原(急性缺氧)环境中,尽管由于心率增加导致心排出量增加,但每搏输出量未发生明显变化,且急性缺氧直接导致体循环血管舒张,外周血管阻力下降,因此血压可无显著变化[11]。但在真实高原环境中,影响血压的因素会更多,如寒冷、运动、心理压力、饮食等[12]。时明远等[13]分析了100名健康青年男性在平原(海拔40 m)和急进高原(海拔2 780 m)后24 h的心率和血压变化,结果显示,与身处平原相比,急进高原24 h后,受试者平均心率、最大心率及最小心率均明显增快;收缩压和舒张压也显著升高,且白昼舒张压升高更明显,认为可能原因为血液浓缩使血液黏滞性增加,从而导致外周阻力增大,致使舒张压升高更明显。杨兵等[9]认为高原海拔越高,血压升高越明显。国外也有研究[14]结果显示随着海拔升高,血压会明显增高,但在海拔5 400 m时,夜间血压升高更明显;在低压低氧环境中,外周化学感受器介导交感神经激活,血浆浓度增加的主要是去甲肾上腺素,而非肾上腺素。但金海英[10]对186名新兵急进高原(海拔3 380 m)训练的研究发现,研究对象第1、3、5、7天的心率明显加快,但血压无明显变化;认为可能心排出量、每搏输出量减少抵消了心率和外周阻力增加对血压的影响。国外有研究[15]发现急进高原第1天尿量增加,可导致血容量和每搏输出量减少。因此从血流动力学角度看,外周阻力增加对血压的影响至关重要。急进高原后,随着交感神经的激活,最初由低氧导致的体循环血管舒张作用逐渐失去主导作用,因而血压增高;而随着肺通气量增加,血氧饱和度会进一步提高,血压则随之下降[16]。因此,高原条件下血压的影响因素较多,具体调节机制仍需进一步探讨。
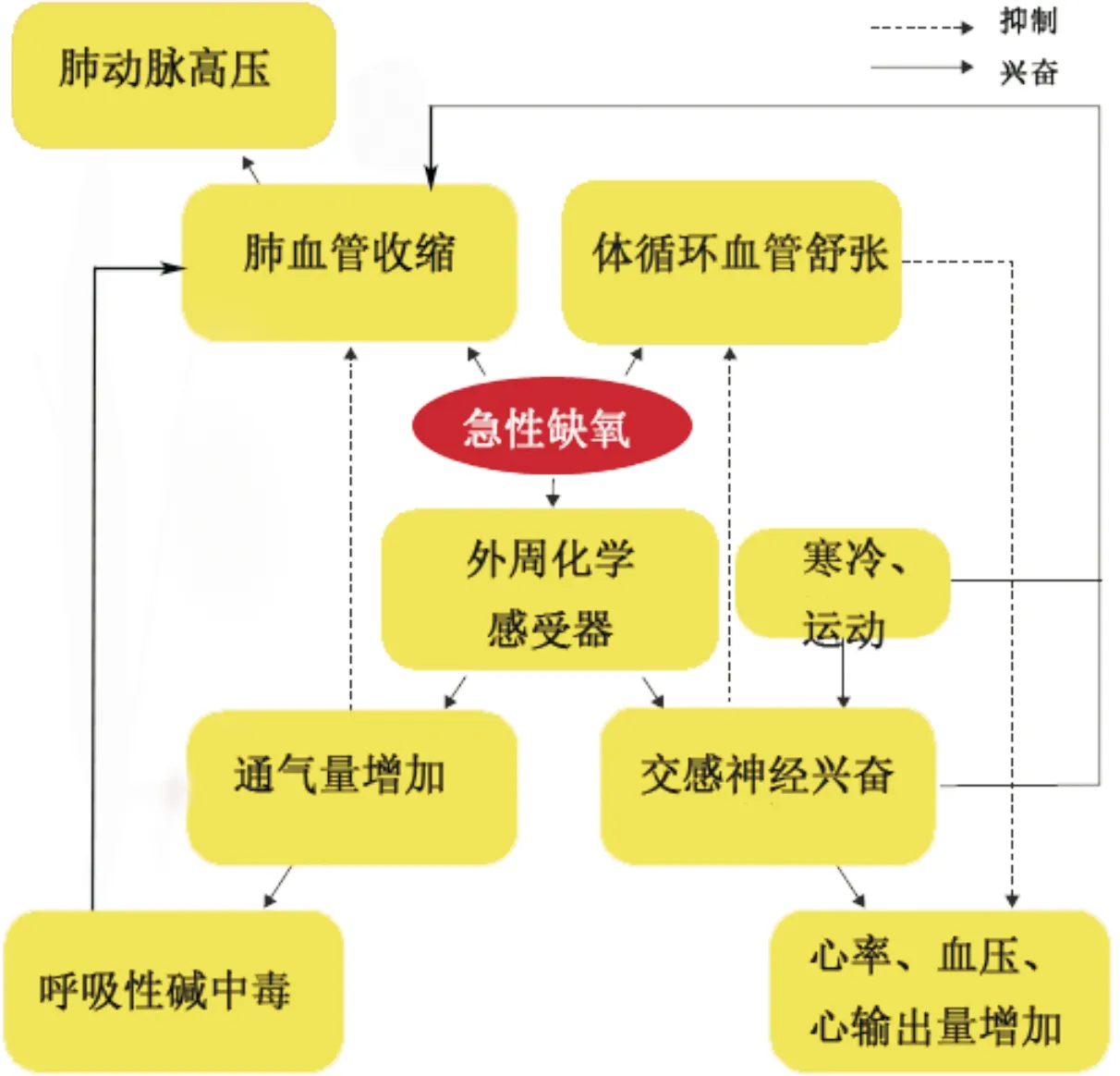
图1 高原地区机体循环系统的调节机制
2 HAPE
HAPE是指从平原快速到达海拔2 500 m以上的高原时,因低压缺氧引起的一种高原特发性疾病[17],通常在急进高原1~5 d内发病[18-19]。HAPE的发病与进入高原的速度和个人易感性密切相关。有研究[20]发现,在急进海拔3 600 m的高原后,HAPE发病率约为1.9%,随着海拔的升高,发病率也相应增加。据报道[19,21]在一般人群中,当从平原缓慢(超过3 d)进入到海拔4 000~5 000 m的高原,HAPE发病率小于0.2%;但如果1 d内从平原到达上述高度的高原,HAPE发病率可高达7%;并且,有HAPE病史的个体再次进入高原,HAPE发病风险高达60%。早期的主要症状有轻度咳嗽、劳累性呼吸困难、胸闷、劳动力下降等,随着水肿的进展,咳嗽和呼吸困难会进一步加重,演变为端坐呼吸并伴有粉红色泡沫痰,体格检查会发现口唇发绀、呼吸急促、心动过速、低热等[22];影像学检查示肺部斑块状、结节状改变[23];若不及时治疗,将进一步加重,最终发生HAPE或HACE。动脉氧分压和氧饱和度可反映HAPE严重程度。张月琴等[24]报道了60例HAPE患者(海拔2 200 m左右),根据胸片渗出程度分为轻度、中度和重度,入院时动脉氧分压均值分别为59.30、52.05和43.22 mmHg(1 mmHg=0.133 kPa),差异具有统计学意义。国外研究[21]报道在海拔4 559 m条件下HAPE患者的动脉氧分压均值约为20 mmHg,血氧饱和度小于50%;而健康对照的动脉氧分压则是35~45 mmHg,血氧饱和度在70%~85%。
HAPE的具体发病机制尚不明确,许多研究[25-26]显示其与肺动脉高压有密切联系。近年来发现,炎症反应在HAPE的形成过程中发挥了重要作用。高钰琪等[27]认为低氧可直接诱导内皮细胞中细胞黏附分子基因的转录激活,增强血管内皮细胞和循环炎症细胞的相互作用,在肺血管周围形成促炎微环境,增加炎症因子的表达,进一步介导或促进肺血管收缩乃至肺血管结构改建。在低氧刺激时大部分应激反应由低氧诱导因子(hypoxia inducible factor,HIF)介导[28]。HIF-1α 与HIF-1β形成二聚体进入细胞核内,与靶基因启动子上的低氧反应元件(hypoxia response elements,HRE) 结合,发挥转录调控作用,从而参与一系列的细胞低氧应激反应。
此外还有多种细胞因子和炎症因子,如NO、内皮素-1、血管内皮生长因子(vascular endothelial growth factor,VEGF)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-6、IL-8等[29-34],都参与了HAPE发病过程。
对HAPE的治疗最直接有效的方法是下降到低海拔地区(至少下降1 000 m),但对于中重度及无法立即下降的患者,通过补氧(利用便携式高压氧仓或持续正压通气效果更佳)使动脉血氧饱和度大于90%可明显缓解症状[4,35]。
在药物治疗上,硝苯地平和磷酸二酯酶抑制剂(如西地那非、他达拉非等)可降低肺动脉压力,利尿剂、地塞米松等具有抗炎、减轻水肿的作用,氨茶碱、纳洛酮以及一些中药制剂(红景天、银杏叶、丹参等[35])也有一定治疗作用。上述治疗HAPE的药物主要是依据个案报道、小样本临床观察、临床经验和药物本身作用机制等。除此之外一些新的治疗药物正在研究中。栾飞等[36]发现藏药螃蟹甲对HAPE模型大鼠具有一定的保护作用。NO一直是研究的热点,据报道[37]吸入低剂量NO可以舒张支气管肺血管,使肺动脉压降低,从而减轻肺水肿,但吸入过量NO则会引发毒性效应。由17个特殊氨基酸组成的TNF凝集素样结构域多肽(如AP301、索那地特) 有望成为治疗HAPE的一种新型药物,动物实验及相关研究表明其具有抑制肺水肿形成和抗炎的作用[38]。另外可以通过比较HAPE患者和健康者的基因和蛋白,筛选出相关易感因子,确定其发病过程的关键环节,以此来寻找、设计合适的治疗药物。
3 HACE
HACE也是高原急危重症,由于极为少见,发病率不是很确切[39],据报道在海拔3 500~5 500 m条件下其发病率为0.1%~2.0%[40]。也有研究者[1,41]认为HACE是AMS的最极端形式。早期常见的症状可能仅为头痛和呕吐。HACE的典型症状为躯干共济失调和意识模糊,若治疗不及时,可在24 h内死亡。Church等[42]报道了2例HACE患者,1例为16岁女孩,进入高原前1周有上呼吸道感染病史,进入高原时已痊愈;坐车在1 d内从海拔759 m到达3 500 m,且又1 d内徒步到达3 800 m,期间出现轻度食欲不振、恶心、头痛,到达3 800 m后出现持续头痛、呕吐、头晕、睡眠障碍,并伴有共济失调步态和指鼻试验阳性。另一例为12岁男孩,坐车到达海拔2 600 m,3 d后到达4 500 m,过程中感觉良好,但到达4 500 m后出现头痛和恶心,并出现视力模糊,下降到4 200 m给予口服乙酰唑胺,但当天晚上出现步态“摇摆不定”等HACE特征性表现。
HACE具体发病机制不详,国外研究[43]显示在海拔4 500 m高原时,受试者不管是否有AMS症状,脑脊液压力都正常,但脑体积(MRI评估)少量增加。脑体积增加原因一为脑血流量增加,另一原因为细胞水肿。一项研究[44]将12名受试者暴露于模拟低氧环境(FiO2=0.12,相当于海拔4 400 m)中22 h,最后有10名受试者完成试验;MRI结果显示在最初6 h内,大脑中动脉直径和血液流速增加以维持大脑氧输送,但并不显著;22 h后脑深静脉体积明显减小,脑白质体积明显增加,并与高原反应症状评分相关。这表明,脑静脉回流受限是脑水肿形成的重要因素。另外,HACE发病可能与血脑屏障损害有关,也与多种细胞因子、炎性因子表达增加有关,如S100B、基质金属蛋白酶-9(matrix metalloproteinase-9)、水通道蛋白4(aquaporin 4)及IL-6等[45]。Yang等[34]将创伤性颅脑损伤模型小鼠分成两组,分别置于低氧环境(FiO2=15.1%)和正常氧环境(FiO2= 21%)30 min,低氧环境组部分小鼠给予IL-6抗体;结果显示创伤性颅脑损伤会破坏血脑屏障,而短暂缺氧会加剧脑损伤小鼠的全身性和脑部炎症,IL-6抗体可明显减轻炎症反应,提示IL-6在缺氧导致的脑损伤中发挥重要作用。
虽然HACE发病率较低,但病死率高,大多数临床研究都是个案报道。由于高原地区脑水肿小鼠模型较难建立,导致许多研究进展缓慢或无法完成。国外研究[46]主要招募受试者到达高海拔地区或者在高原舱中进行试验,国内[47]主要尝试在高原舱中建立稳定的大鼠脑水肿模型并进行发病机制及干预措施的研究。下一步主要研究方向仍然是HACE发病的分子机制。HACE的治疗与HAPE类似,非药物治疗包括补氧和下降海拔,药物治疗包括乙酰唑胺和糖皮质激素等,脱水药物(甘露醇、甘油果糖、高渗盐、人血白蛋白)对HACE有一定疗效[4,48]。邹驰等[49]的研究说明天麻素对模拟高原缺氧大鼠脑组织损伤有保护作用。
4 AMS的预防措施
习服是预防高原反应最好的措施,阶梯习服[50]和低氧预适应[51]都是较好的方法。在人类进入高原前需要提前进行AMS风险评估,主要根据上升速度及既往病史进行评估(表1[52-53])。张来平等[54]研究发现,平原条件下左室舒张末期内径对AMS具有预测价值。除此之外心理因素、寒冷及生活地海拔等也与AMS的发生相关[55],过于紧张焦虑或无所谓态度、缺乏保暖及原居住地海拔较低等人群进入高原后易发生AMS,但对于这些因素尚缺乏大样本系统性分析。当需快速执行任务,如抢险救灾、对敌作战等,习服明显不合适,此时需要提前服用一些抗高原反应药物来预防。AMS的常用预防药物见表2,表中药物的作用机制已有许多报道,需根据实际情况使用,注意适应证及禁忌证。

表1 AMS风险等级评估

表2 常用AMS预防药物
5 总结
急进高原会对人体的循环系统产生重要影响,使心率加快,海拔高度、寒冷、运动等都会对血压产生影响,严重时会发生HAPE或HACE等急重症高原疾病。目前对于急性高原疾病的研究比较分散,需要大样本的前瞻性研究来确定其主要危险因素,并制定相应的干预措施。对AMS的风险评估应结合海拔升高速度、有无高原反应病史、原居住地海拔及心理状况、寒冷等多方面因素综合考虑。多种细胞因子和炎症因子参与了急重症高原疾病的发病过程,需要进一步探讨急重症高原疾病发病机制和主要环节,寻找客观的生化标志物来筛选出易感人群,并通过研发靶向药物来预防和治疗,保障急进高原人群的身体健康。
