沙蟾毒精诱导人结肠癌细胞凋亡和自噬的体外研究※
2020-12-16陈进宝邱艳艳王海静吴文韬吴宏磊贾琳琳殷佩浩曹亦军
陈进宝 徐 可 邱艳艳 王海静 吴文韬 吴宏磊 贾琳琳 李 炜 殷佩浩 曹亦军
(上海中医药大学附属普陀医院普外科,上海 200062)
结肠癌是临床较为常见的消化道恶性肿瘤之一,据相关研究显示其发病率与死亡率均位居前列[1]。目前,临床对于结肠癌的治疗是以外科手术为主,结合放化疗、中药治疗及免疫治疗的综合性治疗。化疗是结肠癌最常见的治疗方案之一,但化疗对患者身体的伤害导致其应用有很大的局限性,且对患者造成一定的经济负担,因此迫切需要寻求一种温和有效的药物治疗方法。
中药具有多靶点治疗等特点,在抗肿瘤方面具有一定优势,可用于肿瘤进展的多个时期。目前,越来越多的研究开始关注某些中药的抗肿瘤作用[2]。蟾酥是中华大蟾蜍或黑框蟾蜍耳后腺及表皮腺体分泌物的干燥成分[3],相关研究已经证实蟾酥的相关活性成分的抗肿瘤作用,临床用于治疗肺癌、结肠癌等多种恶性肿瘤[4-5]。沙蟾毒精为蟾毒内脂类成分之一,研究证实沙蟾毒精对非小细胞肺癌细胞系PC-9具有明显的抑制和促凋亡作用,并且这一作用可能是通过线粒体途径诱导的[5]。此外,沙蟾毒精还可通过Bax-PGAM5L-Drp1复合物介导内源性凋亡,抑制结直肠癌的生长和转移[6]。自噬是细胞中重要的降解系统,其主要作用是将包裹的内容物进行降解,进一步达到一些更新与内环境稳定的作用[7-8]。在肿瘤研究中自噬所起的作用尚不明确。有相关研究表明,细胞的自噬水平可由一些分子和蛋白质(LC3、Beclin1、P62)在一定程度上反映与体现[9]。越来越多的研究表明,自噬可以为肿瘤细胞提供营养以维持其生存,但同时自噬可能被过度激活,导致肿瘤细胞发生自噬性死亡,从而为肿瘤的治疗提供了新方法[10-11]。沙蟾毒精对肿瘤细胞自噬的作用仍不清楚,因此本研究通过体外实验研究沙蟾毒精对人结肠癌HCT116细胞和SW620细胞增殖和自噬的影响,对其可能的分子机制进行初步探讨,从而为沙蟾毒精用于抗肿瘤的治疗提供理论和实验依据。
1 材料与方法
1.1 细胞株 人结肠癌HCT116、SW620细胞株,购自中国科学院上海细胞生物学研究所。
1.2 药品、试剂及耗材 沙蟾毒精,规格:每支20 mg,批号464-74-4,购自成都瑞芬思生物科技有限公司(称取一定量的沙蟾毒精,根据分子量计算,使用二甲基亚砜溶解后加入灭菌双蒸水,用枪头轻柔混匀,配制成母液,根据实验需要稀释为不同浓度);青霉素/链霉素双抗溶液、胎牛血清、RPMI1640培养基、DMEM培养基、胰酶消化液(Trypsin-EDTA),购自美国Gibco公司;微管相关蛋白1轻链3(LC3)抗体、β-肌动蛋白(β-actin)抗体、自噬相关蛋白(P62)抗体,购自英国Abcam公司;雷帕霉素靶蛋白(mTOR)抗体、磷酸化雷帕霉素靶蛋白(P-mTOR)抗体、酵母Atg6同系物(Beclin-1)、B淋巴细胞瘤-xl(Bcl-xl)抗体,购自美国CST公司;细胞计数试剂盒8(CCK-8)(CK04-10000tests),购自东仁化学科技(上海)有限公司;电致化学发光液(ECL)(WBKLS0500),聚偏二氟乙烯膜(PVDF),购自美国Miliipore公司;凋亡抗体(Annexin V-FITC和PI-556547),购自美国RD公司;蛋白裂解液RIPA(P0013B),购自上海碧云天生物技术有限公司;3-甲基腺嘌呤(3-MA),购自德国Sigama公司。
1.3 仪器 BioRad-680多功能酶标仪,购自美国Bio-Rad公司;FACSCalibur流式细胞仪,购自美国BD公司;165-8001垂直电泳系统及170-3930转印系统,购自美国Bio-Rad公司;Gel-DocEQ化学发光成像仪,购自美国Bio-Rad公司;Leica Dmi1倒置显微镜,购自德国徕卡公司。HERAcell 240i CO2恒温培养箱,购自美国Thermo Fisher Scientific公司。
1.4 细胞培养 人结肠癌SW620细胞复苏使用DMEM培养基,HCT116细胞复苏使用RPMI1640培养基,两者培养基中均含有1%青霉素/链霉素双抗溶液、10%胎牛血清,置于细胞培养箱中进行恒温培养(37 ℃,5%CO2)。待细胞生长至70%左右的对数生长期时,磷酸盐缓冲液(PBS)清洗,培养瓶中加入0.5~1 mL胰酶消化后,镜下观察消化状态,加入培养基终止后收集液体至离心管,1 200 r/min离心5 min进行传代继续培养。细胞经过2次传代后取生长状态良好的细胞进行后续实验。
1.5 观察指标及方法
1.5.1 CCK-8检测细胞活力 2块96孔板分别接种HCT116细胞和SW620细胞,100 μL/孔(约1.3×105个/mL),第2 d贴壁后去除原培养液,2块板分别加入含不同终浓度(0、25、50、100、200 nM)的沙蟾毒精培养液100 μL,将2块96孔板置于细胞培养箱中分别培养不同时间(24、48、72 h),同时设置空白对照孔(比色时主要用于空白孔调零),每个浓度设置6个平行样本。加入CCK-8试剂配置液体,置于细胞培养箱中继续培养1~2 h,通过酶标仪测定进行细胞活力的计算。
1.5.2 流式细胞术检测细胞凋亡 2块6孔板中分别接种SW620细胞与HCT116细胞,2 mL/孔,细胞接种密度为2.5×105个/mL,6孔板各孔分别加入0、25、50、100 nM浓度的沙蟾毒精,每个浓度设3个复孔。细胞在含不同浓度沙蟾毒精的细胞培养液中培养48 h后,各孔PBS洗后滴加胰酶进行消化,并用完全培养基进行终止后收集细胞悬液,1 000 r/min离心5 min,将上清吸出丢弃,加入2 mL PBS重悬,1 200 r/min离心5 min,加入2 mL PBS重悬转移至流式细胞管,离心后将上清弃掉,弹匀细胞,加入流式抗体Annexin V-FITC和PI各5 μL,室温用锡纸包裹进行避光孵育15~20 min,加入PBS 2 mL,用枪头轻轻混匀后,1 000 r/min离心5 min,离心结束后将上清去掉,加入PBS 500 μL重悬后上机,通过细胞流式仪检测各处理条件下的细胞凋亡率。
1.5.3 倒置相差显微镜观察细胞形态学变化 2块6孔板中分别接种SW620细胞与HCT116细胞,2 mL/孔,细胞接种密度为2.5×105个/mL,分为空白对照组和沙蟾毒精干预组。待贴壁后沙蟾毒精干预组分别加入浓度为50 nM与100 nM沙蟾毒精培养液,分别继续培养48 h后,采用倒置相差显微镜观察各组细胞的形态学改变。
1.5.4 蛋白免疫印迹法(Western Blotting,WB)检测自噬与凋亡相关蛋白表达 将生长良好的HCT116细胞和SW620细胞分别接种于3块6孔板,细胞计数为2.5×105个/mL,第2 d贴壁后去除原培养液,2块板分别单独加入含100 nM的沙蟾毒精培养液2 mL/孔,将2块6孔板置于细胞培养箱中培养48 h后收集细胞。此外,再次按照上述的铺板密度接种于2块6孔板,分别加入含10 mM的3-MA试剂的培养液2 mL、含10 mM的3-MA+100 nM沙蟾毒精培养液2 mL及培养液(空白组),置于细胞培养箱中培养48 h后收集细胞。使用PBS对各孔细胞清洗2次,加入RIPA裂解液及蛋白酶抑制剂等提取各组蛋白,4 ℃,13 000 r/min离心25 min,然后吸取上清液,切勿吸到底部。每组蛋白浓度用BCA法进行测定。金属浴上蛋白变性10~15 min后,取蛋白20 μg上样进行电泳。电泳结束后通过湿转法将蛋白转移到0.45 μm的PVDF膜上,在室温下用配制的5%脱脂牛奶封闭1~2 h,加入一抗(根据各自说明书进行稀释),4 ℃环境下孵育过夜。第2 d用TBST缓冲液洗膜,摇床上每次洗膜10 min,洗3次,加入相应的二抗(根据各自说明书进行不同比例稀释)于室温孵育1 h,摇床上每次洗膜10 min,洗3次,用ECL显色,并在凝胶成像系统上成像与拍照。β-actin作为内参,用ImageJ软件进行结果分析。
1.6 统计学方法 采用SPSS 21.0软件进行相关数据的统计分析,如果数据符合正态性和方差齐性,采用单因素方差分析检验,组间多重比较采用最小显著差法(LSD)检验;多样本均数多因素比较采用析因设计方差分析;如果数据满足正态性,但不满足方差齐性,采用Welch检验;如果数据不满足正态性和方差齐性,采用秩和检验。标准为α=0.05,P<0.05为差异有统计学意义,P<0.01为差异极有统计学意义。
2 结 果
2.1 不同浓度沙蟾毒精对人结肠癌HCT116、SW620细胞凋亡的影响 见表1,封3图1。
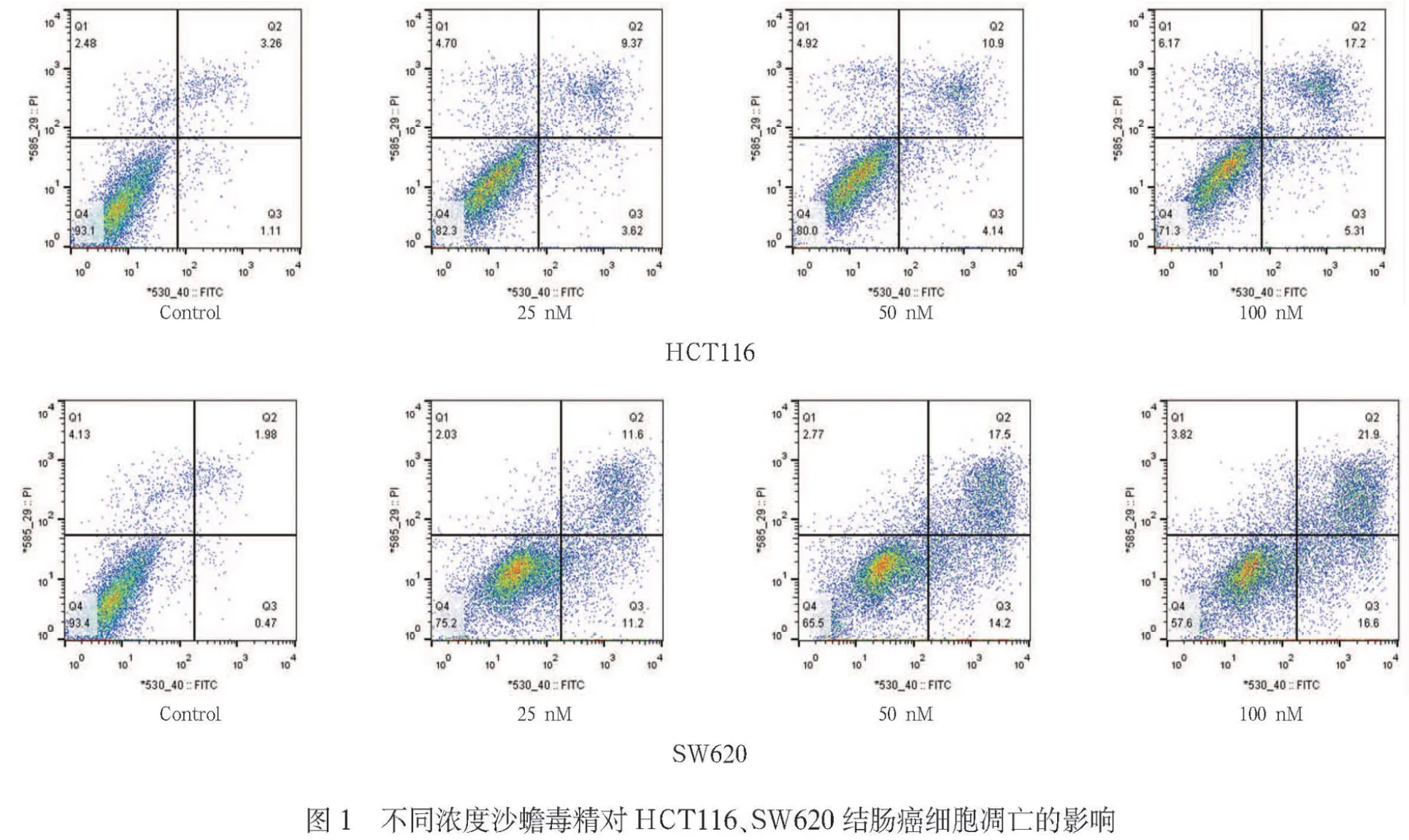
表1 不同浓度沙蟾毒精对人结肠癌HCT116、SW620细胞凋亡的影响
由表1可见,不同浓度(25、50、100 nM)的沙蟾毒精处理细胞48 h后,HCT116与SW620结肠癌细胞凋亡率均有所增加(P<0.05,P<0.01)。
2.2 沙蟾毒精对人结肠癌HCT116、SW620细胞活力的影响 见表2。
表2 沙蟾毒精对人结肠癌HCT116、SW620细胞活力的影响
由表2可见,结肠癌HCT116细胞与SW620细胞在不同浓度(0、25、50、100、200 nM)及不同时间(24、48、72 h)的沙蟾毒精处理后,沙蟾毒精以剂量依赖性及时间依赖性的方式抑制结肠癌细胞增殖(P<0.05,P<0.01)。
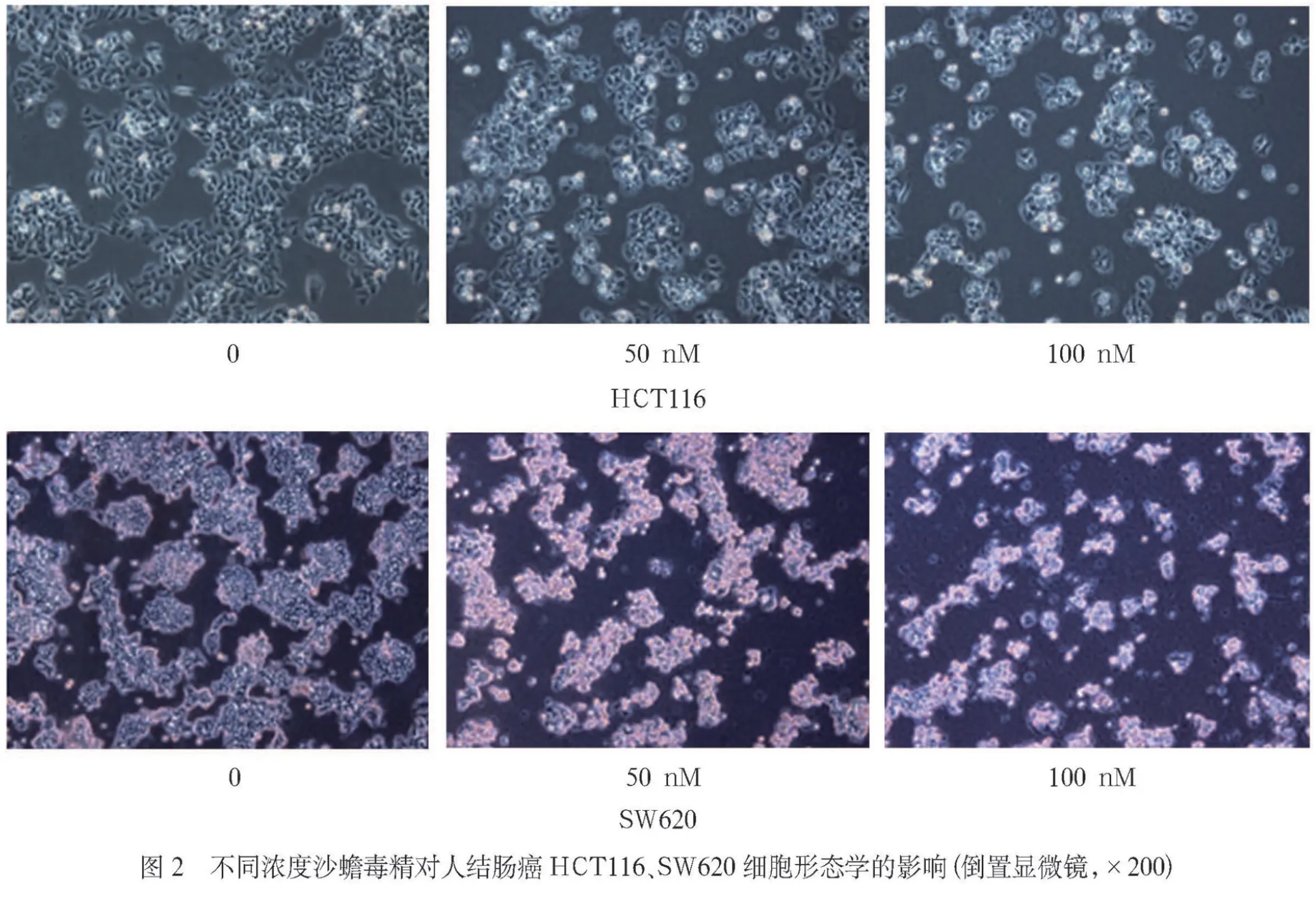
2.3 沙蟾毒精对人结肠癌HCT116、SW620细胞形态学的影响 镜下观察发现,仅加入培养液的空白对照组细胞生长状态较佳,细胞与细胞之间呈现紧密连接的状态。与空白对照组比较,50 nM、100 nM沙蟾毒精干预组HCT116细胞和SW620细胞增殖水平受到一定程度的抑制,细胞数量显著减少,连接分散,各细胞之间间隙增大,一些细胞的形态发生改变,形态不规则,并且贴壁能力有所下降(见封3,图2)。
3.4 沙蟾毒精对人结肠癌HCT116、SW620细胞相关蛋白表达水平的影响,见图3、表3。

图3 沙蟾毒精对人结肠癌HCT116、
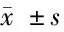
表3 沙蟾毒精对人结肠癌HCT116、SW620细胞相关蛋白表达水平的影响
由表3可见,与0浓度比较,100 nM沙蟾毒精组HCT116、SW620细胞Beclin-1、LC3-Ⅱ蛋白表达升高(P<0.01),P62、Bcl-xl、P-mTOR蛋白表达水平降低(P<0.05),而总蛋白mTOR的表达水平无明显改变(P>0.05)。
2.5 沙蟾毒精与3-MA联合后对人结肠癌HCT116、SW620细胞自噬相关蛋白的影响,见图4,表4。
图4 沙蟾毒精与3-MA联合后对人结肠癌HCT116、
表4 沙蟾毒精与3-MA联合对人结肠癌HCT116、SW620细胞自噬相关蛋白的影响
由表4可见,与空白组比较,加入3-MA后LC3-Ⅱ蛋白表达水平降低(P<0.05),P62蛋白表达水平升高(P<0.05,P<0.01)。与沙蟾毒精组比较,沙蟾毒精+3-MA组LC3-Ⅱ蛋白表达水平降低(P<0.05,P<0.01),P62蛋白表达水平升高(P<0.01)。
3 讨 论
结直肠癌是常见的恶性肿瘤之一,目前在中国男性和女性的发病率分别排名第4位及第3位。早期结肠癌一般通过手术治疗,但较多的结肠癌患者就诊时已处于中晚期,需进行姑息治疗,使得患者5年生存率明显下降[12]。化疗和放疗作为治疗结肠癌的重要手段,在其发挥控制与治疗肿瘤的同时,也会对患者造成较为严重的不良反应,如骨髓抑制、免疫抑制等,一定程度上影响了患者的生活质量水平[13-14]。中药在抗肿瘤治疗中具有一定优势,在治疗肿瘤的过程中辅助中药治疗已成为一种趋势[2]。
研究报道,从中药蟾酥中提取的沙蟾毒精具有良好的抗肿瘤作用[14-15]。沙蟾毒精通过下调β-连环蛋白进而抑制前列腺癌上皮—间质转化和转移,此外有研究表明沙蟾毒精可通过Noxa相关途径诱导非小细胞肺癌细胞凋亡[15-16]。本研究结果显示,沙蟾毒精可显著抑制人结肠癌HCT116、SW620细胞的增殖,且呈剂量与时间依赖性,用药后细胞数量明显减少,细胞形态发生一些变化。此外,沙蟾毒精还可促进结肠癌HCT116、SW620细胞的凋亡,随着浓度的递增,凋亡细胞数量也随之增加。作为抗凋亡蛋白之一的Bcl-xl,可形成异二聚体,从而阻止细胞进入凋亡程序。本研究结果发现,沙蟾毒精作用于人结肠癌HCT1116、SW620细胞后,Bcl-xl表达降低,表明其可促进结肠癌细胞凋亡。
在应激条件下,自噬首先被激活,自噬体随后形成进而与溶酶体结合导致自噬溶酶体的产生,进而降解细胞内的“货物”,从而满足细胞代谢和内部环境稳定性的需求等[17]。随着对自噬相关研究的深入,自噬在肺癌的发生与发展中发挥着越来越重要的作用[18]。此外也有研究表明,妇科恶性肿瘤的发生发展与自噬的发生及改变密切相关[19]。在自噬发生的早期,适度的自噬能够保护细胞免受外部损害并继续存活,而当外部环境较恶劣时,细胞过度自我吞噬时会造成自噬死亡。某些基因可调控细胞自噬过程,其中Beclin-1调节自噬过程中吞噬泡的形成,为检测自噬的常用指标之一[20-23]。LC3是参与自噬调节的另一个关键基因,发生自噬时,LC3-Ⅰ可转变为LC3-Ⅱ,自噬泡的数量与LC3-Ⅱ的含量成正比。P62是一种多功能信号分子,由原癌基因C-myc编码,随着细胞自噬水平的不断增高,P62会不断被消耗;而自噬活性受到抑制时,P62会不断积累,可在一定程度上用于评估细胞的自噬水平[24]。本实验结果表明,沙蟾毒精能上调结肠癌细胞内Beclin-1和LC3-Ⅱ蛋白表达,同时下调P62蛋白表达。3-MA是一种自噬发生的抑制剂,能够抑制自噬体的形成[25]。本研究结果证实,与沙蟾毒精单独处理组比较,沙蟾毒精+3-MA联用组的LC3-Ⅱ蛋白表达水平下调,P62表达水平升高,说明沙蟾毒精诱导人结肠癌HCT116、SW620细胞发生的自噬能够被3-MA逆转。证实沙蟾毒精可以诱导HCT116、SW620细胞自噬,从而进一步引发自噬性死亡,抑制细胞的增殖活力。越来越多的研究表明,中医药可以不同程度地影响细胞自噬的发生,但其相关机制仍不是非常清楚[26]。相关研究表明,自噬的发生涉及大量的基因表达和信号转导,其中mTOR途径是调节自噬的经典途径,自噬的诱导与mTOR信号通路的抑制有一定的相关性;同时该通路与结肠癌的发生发展也密切相关[27-29]。mTOR激酶作为自噬的负调控因子之一,当细胞内营养充足,mTOR可以通过抑制下游信号通路抑制自噬的发生。有研究指出,天然抗癌药物可通过mTOR信号通路诱导乳腺癌细胞及结肠癌细胞发生自噬[30-31]。本实验结果显示,沙蟾毒精处理后降低了人结肠癌HCT116、SW620细胞P-mTOR表达水平,说明沙蟾毒精可诱导自噬发生,可能是通过mTOR信号通路发挥作用。
综上所述,沙蟾毒精可诱导人结肠癌HCT116与SW620细胞发生自噬,从而抑制结肠癌细胞的增殖水平,发挥相应的抑制肿瘤作用,其机制可能与沙蟾毒精抑制mTOR信号通路相关。
