病理性瘢痕及正常皮肤中成纤维细胞CD90表达情况的研究
2020-12-16杨炳林陈昌明陈文新王合兵
杨炳林,肖 坚,陈昌明,陈文新,王合兵
(1.福建医科大学附属三明第一医院 乳腺外科,福建 三明,365000;2.福建医科大学附属三明第一医院 病理科,福建 三明,365000)
病理性瘢痕主要是指皮肤受损的患者创面异常愈合,可以分为瘢痕疙瘩和增生性瘢痕,尤其是增生性瘢痕,有潮红充血表现,患者存在瘙痒或灼痛感,往往持续数月甚至数年后才能发生变化[1]。瘢痕疙瘩呈现红褐色,质地硬,无法自愈。影响患者皮肤美观性,造成患者生活质量降低。预防病理性瘢痕需要加强发生机制研究。CD90作为糖蛋白,通过甘油二酯C末端在细胞膜胞浆面附着,组成细胞粘附结构,参与细胞增殖、凋亡、粘附等活动,达到信号传导的作用,和创面愈合有着重要作用[2]。为了研究瘢痕皮肤和正常皮肤CD90表达差异,本文于本院2019年3月~2020年3月的皮肤样本中,随机选取30例分析:
1 资料与方法
1.1 标本来源
取我院手术切除的病理性瘢痕15例,瘢痕皮肤边缘位置的正常皮肤15例,经过组织切片后,作为观察组和对照组。性别:男/女=16/14,年龄(35.27±4.19)岁。患者之间具有可比性(P>0.05)。纳入与排除标准:(1)观察组皮肤样本存在持续性发红、疼痒等症状,未经过冷冻、激光等方式治疗。供者无器官功能障碍,或者其他皮肤病。(3)对照组皮肤样本健康,无皮肤病或异常情况。
1.2 试剂和仪器
使用胰蛋白酶(美国Gibco公司)、DMEM细胞培养基(美国Gibco公司)、胎牛血清(美国Gibco公司)、α-SMA兔单克隆抗体(上海研生生化试剂有限公司)、CD90小鼠单克隆抗体(上海信裕生物科技有限公司)、Nikon生物光学显微镜(日本Nikon公司)等。
1.3 实验方法
(1)标本制备 准备正常皮肤和病理性瘢痕皮肤标本,在手术室无菌环境中切取,制作为1cm×1cm×1cm的标本。
(2)病理检查 切除组织后去除结缔组织,浸泡福尔马林48h,制作3mm×3mm×3mm的标本组织,浸蜡包埋。使用酒精和二甲苯脱蜡入水。使用蒸馏水清洗,使用明矾苏木素进行染色,8min后清洗浮色。添加1%盐酸分色,冲洗半小时后,使用氨水清洁一次。添加0.5%伊红溶液进行染色3min,使用清水清洁浮色。使用酒精脱水后,分化颜色,使用中性树胶进行封片处理。
(3)检测成纤维细胞CD90表达情况 手术切除后,将皮下结缔组织去除,浸泡在福尔马林中保存48h。制作为3×3×3mm的样本,浸蜡包埋,形成3μm厚度切片。在载玻片上刷涂多聚赖氨酸,将石蜡切片贴附,在60℃环境中经过2h烘烤。使用纯二甲苯进行脱蜡处理,经过水化后,反复使用PBS冲洗三次,3min/次,使用微波抗原进行修复。滴加过氧化氢甲醇液后,将过氧化物酶阻断,在常温下进行10min孵育。再次使用PBS进行三次冲洗,每次需要持续3min。添加动物血清50μl,在室温环境中进行10min孵育。将血清甩去后,添加一抗50μl进行室温孵育1h。再次使用PBS进行重复三次冲洗,持续9min。滴加抗生物素过氧化物酶,进行10min孵育,使用PBS冲洗三次,持续3min。将PBS液甩去,滴加DAB显色液,观察显色反应,观察位棕色时,细胞为阳性。停止显色反应后,使用蒸馏水进行冲洗,使用苏木素进行复染,使用盐酸分化,并使用PBS冲洗至返蓝。添加酒精脱水干燥,使用树胶封固处理。由两位资深病理科医师使用显微镜对CD90进行观察,对免疫组化结果进行评估。CD90细胞呈现出棕色为阳性。
(4)病理性瘢痕成纤维细胞培养 取标本结缔组织后进入DMEM基,转移至培养室。使用生理盐水进行反复冲洗标本,在适量DMEM培养基中切去标本,在培养瓶底摆放,添加培养液半封闭。每间隔10h翻转培养瓶。5~7d更换培养液,然后每间隔3d更换一次。选择2~3代培养细胞制作单细胞悬液,经过离心处理后去除上清液,保存在液态罐中。
(5)观察结果 使用显微镜在中倍镜视野下观察并摄像,判断蛋白表达情况。将细胞标本放置于激光扫描仪上,选择488nm紫外线波长激发FITC,543nm紫外线波长激发TRITC,405nm紫外线波长激发DAPI。计算荧光值。对单细胞进行多层次扫描,锁定目标细胞,观察细胞内表达情况。
1.4 统计学处理
采用SPSS 21.0软件处理数据,使用t和χ2检验资料,P<0.05视为差异有统计学意义。
2 结果
2.1 两组成纤维细胞CD90 表达荧光定量结果对比
对照组CD90表达荧光定量(34.19±1.53)。观察组CD90表达荧光定量(30.12±2.65)。与对照组对比,差异显著(P<0.05),详见表1:

表1 两组成纤维细胞CD90 表达荧光定量结果对比
2.2 两组成纤维细胞CD90 表达免疫组织化学染色结果对比
在15例病理性瘢痕样本中,有9例(60.0%)可以发现阳性细胞,高于正常皮肤2例(13.3%)。正常皮肤阳性细胞体积小,观察组染色结果与对照组对比,差异显著(P<0.05)。
2.3 免疫组织化学染色结果
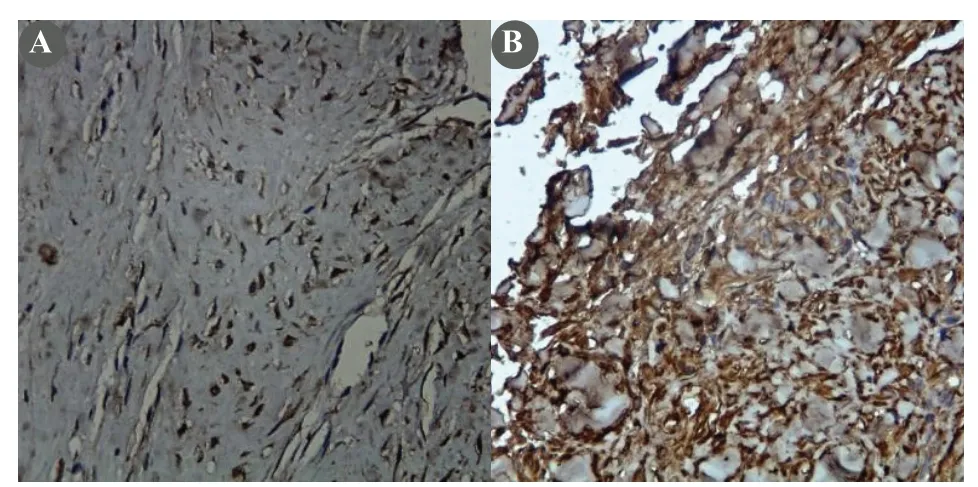
图2 A 增生性瘢痕,细胞间质可见大量粗大阳性表达,胶原排列混乱(光镜×400);B 增生性瘢痕,基层纤维细胞和新生血管均存在阳性反应细胞(光镜×400)
3 讨论
人体皮肤组织受到物理或者化学刺激后,形成缺损或者离断后,内皮细胞、炎性细胞以及成纤维细胞,能够和细胞外的基质产生作用,促进创伤的愈合[3]。创伤愈合可以分成创口收缩、形成肉芽以及覆盖上皮三阶段[4]。在创面修复形成肉芽组织阶段,发生纤维化容易产生瘢痕,对患者皮肤美观性、皮肤功能产生严重影响[5]。瘢痕形成和诸多因素有关联,如修复时间、皮肤色素、缝合技术等。从生物学角度,成纤维细胞也是形成瘢痕的主要因素,由于多种细胞因子参与创面愈合,造成愈合过程中,细胞因子会影响炎症反应时间,不利于创面愈合[6]。
瘢痕形成和细胞粘附分子有重要关系,细胞粘附分子是细胞间和细胞及基质间结合分子,通过受体-配体结合方式发挥出作用,促进细胞间、基质间形成粘附,参与细胞信号传导、增殖和分化等生理反应[7]。胞外基质和整合素相结合,能够激活信号转导分子,成纤维细胞整合素表达水平更高。CD90是最小的一种免疫球蛋白,属于粘附分子中的一种,质量约为25000[8]。通过DAG C末端附着细胞膜,组成粘附结构重要的调节结构,经过生长因子、细胞因子等,在成纤维细胞凋亡、粘附等过程中发挥作用,和创面愈合有着密切关联[9]。CD90表达为部分的成纤维细胞,目前在人体眶周细胞、肺部细胞以及子宫肌层细胞中发现了成纤维细胞。有研究通过分离小鼠的肺细胞和成纤维细胞,发现CD90存在阴性大群和阳性大群,两者发挥着重要作用[10]。可见CD90表达可以作为病理性瘢痕的特异性指标。
经本文研究,对照组CD 90 表达荧光定量(34.19±1.53)。观察组CD 90 表达荧光定量(30.12±2.65)。与对照组对比,差异显著(P<0.05)。在15 例病理性瘢痕样本中,有9 例(60.0%)可以发现阳性细胞,高于正常皮肤2例(13.3%)。正常皮肤阳性细胞体积小,观察组染色结果与对照组对比,差异显著(P<0.05)。可见在病理性瘢痕组织中,CD90表达水平明显高于正常皮肤,正常皮肤CD90表达量明显减少。
有学者提出CD90表达和α-SMA存在共表达性的特点,两者存在协同作用。受到TNF和IL-1的刺激作用,CD90阳性表达显著减少,甚至完全消失[11]。目前尚不能得出CD90表达对病理性瘢痕成纤维细胞功能造成的影响。未来还需要增加样本量,通过mRNA测定的方法明确正常皮肤和瘢痕皮肤的表达差异。本研究中使用组织芯片方法,操作便捷,实验效率高,能够控制实验质量,具有突出优势,可以广泛应用于相关研究中[12]。在临床实践中,通过皮肤样本CD90表达检测,能够初步判断形成病理性瘢痕的风险,根据检测结果提前预防,有助于降低病理性瘢痕的形成,提高治疗效果。
本研究通过免疫组织化学分析和病理学检测对病理性瘢痕成纤维细胞进行探索,为病理性瘢痕的防治建立了理论基础。未来还需要进一步探索临床防治病理性瘢痕,对皮肤创伤患者给予有效治疗,预防形成皮肤瘢痕,提高患者皮肤美观性和功能。
综上所述,成纤维细胞是病理性瘢痕的来源,存在CD90表达量多的特异性特点,通过使用组织芯片检验,可提前预防病理性瘢痕的形成,有助于改善临床疗效,减轻患者心理负担,提高整形治疗效果。
