铁死亡及其在心血管疾病中的作用
2020-12-15张静赵外荣施雯婷周忠焱陈昕琳
张静 赵外荣 施雯婷 周忠焱 陈昕琳
铁死亡(ferroptosis)是一种新型细胞程序性死亡方式,是由于细胞内铁依赖性脂质活性氧(ROS)积聚过多而发生的一种可调节性细胞死亡形式[1]。铁死亡的调节与众多机体生理过程密切相关,包括氨基酸、铁和多不饱和脂肪酸代谢等,且参与多种疾病如肿瘤、组织缺血再灌注损伤、急性肾功能衰竭和神经病变等的发生与发展[2]。铁死亡已成为药物设计和研发的重要靶点。研究表明,通过设计特定小分子物质能有效调节细胞脂质过氧化,使铁死亡成为一个可控过程[3]。铁死亡与心血管疾病也有着密切关系,本文介绍铁死亡的发生机制及其在心血管疾病中的作用。
1 铁死亡的发生机制
铁死亡的发生涉及谷氨酸-胱氨酸转运受阻、氧化应激、铁代谢异常和脂质过氧化等多种途径。这些病理过程均会产生过量的脂质ROS,超出机体的还原代谢能力,最终导致细胞发生铁死亡(见图1)。
1.1 谷氨酸-胱氨酸转运受阻
谷氨酸-胱氨酸转运体由溶质转运蛋白家族3成员2(SLC3A2)和溶质载体家族7成员11(SLC7A11)组成,广泛存在于磷脂双分子中,正常情况下细胞外胱氨酸与胞内谷氨酸在谷氨酸-胱氨酸转运体的作用下有序地进行转运交换[4-5]。胱氨酸进入细胞内转换为半胱氨酸(Cys),参与谷胱甘肽(GSH)的合成,GSH作为细胞内重要的抗氧化剂和自由基清除剂,能及时有效地清除细胞内过多的ROS。GSH是谷胱甘肽过氧化物酶(GPX)4发挥抗氧化功能所必需的辅助因子[6],当谷氨酸-胱氨酸转运体转运受阻时,胱氨酸无法进入细胞内,胞内Cys含量减少,相应的GSH合成也随之减少,使得GPX4的活性缺失,清除脂质ROS的能力下降,脂质ROS堆积,加剧了细胞铁死亡的发生。
1.2 氧化应激
氧化应激是动脉粥样硬化、心肌梗死、心律失常等心血管疾病的重要病理特征,核因子E2相关因子2(Nrf2)/血红素加氧酶-1(HO-1)轴是调节氧化应激反应的关键信号通路[7]。Nrf2增加谷氨酸-胱氨酸转运体的转运,增强GPX4的还原能力,抑制细胞铁死亡的发生。研究发现,在大鼠缺血再灌注模型中,激活Nrf2/抗氧化反应元件(ARE)信号通路,上调超氧化物歧化酶(SOD)和GPX等抗氧化物酶水平,能有效改善大鼠心脏功能,清除ROS等有害物质,减少心肌细胞铁死亡,减少心肌梗死面积[8-9]。Nrf2是脂质过氧化的关键缓解因素,HO-1、NQO1、MRP等Nrf2靶基因能介导细胞的氧化应激反应和铁代谢过程,调节谷氨酸-胱氨酸转运体和GPX4,在铁死亡中发挥关键作用[10]。因此,氧化应激在铁死亡中有重要作用,而激活Nrf2信号通路是抑制铁死亡的重要途径。
1.3 铁代谢异常(铁过载)
铁是人体重要的必需微量元素,正常人体内2分子三价铁离子(Fe3+)结合1分子转铁蛋白(Tf)形成复合物,细胞膜表面的转铁蛋白受体1(TfR1)将Fe3+转运到细胞中,细胞内还原酶将Ff3+还原为二价铁离子(Fe2+),此过程受到铁蛋白和铁调素等多种调节蛋白的影响[11-12]。铁死亡诱导剂爱拉斯汀(erastin)和RAS合成致死物3(RSL3)通过上调TfR1的表达,增加对铁的摄取,同时下调铁蛋白重链1(FTH1)和铁蛋白轻链(FTL)的表达,减少铁的储存,使大量游离铁释放[13]。机体铁代谢平衡破坏会引起一系列疾病,主要机制为细胞内Fe2+增多时,机体会通过芬顿(Fenton)反应产生大量对细胞有较强毒性的羟自由基及大量ROS,从而破坏细胞蛋白质、脂质和DNA,对细胞和组织造成损伤[14]。同时,铁也是脂质过氧化和铁死亡过程中所必须的元素。因此,铁过载会加剧铁死亡的发生,铁代谢异常是细胞铁死亡过程的重要表现。

注:SLC3A2为溶质转运蛋白家族3成员2 ;SLC7A11为溶质载体家族7成员11;System Xc-为谷氨酸-胱氨酸转运体; Tf为转铁蛋白;Cysteine为半胱氨酸;TfR1为转铁蛋白受体1;Cystine为胱氨酸;Glu为谷氨酸;γ-GCS为γ-谷氨酰半胱氨酸合酶;Gly为甘氨酸;BSO为丁硫氨酸亚砜胺;GSS为谷胱甘肽合成酶;GSH为谷胱氨肽;GSSG为氧化型谷胱甘肽;Nrf2为核因子E2相关因子2;GPX4为谷胱甘肽过氧化物酶4;PUFA-OOH为多不饱和脂肪酸的氢过氧化物;PUFA-OH为多不饱和脂肪酸的氢氧化物;LOX为脂氧合酶;erastin为爱拉斯汀(铁死亡诱导剂);RSL3为RAS合成致死物3(铁死亡诱导剂);DMT1为金属离子转运体1; Fenton为芬顿反应;Feritin为铁蛋白;NCOA4为核受体辅激活因子4;DFO为去铁胺;BP为一种新型铁离子螯合剂;DFOM为去铁敏;CPX为一种铁离子螯合剂;FTH1为铁蛋白重链1;FTL为铁蛋白轻链;ferrostatin-1为一种铁死亡抑制剂;Lipid ROS为脂质活性氧
1.4 脂质过氧化
脂质过氧化是ROS氧化生物膜的过程,在机体的新陈代谢中起着重要作用。过量的ROS与细胞膜的磷脂、酶和膜受体相关的多不饱和脂肪酸的侧链及核酸等大分子物质发生脂质过氧化反应形成脂质过氧化产物(LPO),使细胞膜的流动性和通透性发生改变,最终导致细胞结构和功能的改变[15]。铁死亡的发生主要是由于脂质修复酶GPX4的失活引起脂质过氧化物的积累,从而驱动细胞死亡,由此可见,脂质过氧化与细胞铁死亡有着密切联系。Doll等[16]通过敲除细胞长链脂酰辅酶A合成酶4(ACSL4)基因,发现细胞铁死亡受到明显抑制,表明ACSL4通过氧化细胞膜磷脂驱动铁死亡。随着研究的不断深入,亚油酸和花生四烯酸等多不饱和脂肪酸(PUFA)的过氧化作用被证明是铁死亡的主要影响因素,其表现出对铁死亡的高度敏感性,并能进一步加剧细胞铁死亡[17]。因此,脂质过氧化反应能驱动细胞发生铁死亡。
2 铁死亡与其他程序性死亡方式的关系
铁死亡与其他程序性死亡如自噬、凋亡等既有区别,又有着密切联系。铁死亡在细胞形态上的改变主要为线粒体膜密度增加和线粒体收缩,而自噬以双层膜自噬空泡的形成,凋亡以染色质凝集、凋亡小体的形成为主要标志。
2.1 铁死亡与自噬
铁死亡与自噬相互协同。铁死亡诱导剂和抑制剂均能够影响细胞自噬的发生。而自噬能诱导TfR1的表达,同时铁蛋白在自噬溶酶体内可部分降解,释放铁离子,过多的铁离子被运输回胞质,引起氧化应激反应,导致细胞发生铁死亡[18-20]。铁死亡与自噬过程存在分子间的相互作用,铁死亡激动剂会触发自噬过度激活,导致自噬小体的积聚,从而诱导细胞发生铁死亡,其中核受体辅激活因子4(NCOA4)介导的自噬能促进铁蛋白吞噬从而加速铁死亡的发生[21]。
2.2 铁死亡与凋亡
内质网应激介导的蛋白激酶R样内质网激酶(PERK)-真核细胞起始因子2α(EIF2α)-激活转录因子4(ATF4)-C/EBP同源蛋白(CHOP)-p53上调凋亡调控因子(PUMA)途径参与了铁死亡和细胞凋亡过程[22]。p53作为肿瘤抑制因子,可以调控细胞的生物学过程和各种代谢途径,促进ROS的生成,诱导细胞凋亡或铁死亡[23]。铁死亡诱导剂erastin与肿瘤坏死因子相关凋亡诱导配体(TRAIL)之间具有协同作用,研究发现erastin通过CHOP诱导内质网应激,促进p53上调凋亡调节剂PUMA的表达,在缺乏PUMA的人结直肠癌HCT116细胞和缺乏CHOP的小鼠胚胎成纤维细胞中,erastin与TRAIL的协同作用被消除,而在缺乏p53的HCT116细胞中,erastin与TRAIL的协同作用仍存在,表明p53独立的CHOP/PUMA轴参与了细胞铁死亡过程[24]。因此,在一定程度上细胞凋亡参与了铁死亡的发生。
3 铁死亡对心血管疾病的影响
研究表明,铁死亡参与了心血管疾病的发生发展,特别是在心肌梗死和动脉粥样硬化中发挥着重要作用(见图2)。
3.1 心肌梗死
心肌梗死是临床中常见且危险性较高的心血管疾病,其发病呈现年轻化趋势[25]。经皮冠状动脉介入术等治疗手段可使缺血心肌组织在短时间内恢复血供,但同时也产生再灌注损伤,影响患者缺血/再灌注(I/R)后心脏结构和功能的恢复[26]。因此,减少I/R引起的心肌细胞损伤成为心肌梗死治疗及预后的关键。
铁死亡是心肌细胞死亡的重要形式[27]。研究表明,核苷酸焦磷酸酶2抗体(ENPP2)/溶血磷脂酸(LPA)通过调节GPX4、ACSL4和Nrf2的表达以及增强丝氨酸/苏氨酸蛋白激酶(Akt)信号来保护心肌细胞免受铁死亡诱导剂erastin诱导的细胞死亡[28]。为评估I/R后心脏中的铁积累水平,Baba等[29]通过心脏冠状动脉左前降支结扎制备小鼠I/R损伤模型,发现I/R损伤30 min后铁蛋白沿心肌瘢痕区积聚,铁积累诱导心肌细胞死亡,该过程可能主要受TfR1调节。Fang等[30]研究发现,通过铁死亡抑制剂ferrostatin-1、铁螯合剂去铁胺(DFO)、线粒体靶向抗氧化剂mitoTEMPO、血红素加氧酶1(HO-1)以及低铁饮食等措施能有效防治铁死亡介导的心脏损伤,这为心肌病及心肌梗死等心脏疾病提供了新的预防及治疗思路。
3.2 动脉粥样硬化
动脉粥样硬化是一种慢性炎症性疾病,血管内皮细胞、平滑肌细胞和巨噬细胞等参与其病理生理过程[31]。动脉粥样硬化与体内铁水平的变化密切相关,铁过载可促进氧化应激、脂质过氧化等病理过程,增加斑块的不稳定性,脂质过氧化、斑块内出血和铁沉积是晚期动脉粥样硬化斑块的重要特征,这间接说明铁死亡可能参与动脉粥样硬化的发展[32]。铁死亡的关键酶GPX4活性丧失,可导致大量脂质过氧化物积累,驱动铁死亡,进一步影响动脉粥样硬化的进展[33]。铁鳌合剂的使用能够有效缩小动脉粥样硬化斑块的面积,稳定斑块,减缓动脉粥样硬化的进展[34]。这些研究都提示铁过载及脂质过氧化在动脉粥样硬化的发生发展中起重要作用,铁死亡与动脉粥样硬化密切相关。因此,清除过量的铁及减少ROS的产生可能是今后治疗和预防动脉粥样硬化的新策略。
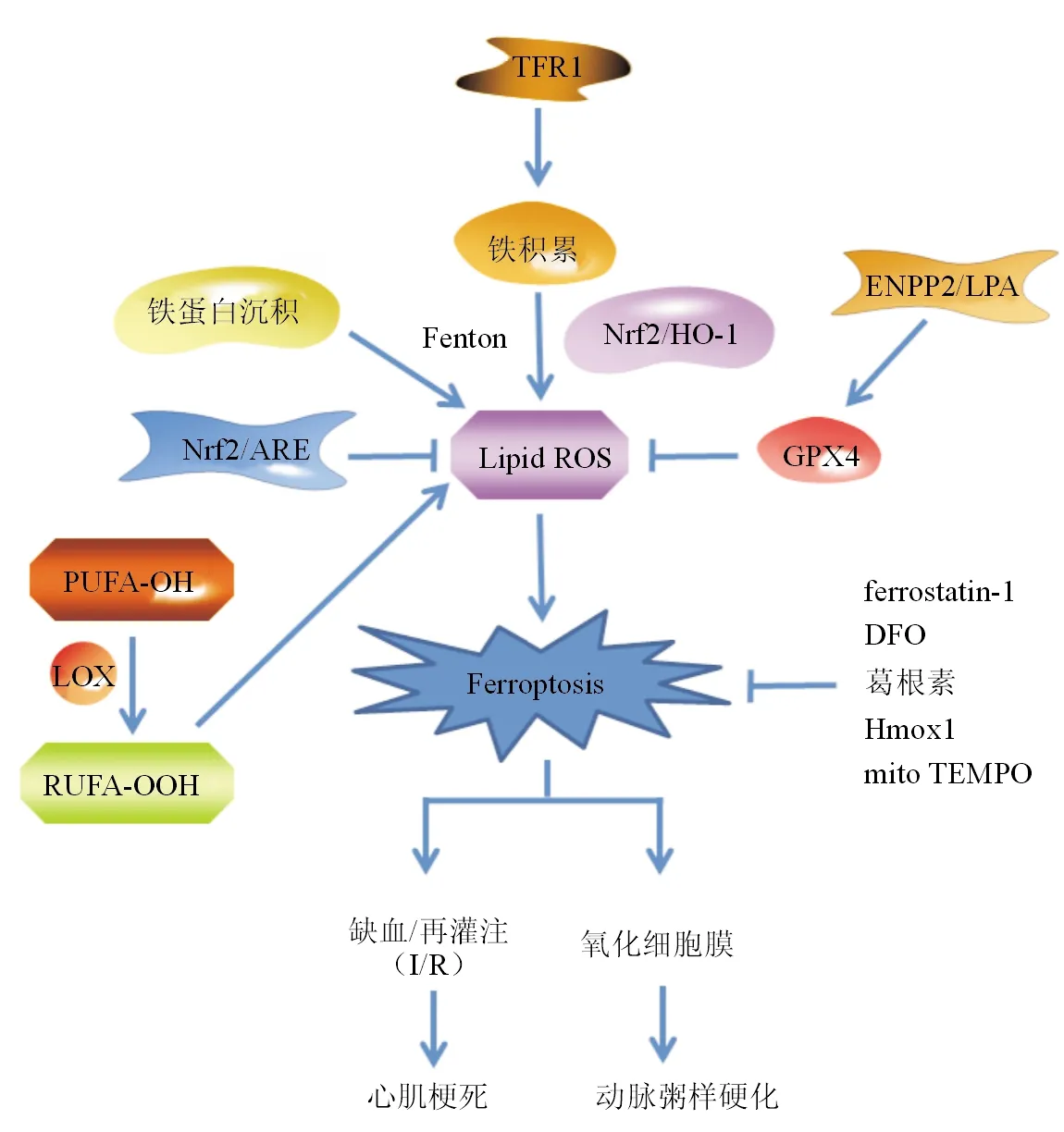
注:Hmox1 (HO-1)为血红素加氧酶1;ARE为抗氧化反应元件;mitoTEMPO为一种线粒体靶向超氧化物歧化酶;ENPP2/LPA为核苷酸焦磷酸酶2抗体/溶血磷脂酸
4 小结
铁死亡导致心血管疾病的主要机制是谷氨酸-胱氨酸转运受阻、铁过载、氧化应激和脂质过氧化反应,阻断这些环节,能有效防治心肌梗死、动脉粥样硬化及其他继发性心血管疾病的发生。随着基础研究不断深入,铁死亡在心血管疾病中的作用机制也会不断完善。铁死亡抑制剂、抗氧化剂、铁螯合剂等有望为心血管疾病治疗带来新的希望。
