IL-17A 对前列腺癌细胞迁移的促进作用及其机制
2020-12-15肖梓屾刁书腾张莉爽杨丽娟冯新雨王振江刘艳波
肖梓屾, 刁书腾, 张莉爽, 刘 杰,2, 杨丽娟, 冯新雨, 王振江, 刘艳波
(1.北华大学医学院病理生理学教研室,吉林 吉林 132013;2.北华大学附属医院肾病风湿病科,吉林 吉林132013;3.北华大学医学院解剖学教研室,吉林 吉林 132013)
慢性炎症与许多恶性肿瘤的发生发展有关联,有研究[1]证实:大约25% 的癌症是由慢性炎症恶性转化形成。几乎所有前列腺手术切除标本都存在不同程度的炎症[2-3],前列腺炎症可由感染、尿液反流、饮食因素和创伤等原因引起[4]。炎症过程中伴有大量炎症细胞浸润和细胞因子释放。本课题组前期工作[5-7]证实: 在良性前列腺增生(benign prostatic hyperplasia,BPH) 和前列腺癌组织中均存在炎症细胞浸润,如淋巴细胞、巨噬细胞、中性粒细胞和肥大细胞浸润等。炎症细胞激活可释放大量的细胞因子、炎症介质和自由基等,其中白细胞介素17 (interleukin-17, IL-17) 家族是非常重要的促炎细胞因子, 该家族成员包括IL-17A~F 这6 种配体以及IL-17RA~E 这5 种受体。IL-17A 可由Th17 细胞、γδT 细胞和NK 细胞等免疫细胞产生,上皮细胞、肿瘤细胞和血管内皮细胞也可合成IL-17A[5-7]。 IL-17A 与 IL-17RA 、 IL-17RC 和IL-17RA/IL-17RC 受体复合物结合, 通过激活下游信号转导过程诱导细胞因子合成,在炎症性疾病、自身免疫性疾病和恶性肿瘤发生发展过程中发挥 重 要 作 用[8]。 本 课 题 组 前 期 工 作[5-7]表 明:IL-17 家族成员在前列腺癌、膀胱癌和直结肠癌组织中均有不同程度高表达,其中,IL-17A 在上述各种恶性实体肿瘤组织中表达水平均升高,且随着疾病恶性度增加,其表达水平明显增强,在前列腺癌组织中血管内皮细胞表达水平明显高于正常前列腺(normal prostate, NP) 及BPH 组织。 IL-17A重组蛋白与直结肠癌和肺癌细胞共培养,可促进癌细胞的增殖[9],但IL-17A 是否具有促进前列腺癌增殖及迁移作用,目前尚无相关研究报道。本实验观察IL-17A、信号传导及转录激活蛋白3 (signal transducer and activator of transcription 3,Stat3) 和血管内皮生长因子(vascular endothelial growth factor, VEGF) 在前列腺癌组织中的表达差异及其与肿瘤恶性度的相关性,验证IL-17A 重组蛋白对前列腺癌细胞增殖及迁移的作用, 进而探讨IL-17A 对前列腺癌作用的相关机制,为将IL-17A作为前列腺癌诊断及治疗靶点提供理论依据。
1 资料与方法
1.1研究对象选取2017 年10 月—2019 年10 月北华大学附属医院、吉林省吉林市人民医院和吉林省吉林市中心医院等提供的前列腺组织标本73 例。其中NP 标本(手术切除的癌旁组织) 8 例,标本来源患者平均年龄为(61.7±4.9) 岁;BPH 标本30 例, 标 本 来 源 患 者 平 均 年 龄 为 (60.7±5.0) 岁;前列腺癌标本35 例,标本来源患者平均年龄为(64.2±5.1) 岁。BPH 诊断标准:排尿困难、尿细无力、费时费力、尿频和夜尿增多;肛门指诊,两侧叶增大光滑、有弹性,B 超检查:前列腺体积增大(前列腺体积=0.52×三经线之乘积,按质量>20 g 计算,体积>19.05 cm³为诊断标准);尿流率测定,尿量>150 mL ;残余尿量,经腹B 超检查膀胱残余尿为10~60 mL。 纳入标准: 符合BPH 诊断标准, 1 周以来未使用治疗BPH 的药物, 知情同意且自愿受试。 排除标准:临床资料不完整,并发各种慢性感染,患者有严重的心功能不全和肾功能不全等。前列腺癌诊断的病理标准:以超声引导下经直肠前列腺系统穿刺活检的病理结果为标准。纳入标准:有完整的影像数据和详细的临床资料,经过系统穿刺活检病理证实为前列腺癌,且穿刺与影像检查前后相隔不超过6 个月,患者1 周内未进行治疗;排除标准:患者经过内分泌治疗和放射性治疗等治疗方案,并发严重的感染。前列腺癌病理分级采用Gleason 评分标准:其 中 高 分 化(Gleason 2~4 分) 5 例, 中 分 化(Gleason 5~7 分) 22 例, 低 分 化(Gleason 8~10 分) 8 例,所有标本均采用双盲法阅片,由2 名病理医师独立完成。患者手术前1 周内均未进行导尿和前列腺按摩等检查,术前未接受任何治疗。另收集前列腺癌患者血清标本40 例, 平均年龄为(66.5±6.8) 岁;男性健康志愿者血清标本40 例,平均年龄为(63.9±5.3) 岁。前列腺癌患者和健康对照者年龄比较差异无统计学意义(P>0.05)。本研究经北华大学医学院医学伦理委员会批准,受试者均对该研究知情,自愿参与并签署知情同意书。
1.2细胞、主要试剂和仪器PC3 细胞由吉林大学前列腺疾病研究中心惠赠。 胎牛血清、 胰酶和DMEM 培养基购自北京中杉金桥有限公司,IL-17A 重组蛋白和山羊抗人IL-17RA 抗体(ab133416,1∶400) 购自美国Abcom 公司,兔抗人IL-17A 抗体(NBP1-42746, 1∶100)、 兔抗人p-stat3 多克隆抗体(NBP2-24463,1∶400)、兔抗人Stat3 单克隆抗体(NBP2-674321∶300) 和鼠抗人VEGF 单克隆抗体(NB100-648,1∶200) 均购自美国NOVUS Biologicals 公司, 人源性VEGF ELISA 试剂盒(DVE00)、 人源性IL-17A ELISA试剂盒(DY317) 和人源性IL-6 ELISA 试剂盒(D6050) 购自美国NOVUS Biologicals 公司,人源性基质金属蛋白酶(matrix metallopeptidase,MMP-9) ELISA 试剂盒购自奥地利维也纳eBioscience 公 司,RIPA 裂 解 液、SDS-PAGE 蛋 白上样缓冲液(6×) 和BCA 蛋白浓度测定试剂盒均购自广州碧云天公司,二甲基亚砜和丽春红染色液购自北京索莱宝有限公司,丙烯酰胺、甲叉双丙烯酰胺、异丙醇、SDS、甘氨酸、氯化钠和甲醇等均为美国Sigma 公司生产。Olympus 显微镜成像系统由日本Olympus 公司生产,Infinite 200 分光光度计由奥地利TECAN 公司生产,Centrifuge 5424 高速离心机由德国Eppendorf 公司生产, 恒温孵育箱CNP-9160 由精鹰医疗器械公司提供,高压灭菌锅(ZEALWAY-GR60DR) 和低温冷冻离心机由湘仪有限公司提供,凝胶成像仪、垂直电泳槽和湿式转膜槽为美国Bio-Rad 公司生产。
1.3免疫组织化学染色和判定标准石蜡包埋的病理标本经100% 二甲苯脱蜡,依次放入不同浓度梯度酒精入水;自来水冲洗5 min,磷酸盐缓冲液漂洗; 将标本置于含0.01 mol·L-1柠檬酸缓冲液中,高温高压法进行抗原修复,冷却至室温后磷酸盐缓冲液充分漂洗3 次,加入1% H2O2溶液常温孵育,以灭活内源性过氧化物酶,滴加不同稀释度的一抗(IL-17A、 IL-17RA、 Stat3 和VEGF), 4 ℃孵育过夜,磷酸盐缓冲液充分漂洗后;滴加二抗,常温孵育,磷酸盐缓冲液充分漂洗,DAB 溶液显色,自来水冲洗终止反应,苏木精轻度复染,梯度酒精脱水,二甲苯透明,干燥,中性树胶封片。拍摄样品照片时选取图片上目标区域(area of interesting, AOI), 测 量 该 区 域 的 累 计 吸 光 度(IA) 值,选择并测量有效统计区域的面积,计算IA 的平均值(IA /area), 将拍好的照片采用Image-Pro Plus 9.1 软件对染色阳性的部分进行客观定量分析,以每组所拍照片的平均值作为量化后的数值。
1.4 ELISA法检测血清IL-17、IL-6、VEGF和MMP-9水平在已经包被的反应孔中加入稀释后的血清标本0.1 mL, 37℃孵育1 h;充分洗涤后各反应孔中加入酶标抗体0.1 mL,37℃继续孵育1 h;充分洗涤后加入新鲜配置的四甲基联苯胺(3,3',5, 5'-Tetramethylbenzidine , TMB) 底 物 溶 液0.1 mL, 37℃继续孵育30 min;每个反应孔中加入酸性溶液0.05 mL 终止反应。以空白对照孔调零,450 nm 处检测各反应孔A 值, 并计算血清IL-17、IL-6、VEGF 和MMP-9 水平(根据已知浓度的抗体标准品, 经过浓度稀释, 检测标准品的A 值, 将检测的A 值代入线性关系计算公式,计算待测样品水平)。
1.5细胞划痕实验检测各组细胞迁移能力采用Marker 笔在6 孔板背面均匀划线,在6 孔板中加入5×105个细胞,过夜后使细胞融合率为100%。采用枪头垂直于孔板背后的划线进行划痕。PBS 洗涤3 次,去除脱落细胞,对照组加入新鲜无血清培养基 培 养, 实 验 组 加 入 终 浓 度 为100 μ g·L-1的IL-17A 重组蛋白,于37 ℃、5%CO2条件培养箱中培养。倒置显微镜观察不同时间(0、 6、 12 和24 h) 细胞划痕情况并拍照。在划痕每侧边缘均选取30 个点后取其中线代表划痕边缘,测量不同时间点划痕边缘的最小距离,并用以下公式计算迁移距离,迁移距离=0 h时划痕边缘的最小距离-n h 时划痕边缘的最小距离(n 代表不同时间点),进而计算不同时间点迁移距离的大小。采用Image J 软件计算划痕线之间距离的平均值,比较各组划痕愈合情况。以细胞迁移距离代表各组细胞迁移能力。
1.6 Transwell小室实验检测各组迁移细胞数制备PC3 细 胞 悬 液, 将4×105个 细 胞 接 种 于Transwell 小室的上室,向Transwell 小室的上室中加入无血清DMEM 培养基作为对照组,以含50 和100 μg·L-1IL-17A 重组蛋白的无血清DMEM 培养基为给药组,给药组和对照组Transwell 小室的下室中均加入含25% 胎牛血清的DMEM 培养基,置于37 ℃、5% CO2培养箱中孵育24 h,取出小室,4%多聚甲醛固定30 min,0.1%结晶紫染色10 min,光学显微镜下随机选取10个视野,计数迁移细胞数。
1.7 Western blotting法检测各组细胞中目的蛋白表达水平将前列腺癌细胞胰酶消化后,分别接种于4 个细胞培养瓶中,加入DMEM 培养液进行培养,分别向4 个培养瓶中加入终浓度为0、20、50和100 μg·L-1的IL-17A 重组蛋白,继续培养48 h,弃去培养液,收集前列腺癌细胞,加入150 μL 超声 裂 解 缓 冲 液 [ 含50 mmol·L-1NaH2PO4、10 mmol·L-1Tris-HCl、 250 mmol·L-1NaCl、 苯甲基磺酰氟(PMSF) 1 000 μg·L-1和蛋白酶抑制剂(Aprotitin) 2 000 μg·L-1,pH 为8.0)],超声反复裂解, 10 000 r·min-1、 4 ℃离心提取总蛋白液。取50 μg 蛋白加入等体积5×上样缓冲液。将样品置于100 ℃沸水中热变性5 min,按前述分组顺序加样,75 V、30 min,150 V、60 min 衡压电泳,直至溴酚蓝接近分离胶底部时,关闭电源。行SDS-PAGE 凝胶电泳,转膜至PVDF 上,5% 脱脂奶粉封闭2 h, TBST 充分洗膜,与p-Stat3、Stat3和VEGF 抗体4℃孵育过夜,TBST 充分洗膜;滴加HRP标记二抗,室温孵育后TBST洗膜,暗室中显影、采集图像并分析各条带灰度值。以目的蛋白条带灰度值与β-actin条带灰度值比值表示目的蛋白表达水平。
1.8统计学分析采用SPSS 16.0 统计软件进行统计学分析。 各组细胞中IL-17A、 IL-17RA、Stat3 和VEGF 免疫组织化学染色结果采用独立样本 非 参 数Mann-WhitneyU检 验; 血 清IL-17、IL-6、 VEGF 和MMP-9 水平, 各组细胞中Stat3、p- Stat3 和VEGF 蛋白表达水平以x±s表示,多组间样本均数比较采用单因素方差分析,2 组间比较采用t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1各种组织中IL-17A和IL-17RA表达免疫组织化学结果显示:IL-17A 蛋白染色呈棕黄色,表达于腺上皮、单个核细胞和血管内皮细胞。在NP组织中IL-17A 表达微弱,在BPH 和前列腺癌组织中表达明显增强。与NP 组织比较, BPH 组织中IL-17A 表达水平升高(P<0.05)。与BPH 组织比较, 前列腺组织中IL-17A 表达水平升高(P<0.05)。IL-17RA 主要表达于腺上皮、单个核细胞和血管内皮细胞。 与NP 组织比较, BPH 组织中IL-17RA 表达水平升高(P<0.05);与BPH 组织比较,前列腺组织中IL-17RA 表达水平升高(P<0.05)。见图1 (插页五) 和图2。
2.2各种组织中Stat3和VEGF的表达免疫组织化学染色结果显示: Stat3 阳性颗粒呈棕黄色,主要表达于细胞质,在细胞核也可见少量表达。与BPH 和NP 组织比较,前列腺癌组织中Stat3 表达水平升高(P<0.05)。 VEGF 中性颗粒也呈棕黄色,主要表达于前列腺上皮细胞中。与BPH 和NP组织比较,前列腺癌组织中VEGF 表达水平升高(P<0.05)。见图3 (插页五) 和图4。
2.3 IL-17A和IL-17RA表达与前列腺癌恶性程度的关系35例前列腺癌组织中,Gleason分级2~4分(高分化) 5 例,5~7 分(中分化) 22 例,8~10 分(低分化) 8 例。 统计不同Gleason 分级IL-17A 和IL-17RA 表达情况检测结果显示:随着Gleason 分级增加(分化程度降低,恶性程度增加),IL-17A和IL-17RA表达水平均升高。见图5(插页五)和图6。
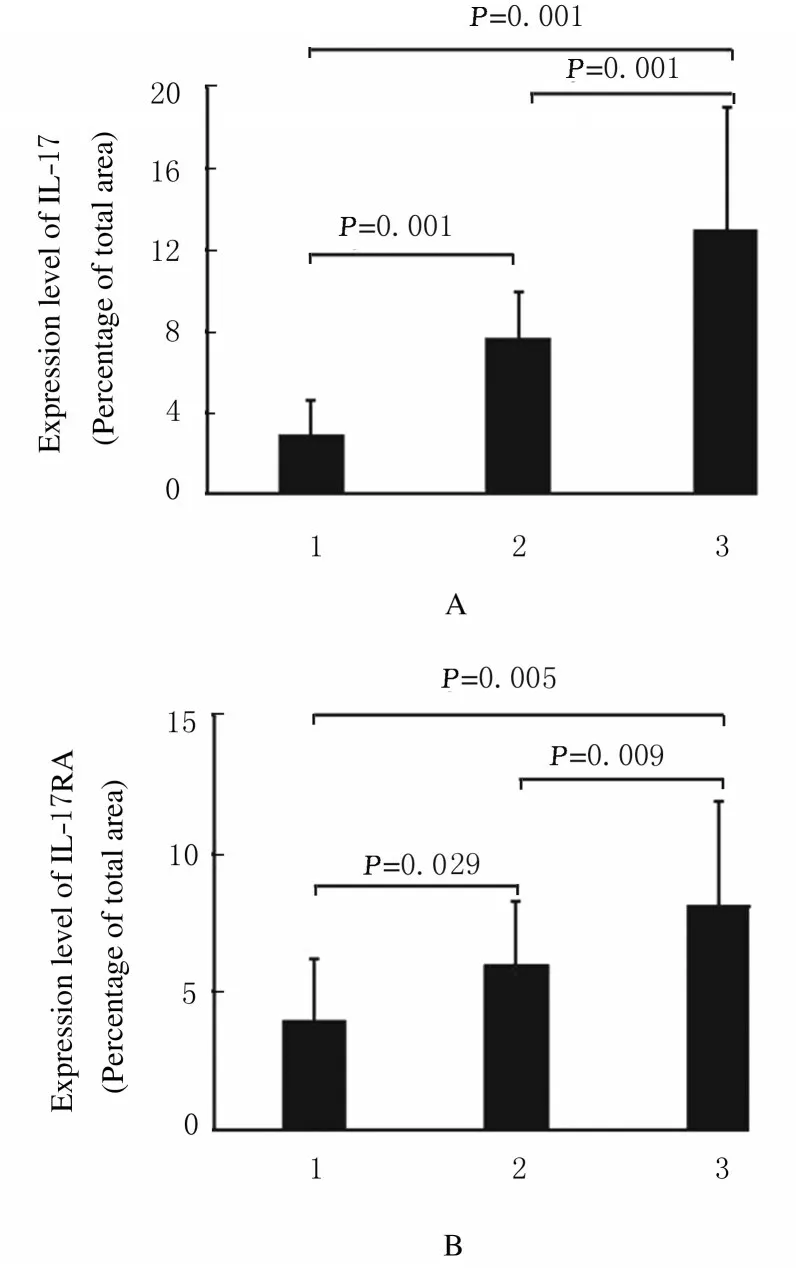
图2 各种组织中IL-17A 和IL-17RA 表达水平Fig.2 Expression levels of IL - 17A and IL - 17RA in various tissues
2.4 Stat3和VEGF表达水平与前列腺癌恶性性度的关系随着Gleason 分级增加(分化程度降低,恶性程度增加),Stat3 和VEGF 表达水平均升高。见图7 (插页五) 和图8。
2.5 2组研究对象血清IL-17A、IL-6、VEGF和MMP-9水平ELISA 实验结果显示:与健康对照组比较, 前列腺癌组患者血清IL-17、 IL-6 和VEGF 水平明显升高(P<0.05),MMP-9 水平比较差异无统计学意义(P>0.05)。见表1。
2.6划痕实验检测2组PC3细胞迁移细胞数随着培养时间的延长, 细胞愈合的程度越强。Transwell 小室实验结果显示: 实验组中50 和100 μg·L-1IL-17A 重组蛋白作用细胞24 h 后,穿过Transwell 小室底的细胞数分别为(99.71±13.92)个·mm-2和(128.50±15.26) 个·mm-2; 实 验组PC3细胞的迁移距离明显长于对照组(P<0.05或P<0.01)。见表2。Transwell小室上、下室的细胞经结晶紫染色后,典型的细胞形态表现见图9(插页六)。
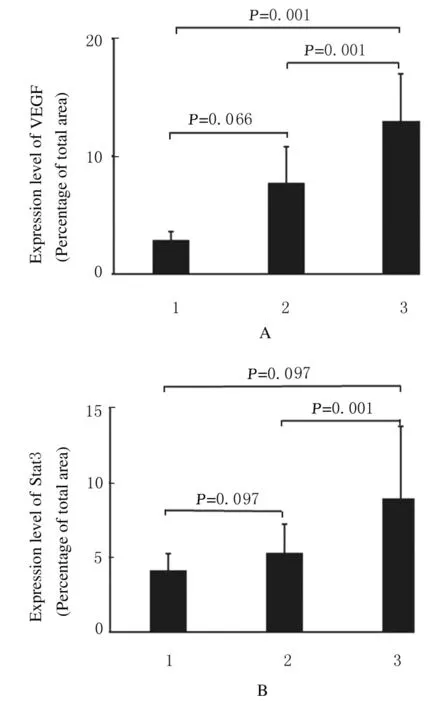
图4 各种组织中Stat3 和VEGF 表达水平Fig.4 Expression levels of Stat3 and VEGF in various tissues
2.7各组PC3细胞中Stat3、p-Stat3和VEGF蛋白表达水平随着IL-17A 重组蛋白浓度的增加,PC3 细胞中Stat3、p-Stat3 和VEGF 蛋白表达水平升高,50 和100 μg·L-1IL-17A 作用PC3 细胞后细胞中Stat3、p-Stat3 和VEGF 蛋白表达水平明显高于0 和20 μg·L-1IL-17A 组(P<0.05)。见图10。
3 讨 论
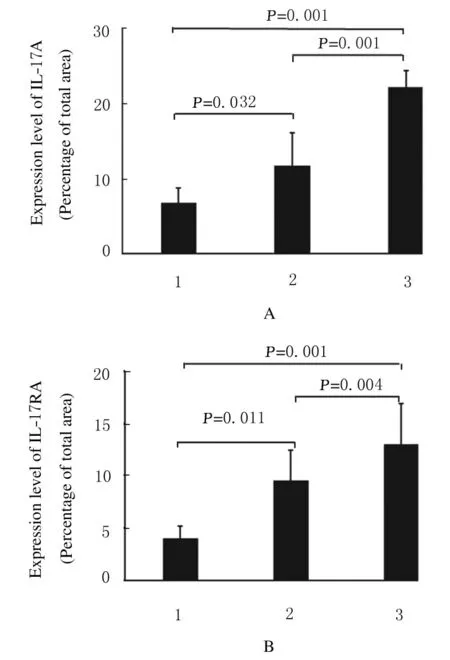
图6 前列腺癌组织中IL-17A 和IL-17RA 的表达水平Fig.6 Expression levels of IL-17A and IL-17RA in prostate cancer tissue
1995 年首先发现IL-17 及其第一个受体IL-17RA 以来,关于IL-17 的研究不断深入。IL-17家族成员主要由辅助T 淋巴细胞17 (Th17) 产生,此外,γδT 细胞和其他免疫细胞也可产生,目前研究较多的是 IL-17A 和 IL-17RA 。 IL-17A 与IL-17RA 结合后,通过系列转导过程引起下游基因转录[10]。GEORE 等[11]发现:在BPH 组织和前列腺癌组织中IL-17A 及IL-17RA 表达水平升高。EUGENA 等[12]在 前 列 腺 增 殖 性 炎 性 萎 缩 病 变 中发现了表达IL-17 的巨噬细胞和中性粒细胞。因为炎症刺激是促进各种恶性肿瘤发生发展的重要因素,如慢性胃炎发展成胃癌,长期的宫颈炎转变为宫颈癌等。 前列腺癌通常由长期BPH 演变而来,而炎症是BPH 的典型病理改变。本课题组前期研究[5] 结果表明:BPH 组织伴有大量炎症细胞浸润,提示BPH 是前列腺癌的直接前体。小鼠模型检测发现:前列腺炎症信号可以诱导或协同致癌信号促进前列腺癌的发生发展[15]。在BPH 组织中,炎细胞浸润和细胞因子的产生同时增加, IL-17 家族成员 (IL-17A 、 IL-17E 和 IL-17F 及 IL-17RA 、IL-17RB 和IL-17RC) 的表达均有不同程度改变,尤其IL-17A表达水平升高最为明显[5],IL-17A是前列腺癌发生发展的重要调节因子,ZHANG 等[13]证实:IL-17可促进激素依赖型和去势抵抗型前列腺癌的发展,其发生机制与促进Stat3的表达有一定关联。
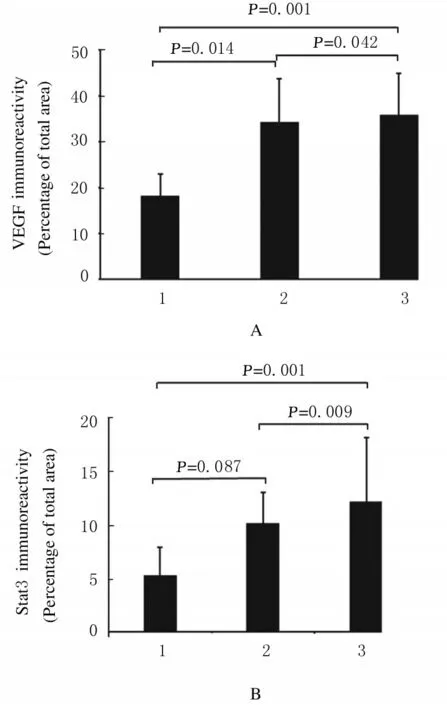
图8 前列腺癌组织中Stat3 和VEGF 的表达水平Fig.8 Expression levels of Stat3 and VEGF in prostate cancer tissue
本研究结果显示:在BPH 组织和前列腺癌组织中IL-17A 表达水平升高,尤以前列腺癌组织中的表达水平升高最明显,且在Gleason 评分高的组织其表达水平升高明显,这也部分解释了IL-17 具有 促 前 列 腺 癌 发 生 发 展 的 效 应 。CHUNNINGHAM 等[14]和ZHANG 等[15]通 过 基因敲除IL-17RC,进而阻断IL-17A 的信号,发现前列腺癌生长受到抑制,其侵袭和转移发生率也明显降低;利用IL-17A 阻断剂或单克隆抗体也可抑制前列腺癌的生长,由此可见IL-17A 对前列腺癌具有促瘤效应。
为了探讨IL-17A 促进前列腺癌增殖和迁移的机制,本研究采用不同实验方法检测IL-17 下游信号的表达情况结果显示:在前列腺癌组织中Stat3和VEGF 表达水平明显高于BPH 组织,且随着癌恶性程度的增加其水平进一步升高;血清学实验证明:前列腺癌患者血清IL-17A、IL-6 和VEGF 水平较健康对照者明显升高,而MMP-9 水平无明显变化。50 和100 μg·L-1IL-17A 重组蛋白具有促进前列腺癌细胞增殖和迁移的效应; Western blotting 法检测结果证实:随着IL-17A 重组蛋白浓度的增加,Stat3、p-Stat3 和VEGF 蛋白表达水平逐渐升高,50 和100 μg·L-1IL-17A 组PC3 细胞中Stat3 和VEGF 蛋白表达水平明显高于0 和20 μ g·L-1IL-17A 组,说明IL-17 重组蛋白具有促进前列腺癌增强及转移的效应。

表1 2 组研究对象血清IL-17A、IL-6、VEGF 和MMP-9 水平Tab.1 Levels of IL-17A, IL-6, VEGF ,and MMP-9 in serum of subjects in two groups [n=40,x±s,ρB/(μg·L-1)]
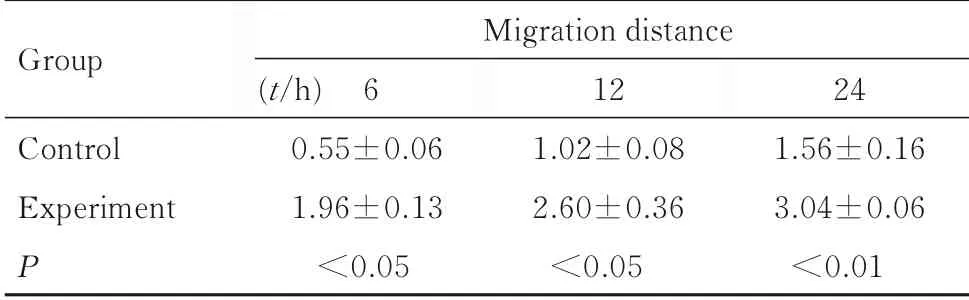
表2 划痕实验检测不同时间点2 组PC3 细胞迁移距离Tab.2 Migration distances of PC3 cells in two groups at different time points detected by scratch test (x±s,l/mm)
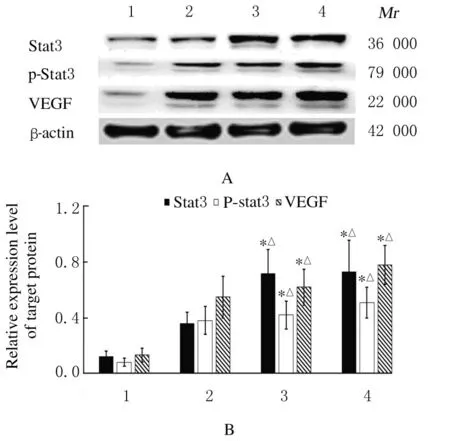
图10 各组PC3 细胞中Stat3、p-Stat3 和VEGF 蛋白表达电泳图(A)和直条图(B)Fig.10 Electrophoregram (A) and histogram(B) of expressions of Stat3, p -Stat3, and VEGF proteins in PC3 cells in various groups
Stat3 在炎症性信号转导过程中发挥重要作用,可 被LPS 、 INF- γ 和 其 他 细 胞 因 子 激 活, IL-6、IL-10 和IL-11 与特异性受体结合可激活受体依赖的JAK1 和Tyk2,而Stat3 是JAKA1 下游基因,磷酸化后转位进入胞核,调节Bcl-XL、Bcl-2、MYC 和SOCS3 转录[16]。Stat3 在肿瘤进展中发挥的宿主免疫 和 炎 症 反 应 不 容 忽 视,YOU 等[17]采 用Stat3 的小分子抑制剂明显增强NK 和中性粒细胞的抗肿瘤免疫活性,说明Stat3 具有促使肿瘤免疫逃逸效应。Sta3 又是非常重要的原癌基因,在前列腺癌组织中持 续 激 活[18-19]。 IL-6 可 促 进Stat3 的 磷 酸 化, 而IL-6 在前列腺癌组织中持续高表达,并与癌症的恶性程度有关联[20]。 单核巨噬细胞系统产生大量IL-6 和TGF-β,共同诱导Th17 细胞活化并分泌大量IL-17,IL-17可增强促炎细胞因子IL-6和TNF-α 生成,反之,TNF-α 又可协同IL-6 正反馈激活Th17和γδT 细胞分泌IL-17,导致炎症反应的级联放大。IL-6 是IL-17A 的直接下游调节基因,IL-17A 持续激活可诱导IL-6 表达异常增加, 进而激活Stat3,形成正反馈通路,共同作用促进前列腺癌发生发展。本研究结果显示:小鼠前列腺原位癌模型中Th17 细胞浸润明显;在前列腺癌患者体内巨噬细胞增加明显;当Th17 细胞浸润增加时,其分泌的IL-17 细胞因子水平明显升高,而IL-17A 趋化炎症细胞,发挥正反馈作用,进而促进肿瘤生长。
在恶性肿瘤发生发展过程中VEGF 是非常重要的生长因子,可调控血管的生成,而新生血管密度的增加是实体恶性肿瘤最重要的标志之一,因此被认为是肿瘤治疗的靶标。IL-17A 可选择性增强肿瘤细胞与内皮细胞的VEGF 表达,进而发挥促血管生成作用。IL-17A 可激活有丝分裂原活化的蛋白酶, 进而使其下游信号转录因子NF-κB 和Stat3 激活,因此IL-17RA 在多种肿瘤细胞中高表达, 如膀胱癌、 大肠癌和肝癌等。 在喉癌组织中, IL-17 结合IL-17RA 可通过JAK/Stat3 信号通路调控VEGF 和MMP-9 的表达。
在前列腺癌组织,VEGF 表达增加与肿瘤的生长、浸润和转移关系密切,血清中VEGF 水平也可为肿瘤的预后提供可靠信息。在前列腺癌组织中, IL-17A 与其受体IL-17RA 结合后可诱使细胞因子IL-6 的持续合成和分泌,而Stat3 是IL-6 可靠的下游分子,因此存在IL-17A-IL-6-Stat3 的信号转导 通 路 激 活, 而VEGF 是Stat3 的 下 游 分 子, 当Stat3 被激活后,p-Stat3 即刻转位进入细胞核,与特定的DNA 启动子序列结合并诱导下游基因表达,使VEGF 合成及分泌增加,VEGF 一方面以旁分泌的形式在肿瘤局部产生生物学效应,促进肿瘤组织内血管生成,减少肿瘤实质细胞和血管的距离,供给实体肿瘤氧和营养物质增加,肿瘤持续增殖甚至通过血液循环转移至全身;合成的VEGF 另一方面分泌入血浆,作为内分泌因子促进血管生成及生长。在肿瘤微环境中,促血管生长和抑制血管生成趋化因子影响着肿瘤的生长速度,当肿瘤细胞或组织中浸润的炎症细胞分泌促血管生成趋化因子较抑制血管生成的趋化因子增加时,则导致新生血管的增多并促进肿瘤生长,而IL-17 可增强肿瘤细胞和内皮细胞中促血管生成的趋化因子(如VEGF) 的水平及活性,从而促进肿瘤生长。
综上所述,IL-17 既是Stat3 激活的诱发因子,又是炎细胞趋化和活化的炎症因子,而这些炎细胞被活化进一步释放VEGF,出现了正反馈效应,但具体的信号转导机制尚需深入研究。
