芦丁对肝细胞氧化应激损伤的保护作用及其机制
2020-12-15金芳多尹学哲全吉淑
金芳多, 张 天, 张 钊, 尹学哲, 全吉淑
(延边大学基础医学院生物化学与分子生物学教研室,吉林 延吉 133002)
氧化应激损伤是肝损伤发生过程中的重要机制和 环 节[1]。 叔 丁 基 过 氧 化 氢 (tert-butyl hydroperoxide, TBHP) 是一种较稳定的氧化剂,通常用于体内外诱导氧化应激损伤,本研究利用TBHP 建立人肝癌HepG2 细胞的氧化损伤模型。芦丁是从植物中提取的天然黄酮类化合物,是天然的抗氧化剂,具有抗氧化、抗自由基、舒张血管、神经保护和保肝等多种药理作用[2-3]。芦丁作为传统的中草药,近年来引起国内外学者的广泛关注,因其具有强烈的抗氧化性和较少的不良反应,被广泛应用于临床中,目前主要用于治疗高血压、糖尿病和心血管疾病等。既往研究[4]显示:芦丁可以通过调节信号通路、抑制肿瘤细胞生长和诱导细胞凋亡发挥其抗肿瘤作用,有研究[5]显示:芦丁能增加磷脂酰肌醇-3 激酶(phosphoinositol 3 kinase,PI3K)、蛋白激酶B (protein kinase B,Akt) 和哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR) 信号通路的活化程度, 并能通过增加抗氧化应激酶的表达来进一步降低氧化应激的水平,对神经细胞、胃癌细胞和心肌细胞等均有一定的保护作用,但有关芦丁抑制肝细胞氧化损伤的作用及其机制尚缺乏深入的系统性研究。本研究通过探讨芦丁对肝细胞氧化损伤的保护作用,为芦丁的临床应用提供依据。
1 材料与方法
1.1细胞、主要试剂和仪器人肝癌HepG2 细胞购自延边大学附属医院细胞库提供。芦丁购自阿拉丁试剂公司, 高糖DMEM 培养基购自美国Gibco公司,胎牛血清购自美国Gemini 公司,胰蛋白酶购自美国Sigma-Aldrich 公司, 四甲基偶氮唑盐(methyl thiazolyl terrazolium, MTT) 购 自 美 国Sigma-Aldrich 公 司, 丙 二 醛(malondialdehyde,MDA) 试剂盒、 超氧化物歧化酶(superoxide dismutase, SOD) 试剂盒和还原型谷胱甘肽(reduced glutathione, GSH) 试剂盒购自南京建成科 技 有 限 公 司, 活 性 氧 (reactive oxidative species, ROS) 检测试剂盒购自广州碧云天生物技术有限公司,PI3K 抗体、Akt 抗体和核转录因子κB (nuclear factor kappa B, NF-κB) 抗体、 肿瘤抑制基因p53 抗体购自美国Cell Signaling Technology 公司。 酶标仪购自深圳雷杜公司,IX70-7721 倒置显微镜购自日本Olympus 公司,DYCZ-24DN 电泳仪购自北京市六一仪器厂,UVP凝胶成像仪购自美国UVP 公司,高速冷冻离心机购自德国Eppendorf 公司。
1.2肝癌HepG2细胞培养和分组取增殖活跃并处于对数生长期的肝癌HepG2 细胞,将其分为对照组、TBHP 组和0.25、0.50、1.00 μmol·L-1芦丁组。对照组细胞常规培养,TBHP 组细胞加入含终 浓 度 为400 μmol·L-1TBHP 的 无 血 清 培 养 液,培养细胞4 h,建立氧化损伤模型;0.25、0.50 和1.00 μmol·L-1芦丁组先分别使用含0.25、0.50 和1.00 μmol·L-1芦丁的培养液预处理24 h (芦丁用DMSO 预溶,DMSO 体积不超过总体积的0.3%,采用DMEM 培养液稀释至所需的溶液浓度),再采用含400 μmol·L-1TBHP 的无血清培养液培养细胞4 h。
1.3 MTT法检测各组肝癌HepG2细胞活性将细胞接种于96 孔板中,待细胞贴壁后,换入含芦丁的无血清培养液,使其浓度分别为0.25、0.50、1.00、2.00 和4.00 μmol·L-1,并设置对应的空白对照组。对照组添加无血清培养液,空白对照组添加不含细胞的培养液。作用细胞24 h 后,弃去上清。每孔加入20 μL MTT 溶液。MTT 溶液作用细胞4 h 后,吸取上清,每孔依次加入150 μL DMSO溶液,混匀溶解,待生成的蓝紫色结晶完全溶解后,置于酶标仪492 nm 波长处测得各组吸光度(A) 值,计算细胞活性。细胞活性= (实验孔A 值-实验空白孔A 值) / (对照孔A 值-空白对照孔A 值) ×100%。实验重复3 次。
1.4 MTT法检测各组肝癌HepG2细胞存活率将细胞接种于96 孔板中,按照上述实验分组分为对 照 组、 TBHP 组和0.25、 0.50、 1.00 μmol·L-1芦丁组,并对各个实验组设置空白对照。细胞按上述方法处理后,吸取上清,每孔加入20 μL MTT溶液, 作用细胞4 h 后, 吸 取 上 清, 每 孔 加 入150 μL DMSO 溶液,振荡混匀,待生成蓝紫色结晶并完全溶解后,置于酶标仪492 nm 波长处测得各组A 值。细胞存活率=(实验孔A 值-实验空白孔A 值) / (对照孔A 值-空白对照孔A 值) ×100%。实验重复3 次。
1.5比色法检测各组肝癌HepG2细胞中MDA和GSH水平及SOD活性按上述实验方法处理细胞后,弃去原上清培养液,胰酶消化细胞,将培养液在室温条件下1 000 r·min-1,离心10 min 并收集细胞沉淀,在细胞沉淀中加入0.5~1.0 mL 等渗磷酸盐缓冲液(phosphate buffer solution, PBS),在室温条件下离心10 min 沉降细胞。弃上清,留细胞沉淀。加入0.5~1.0 mL PBS,冰水浴下手动匀浆破碎细胞3 min,取破碎后细胞匀浆液待用,后按试剂盒说明书步骤进行操作。计算方法:MDA 水平(μmol·L-1) = (测定管A 值-测定空白管A 值) /(标准管A 值- 标准空白管A 值) × 标准品浓度(10 μmol·L-1) × 样 本 稀 释 前 倍 数; SOD 活 性(U·mL-1) = (对照管A 值-测定管A 值) /(对照管A 值) /50%×反应体积的稀释倍数×样本测试前的稀释倍数; GSH 水平(μmol·g-1) = (测定 孔A 值- 空 白孔A 值) / (标 准 孔A 值- 空 白孔A 值) ×样本前处理稀释倍数(2 倍) /待测匀浆蛋白浓度(g·L-1)。实验重复3 次。
1.6荧光显微镜检测各组肝癌HepG2细胞中ROS水平将细胞接种于6 孔板中, 分组处理方法同“1.2” 步骤。按照1∶1 000 的比例采用无血清培养液 稀 释DCFH-DA, 使 其 终 浓 度 为10 μmol·L-1,去除细胞培养液,每孔加入1 mL DCFH-DA 稀释液,置于37℃培养箱孵育20 min,以装载探针,然后采用无血清细胞培养液洗涤细胞3 次, 每孔1 mL,去除细胞中残留的DCFH-DA,置于荧光显微镜下采用488 nm 激发波长和525 nm 发射波长观察细胞形态表现,以细胞中绿色荧光强度表示ROS 水平。
1.7 Western blotting法检测各组肝癌HepG2细胞中相关蛋白表达水平按照 “1.2” 步骤中方法进行分组和给药,药物作用完毕后收集细胞。提取细胞总蛋白后,采用BCA 法测定蛋白浓度。配置浓缩胶和10% 分离胶进行电泳分离蛋白,统一蛋白上样量20 μg,电转移至聚偏乙烯PVDF 膜上,转膜过后, 采用含5% 脱脂奶粉的TBST 封闭2 h。采用TBST 洗脱PVDF 膜,加入一抗孵育4℃过夜。次日经TBST 洗脱抗体后,置于二抗中室温孵育1~2 h,然后采用TBST 洗脱PVDF 膜。并将膜浸泡于显影液中显影曝光,UVP 凝胶成像分析仪中采集图像,采用Image J 进行灰度分析,以β-actin作为内参对照, 计 算 PI3K 、 磷 酸 化 PI3K( p-PI3K)、 Akt、 磷 酸 化Akt (p-Akt)、 NF- κB、磷酸化NF-κB (p-NF-κB) 及p53 蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/β-actin条带灰度值。
1.8统计学分析采用SPSS 20.0 和GraphPad Prism 7.0 统计软件进行统计学分析。各组HepG2细胞存活率、肝癌HepG2 细胞中MDA 和GSH 水平及SOD 活性以及HePG2 细胞中PI3K、p-PI3K、Akt、p-Akt、NF-κB、p-NF-κB 和p53 蛋 白 表达水平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,两组样本均数比较采用独立样本t检验。 以P<0.05 为差异有统计学意义。
2 结 果
2.1各组HepG2细胞活性当芦丁摩尔浓度≤1.00 μmol·L-1时,HepG2 细胞的存活率均>90%,与对照组比较差异无统计学意义(P>0.05);芦丁摩尔浓度>1.00 μmol·L-1后,细胞存活率逐渐降 低。 因此本实验选取0.25、0.50和1.00 μmol·L-1芦丁作为后续实验的干预剂量。见图1。
2.2各组肝癌HepG2细胞存活率与对照组比较, TBHP 组肝癌HepG2 细胞存活率明显降低,接近半数抑制率(P<0.01);与TBHP 组比较,各浓度芦丁组肝癌HepG2 细胞存活率逐渐升高,1.00 μmol·L 芦 丁 组 肝 癌HepG2 细 胞 存 活 率 最 高(P<0.01)。见表1。
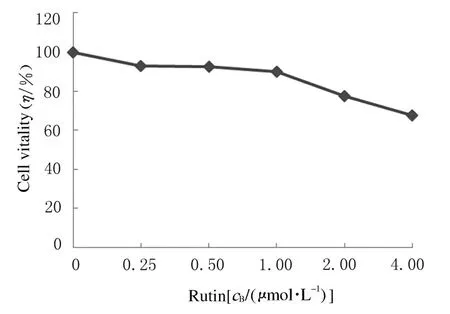
图1 各组肝癌HepG2 细胞活性Fig.1 Cell vitalities of liver cancer HepG2 cells in various groups
表1 各组肝癌HepG2 细胞存活率Tab.1 Survival rates of liver cancer HepG2 cells in viarous groups (n=3±s)
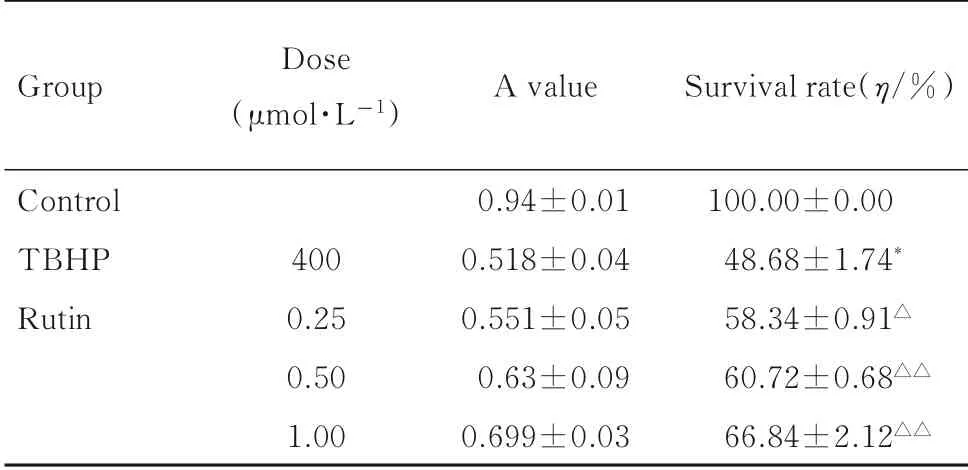
表1 各组肝癌HepG2 细胞存活率Tab.1 Survival rates of liver cancer HepG2 cells in viarous groups (n=3±s)
*P<0.01 compared with control group;△P<0.05, △△P<0.01 compared with TBHP group.
Group Control TBHP Rutin Dose(μmol·L-1)400 0.25 0.50 1.00 A value 0.94±0.01 0.518±0.04 0.551±0.05 0.63±0.09 0.699±0.03 Survival rate(η/%)100.00±0.00 48.68±1.74*58.34±0.91△60.72±0.68△△66.84±2.12△△
2.3各组HepG2细胞中MDA和GSH水平及SOD活性对照组肝癌HepG2 细胞MDA 水平较低, GSH 水平和SOD 活性较高;与对照组比较,TBHP 组 肝 癌HepG2 细 胞MDA 水 平 升 高(P<0.01), GSH 水 平 和SOD 活 性 明 显 降 低(P<0.01); 与TBHP 组 比 较, 不 同 浓 度 芦 丁 组 肝 癌HepG2 细胞中MDA 水平逐渐降低(P<0.01),GSH 水平和SOD 活性均明显升高(P<0.05 或P<0.01)。见表2。
表2 各组HepG2 细胞中MDA 和GSH 水平及SOD 活性Tab.2 Levels of MDA and GSH and activity of SOD in HepG2 in various groups (n=3,±s)
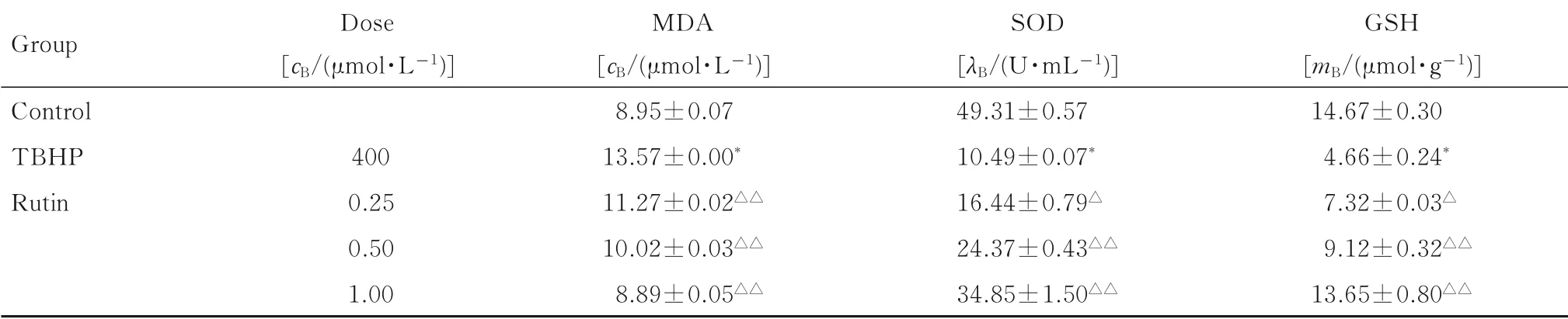
表2 各组HepG2 细胞中MDA 和GSH 水平及SOD 活性Tab.2 Levels of MDA and GSH and activity of SOD in HepG2 in various groups (n=3,±s)
*P<0.01 compared with control group;△P<0.05,△△P<0.01 compared with TBHP group.
Group Control TBHP Rutin 1.00 Dose[cB/(μmol·L-1)]400 0.25 0.50 MDA[cB/(μmol·L-1)]8.95±0.07 13.57±0.00*11.27±0.02△△10.02±0.03△△8.89±0.05△△SOD[λB/(U·mL-1)]49.31±0.57 10.49±0.07*16.44±0.79△24.37±0.43△△34.85±1.50△△GSH[mB/(μmol·g-1)]14.67±0.30 4.66±0.24*7.32±0.03△9.12±0.32△△13.65±0.80△△
2.4各组肝癌HepG2细胞中ROS水平对照组肝癌HepG2 细胞生成的绿色荧光微弱,几乎看不见细胞被染色; 与对照组比较, TBHP 组肝癌HepG2 细胞生成的绿色荧光强度明显增加,说明HepG2 细胞中ROS 水平升高,被染色的细胞数增加;与TBHP 组比较, 0.25、0.50和1.00 μmol·L-1芦丁组肝癌HepG2 细胞荧光强度呈减弱的趋势,说明HepG2 细胞中ROS 水平降低,被染色的细胞数逐渐减少。见图2 (插页一)。
2.5各组肝癌HepG2细胞中PI3K/Akt信号通路蛋白的表达水平
与对照组比较,TBHP 组肝癌HepG2 细胞中PI3K 和p-PI3K 蛋白表达水平明显降低(P<0.05), Akt 和p-Akt 蛋 白 表 达 水 平 均 明 显 降 低(P<0.05);而与TBHP 组比较,各浓度芦丁组肝癌HepG2 细胞中PI3K 和p-PI3K 蛋白表达水平升高(P<0.05),Akt 和p-Akt 蛋白表达水平升高(P<0.05)。见图3 和图4。
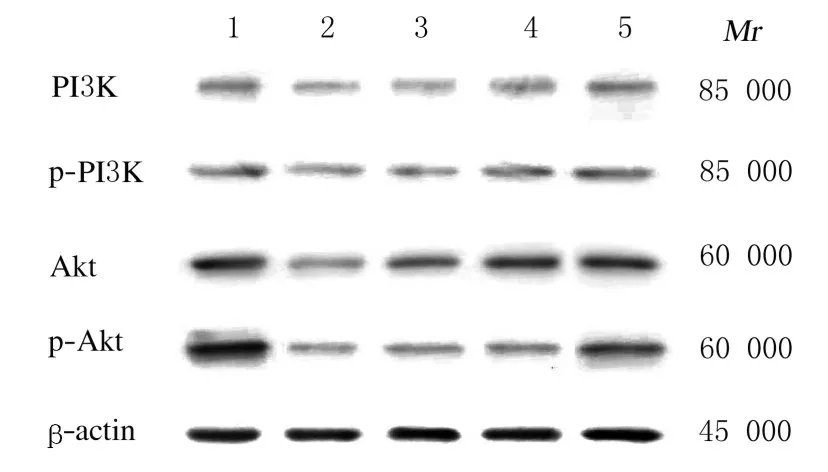
图3 各组肝癌HepG2 细胞中PI3K、p-PI3K、Akt 和p-Akt蛋白表达电泳图Fig.3 Electrophoregram of expressions of PI3K, p-PI3K,Akt,and p-Akt proteins in liver cancer HepG2 cells in various groups
2.6各组HepG2细胞中NF-κB信号通路蛋白的表达水平与对照组比较,TBHP 组肝癌HepG2 细胞中NF-κB、p-NF-κB 和p53 蛋白表达水平明显升高(P<0.05);与TBHP 组比较,各浓度芦丁组HepG2 细胞中NF-κB、p-NF-κB 和p53 蛋白表达水平降低(P<0.05),1.00 μmol·L-1芦丁组HepG2细胞中NF-κB、p-NF-κB 和p53 蛋白表达水平达到最低。见图5 和图6。
3 讨 论
氧化应激是最常见的应激损伤, 是细胞中ROS 水平超过细胞抗氧化能力的一种状态,是肝损伤发生机制中的重要损伤机制和环节[6-7]。TBHP 具有较稳定、不宜分解的优势,可以代谢为自由基中间体, 从而进一步引起脂质过氧化、GSH 耗竭和DNA 损伤,破坏抗氧化防御体系,使细胞氧化损伤甚至凋亡[8]。 TBHP 会引起DNA、蛋白质和脂质等生物分子的改变,尤其是调节与细胞凋亡和肝星状细胞活化有关的信号传导途径,从而引起肝脏损伤[9]。芦丁是一种从植物中提取的天然黄酮类化合物,是天然的抗氧化剂,具有多方面的生物活性和药理作用,包括抗氧化、抗自由基、抗炎、抗病毒、清热解毒、降血糖、降血脂、舒张血管、止血、拮抗血小板活化因子、神经保护、保肝以及抗肿瘤等作用[10-13]。 本研究结果表明:TBHP 使肝细胞存活率明显降低,细胞中生成大量的ROS,细胞中脂质过氧化水平升高,抗氧化体系水平明显降低。而芦丁预处理可以增加细胞存活率,减少细胞中ROS 自由基和脂质过氧化反应产物的生成,明显提高细胞的抗氧化能力,提示芦丁对肝细胞损伤具有一定的防御和保护作用。本研究结果与储金秀等[13]的研究结果一致。
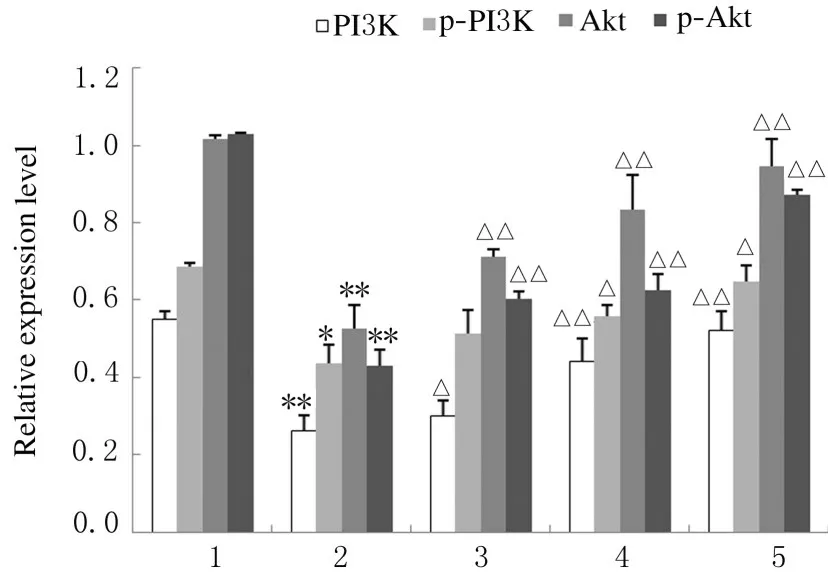
图4 各组肝癌HepG2 细胞中PI3K、p-PI3K、Akt 和p-Akt蛋白表达水平Fig.4 Expression levels of PI3K, p-PI3K, Akt, and p-Akt proteins in liver cancer HepG2 cells in various groups
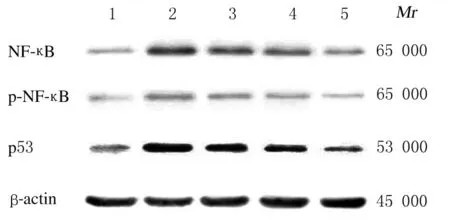
图5 各组肝癌HepG2 细胞中NF-κB、p-NF-κB 和p53 蛋白表达电泳图Fig.5 Electrophoregram of expressions of NF-κB, p-NFκB, and p53 proteins in liver cancer HepG2 cells in various groups
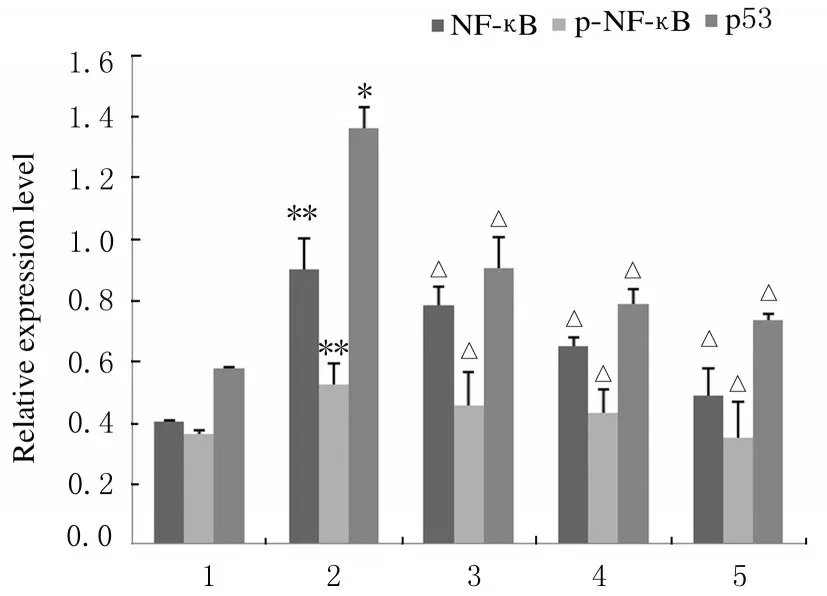
图6 各组肝癌HepG2 细胞中NF-κB、p-NF-κB 和p53 蛋白表达水平Fig.6 Expression levels of NF- κB, p-NF- κ B and p53 proteins in liver cancer HepG2 cells in various groups
PI3K/Akt 信号通路在癌细胞生长、存活、代谢、自噬和凋亡调控中起多方面重要作用,其对于细胞增殖和凋亡必不可少,在肿瘤疾病的发生发展中也起重要作用[14-18]。PI3K 被激活后,诱导下游蛋白Akt 的2 个位点磷酸化,激活的Akt 再磷酸化下游底物, 引发级联反应[19]。 本研究结果显示:TBHP 损伤引起PI3K、p-PI3K、Akt 和p-Akt 蛋白表达水平明显降低,而芦丁预处理能使PI3K 、p-PI3K、Akt 和p-Akt 蛋白表达水平升高,且有随药物浓度的增加而逐渐升高的趋势,说明芦丁对肝细胞损伤的保护作用可能与PI3K/Akt 信号通路有关联。
NF-κB 是一种多效性的核转录因子,可调控多种基因的表达,这些基因也可促进各种肿瘤细胞的生 长、 存 活 和 转 化[20-22]。 既 往 研 究[23]表 明:PI3K/Akt 信号通路中其下游蛋白Akt 可以激活B细胞的核因子κ 轻链增强子NF-κB;且体外研究[24]表明: 组成性活性Akt 可以激活鼠源双微体(murine double minute gene 2, MDM2),MDM2是一种降解p53 减少细胞凋亡的E3 泛素蛋白连接酶,而其激活和核易位可以降低p53 水平, 从而降低p53 转录活性。 本研究结果表明: TBHP 组肝癌HepG2 细胞中NF-κB、p-NF-κB 和p53 蛋白表达水平明显升高,芦丁预处理可使NF-κB、p-NF-κB 和p53 蛋白表达水平有所降低, 说明芦丁能下调NF-κB 的活化及p53 蛋白的表达,从而抑制肝细胞凋亡。上述结果表明:芦丁对PI3K/Akt 和NF-κB两条信号通路的关键蛋白表达均有一定的调控作用,提示芦丁对TBHP 引起的HepG2 细胞氧化损伤的保护作用可能与PI3K/Akt 和NF-κB 两条信号通路有关联。
综上所述,芦丁能够抑制TBHP 引起的肝细胞的氧化损伤和细胞凋亡, 其机制可能与调控PI3K/Akt 和NF-κB 这2 条信号通路有关。由于肝细胞损伤临床极为常见,部分肝损伤甚至经久不愈。芦丁具有较好的抗肝细胞氧化损伤作用,且价格低廉, 不良反应少, 故具有广泛的临床研究前景。
