GLI1 真核表达载体的构建、鉴定及其对肺癌PC9 细胞增殖的影响
2020-12-15陈微微安佳佳代娟娟
陈微微, 安佳佳, 武 艳, 代娟娟, 杜 静
(滨州医学院附属医院肿瘤研究实验室,山东 滨州256600)
肺癌是全球目前发病率和死亡率居首位的恶性肿瘤,其发病率和死亡率呈逐年升高趋势,严重影响人类健康。SHH 信号通路是调控胚胎发育和细胞增殖分化的经典信号通路,在肺癌、胃癌、大肠癌、 肝癌、 胰腺癌和乳腺癌等多种肿瘤组织中Hedgehog 轴 的 关 键 组 分 表 达 上 调[1-6]。 SHH 信 号通路处于静止时,PTCH 抑制SMO 蛋白活性,从而抑制下游通路,当处于激活状态时,PTCH 与SHH 结合后,解除对SMO 的抑制,促进GLI1 蛋白入核激活下游靶基因转录。GLI1 作为SHH 信号通路末端的一种直接调控靶基因的转录激活因子,可直接调控靶基因的转录和表达。研究[7-8]表明:针对GLI1 靶点的抑制剂GANT61 可特异性阻断人肺癌细胞和髓母瘤细胞中GLI1 表达,从而抑制肿瘤细胞增殖。有学者[9]采用RNA 干扰技术有效抑制GLI1 基因表达,该方法能明显提高人非小细胞肺癌耐药细胞对顺铂的敏感性。研究[3]显示:过表达GLI1 能促进胃癌细胞的增殖和转移,但过表达GLI1 对肺癌PC9 细胞增殖的影响国内外尚未见报道。本研究成功构建了GLI1 基因的真核表达载体,并将其转染至肺癌PC9 细胞中,通过细胞增殖和细胞克隆形成实验验证GLI1 促进细胞增殖的作用,为深入研究GLI1 在肺癌发生发展中的分子机制奠定基础,同时也为开发治疗肺癌的新靶点提供思路。
1 材料与方法
1.1细胞、主要试剂和仪器肺癌PC9 细胞和
pcDNA 3.1 过表达载体为本实验室保存。胎牛血清和RPMI1640 培养基购于美国BI 公司,质粒小提试剂盒与胶回收试剂盒购于北京天根生物公司,TRIzol 和PCR 所需引物购于上海生物工程有限公司合成,GLI1 抗体购于美国Abcam 公司,Tubulin抗体购于美国Bioworld 公司,HRP 标记的山羊抗兔抗体购于美国CST 公司, 限制性核酸内切酶Hind Ⅲ、Xba Ⅰ和T4 连接酶购于美国NEB 公司,2×Taq PCR Mix 和T- 载体试剂盒购于中国Transgen 公司,CCK-8 试剂盒购自日本同仁化学研究所。 PCR 仪购于美国ABI 公司( 型号ABI9700),37℃恒温CO2孵箱购于美国Thermo 公司, 凝胶成像仪(Bio-Rad ChemiDoc XRS+) 购于美国伯乐公司, 多功能酶标仪(BIO-TEK SynergyHIM) 购于美国Omega Bio-Tek 公司, 光学显微镜购于日本Olympus 公司, 温控细菌摇床(型号MaxQ6000) 购于美国Fisher 公司。
1.2引物设计根据GenBank 中GLI1 的序列,采用Primer 5 设计出含有Hind Ⅲ和Xba Ⅰ限制性核酸内切酶位点的GLI1 特异性引物(下划线处为酶切位点)。 引物序列: GLI1 (克隆) 上游引物5'-CCCAAGCTTCCATGTTCAACTCGATGACC-3',GLI1(克隆)下游引物5'-TGCTCTAGACTTTAGGCACTAGAGTTGAG-G-3';GLI1(鉴定)上游引物5'-CCCAATCACAAGTCAGGTTCCT-3',GLI1 (鉴定) 下游引物5'-CCTATGTGAAGCCCTATTTGCC-3'; β -actin 上 游 引 物 5'-CTCCATCCTGGCCTCGCTGT-3', β -actin 下 游引物5'-GCTGTCACCTTCACCGTTCC-3'。
1.3 GLI1的扩增和鉴定以pOTB7-GLI1 质粒为模板。反应体系:2×Taq mix 25 μL,上下游引物各2 μL (10 mmol·L-1), 无 菌 纯 水 补 足 体 系 至50 μL; 反应条件: 94 ℃、 5 min, 95 ℃、 10 s,54 ℃、 30 s, 72 ℃、 15 s, 共35 个 循 环, 72 ℃、10 min。0.5% 琼脂糖凝胶电泳后回收GLI1 目的条带并行测序鉴定。
1.4真核表达载体pcDNA3.1-GLI1的构建将测序正确的GLI1 回收产物与T 载体混合均匀,25 ℃、10 min 转化至大肠杆菌DH5α 中,涂至氨苄青霉素抗性的LB 固态培养板上,37 ℃倒置培养过夜,挑取单个菌落,扩大培养后提取质粒,并进行Hind Ⅲ和XbaⅠ双酶切鉴定、PCR 及测序鉴定。将测序正确的T-GLI1 质粒和pcDNA3.1 载体双酶切后分别切胶回收目的条带,通过T4 DNA 连接酶连 接, 转 化至大肠杆菌DH5α 中, 涂于LB 平板(含有氨苄青霉素),37 ℃倒置培养过夜,次日挑取单菌落,振荡培养过夜,小量提取重组质粒,并行双酶切鉴定。 将鉴定正确的重组质粒命名为pcDNA3.1-GLI1, 采 用Nanodrop 测 定 浓 度, 置于-20 ℃备用。
1.5真核表达载体pcDNA3.1-GLI1的细胞转染和GLI1 mRNA及蛋白表达水平检测
将PC9 细胞接种至12 孔板中,待细胞贴壁生长至70%~80% 时,准备转染。将1.5 μg 质粒溶于50 μL 培 养 基 作 为A 管, 将3 μL Lipofectamine 2000 溶于50 μL 培养基作为B 管,将A 和B 管 轻轻混合后,室温放置20 min,加入准备好的细胞中,继续培养48 h 后更换培养基,加入G418 筛选2 周后进行后续实验。将PC9 细胞分为空质粒组(给予pcDNA3.1 质粒) 和重组质粒组(给予pcDNA3.1-GLI1 质 粒)。 采 用RT-PCR 法 检 测 细 胞 中GLI1 mRNA 表 达 水 平。 将 细 胞 转 染 48 h 后,5 000 r·min-1离心收集细胞,提取细胞总RNA,采用逆转录试剂盒将RNA 反转录成cDNA,采用2×Taq PCR SuperMix 进 行PCR 鉴 定。 以2 μg cDNA 为模板(100 μg·L-1),反应体系为2×Tag mix 10 μg , 上 下 游 引 物 各1 μL (10 mmol·L-1),以无菌纯水补足体系至20 μL。反应条件:94 ℃、5 min,95 ℃、10 s,54 ℃、20 s,72 ℃、15 s,共35 个循环;72 ℃、10 min。并进行3 次重复实验,采用Image J 软件分析灰度值,以GAPDH 作为内参,计算GLI1 mRNA 表达水平。
采用Western blotting 法检测2 组细胞中GLI1蛋白表达水平。将细胞转染48 h 后,5 000 r·min-1离心收集细胞,蛋白裂解液裂解细胞30 min,BCA法测定蛋白浓度。取40 μg 蛋白与适量蛋白上样缓冲液混合均匀后, 100 ℃煮沸10 min, 进行10%SDS-PAGE 电泳分离,100 V/2 h 湿转法将目的蛋白转印至PVDF 膜上。5% 脱脂奶粉封闭膜30 min后, 根据预染蛋白Marker 裁膜, 分别孵育抗体GLI1 (1∶1 000) 和α-Tubulin (1∶1 000) 抗体过夜。次日TBST 洗膜3 次后,孵育羊抗兔标记的二抗(1∶1 000) 室温1 h,TBST 洗膜3 次后,加入ECL 底物显色液,采用凝胶成像系统进行曝光拍照。采用Image J 软件分析灰度值,以α-Tubulin为内参,计算GLI1 蛋白表达水平。
1.6 CCK-8法检测2组细胞增殖活性将细胞悬液按1×104mL-1的 细 胞 密 度, 每 孔100 μL 接 种 于96 孔板,每组设6 个平行复孔。然后分别于培养24、 48、 72 和96 h 后, 在避光条件下加入10 μL CCK-8 反应液, 在37℃细胞培养箱避光反应2 h。2 h 后用酶标仪在450 nm 处检测的吸光度(A) 值,以仅加培养液的孔为对照孔调零。以A 值表示各组细胞的增殖活性。
1.7克隆形成实验检测2组细胞克隆形成数将细胞以500 个/孔的密度接种于6 孔板,每组设3 个重复,每3 d 更换新鲜培养基继续培养10 d。将细胞采用4% 甲醛固定15 min 后,结晶紫染色10 min,采用自来水洗涤至本底干净,采用凝胶成像仪进行拍照,采用Image J 软件计算各组细胞克隆形成数。
1.8统计学分析采用Graphpad Prism 7.0 统计软件进行统计学分析。2 组细胞中GLI1 mRNA 表达水平、GLI1 蛋白表达水平、细胞增殖活性和细胞克隆形成数以x±s表示,组间比较采用t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 GLI1的扩增和重组质粒的构建及鉴定从Potb7-GLI1 质粒中克隆出GLI1 (3 300 bp) 基因片段, 见图1 A。 随后将GLI1 基因片段克隆至pcDNA3.1 (5 400 bp) 载体上,并进行Hind Ⅲ和XbaⅠ双酶切鉴定,见图1 B。经琼脂糖凝胶电泳检测,GLI1 条带大小与预期一致,双酶切鉴定结果提示GLI1 已成功插入至pcDNA3.1 载体上。
2.2 2组PC9细胞中GLI1 mRNA和蛋白表达水平将pcDNA3.1 和pcDNA3.1-GLI1 质粒分别转染PC9 细胞后,采用RT-PCR 法检测2 组PC9 细胞中GLI1 mRNA 表达水平, 与空载体组(1.016±0.085) 比 较, 重 组 质 粒 组PC9 细 胞 中GLI1 mRNA 表 达 水 平(47.138±7.087) 升 高(P<0.01);采用Western blotting 法检测GLI1 蛋白表达水平可见:与空载体组(0.561±0.061) 比较,重组质粒组PC9 细胞中GLI1 蛋白表达水平(1.334±0.055) 也明显升高(P<0.05)。见图2。
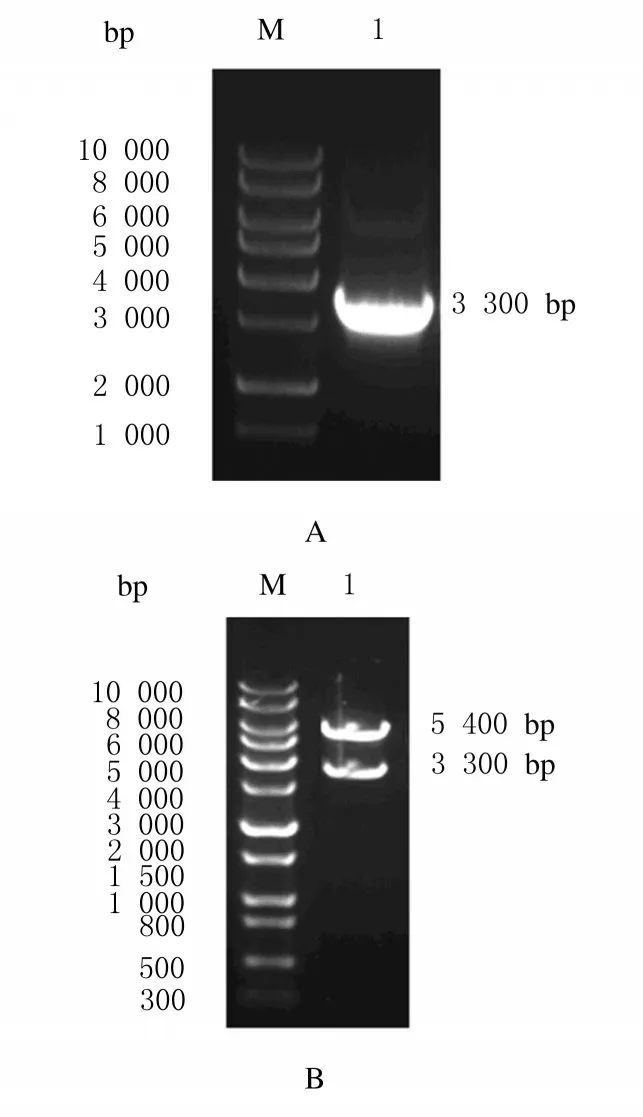
图1 GLI1 重组质粒的构建和鉴定电泳图Fig.1 Electrophoregram of construction and identification of GLI1 recombinant plasmid
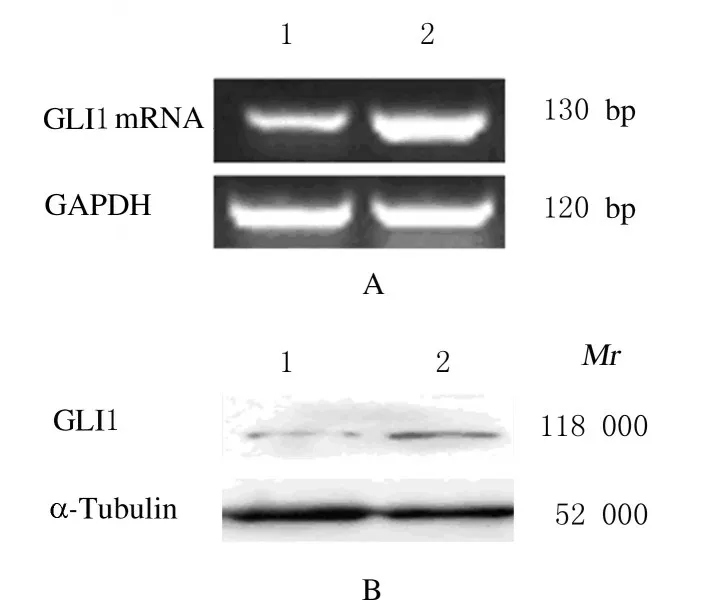
图2 2 组PC9 细胞中GLI1 mRNA(A)和蛋白(B)表达电泳图Fig.2 Electrophoregram of expressions of GLI1 mRNA(A) and protein(B) in PC9 cells in two groups
2.3 2组PC9细胞增殖活性和克隆形成数与空载体组比较,24 和48 h 时重组质粒组PC9 细胞增殖活性差异无统计学意义(P>0.05),72 和96 h细胞增殖活性明显升高(P<0.01),见图3 和图4。克隆形成实验(培养10 d) 结果显示:重组质粒组PC9 细胞克隆形成数较空载体组明显增加(P<0.01),见图5 (插页三)。
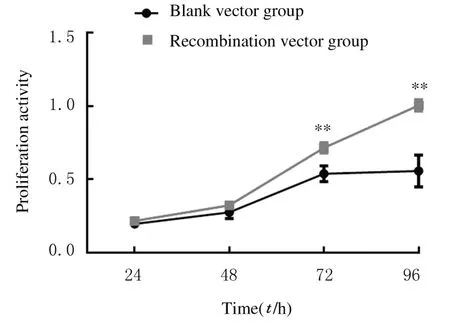
图3 各时间点2 组PC9 细胞的增殖活性Fig.3 Proliferation activities of PC9 cells in two groups at different time points
图4 2 组PC9 细胞增殖形态表现(×10)Fig.4 Morphology of proliferation of PC9 cells in two groups(×10)
3 讨 论
SHH 信号通路的异常激活在肺癌的发生发展中有重要作用[10]。该信号通路主要由分泌型糖蛋白配体SHH、2 个跨膜受体PTCH 和SMO 及核转录因子GLI 构成。GLI 蛋白家族在信号通路中占据重要地位,包含3 个成员(GLI1、GLI2 和GLI3),其中GLI1 是调控Hedgehog 通路最关键的转录因子。 本 课 题 组 前 期 研 究[11]表 明: 在 肺 癌 组 织 中GLI1 基因较癌旁组织异常高表达,且表达水平与患者预后呈负相关关系。中药半枝莲通过抑制该通路中SMO 表达,阻滞下游细胞周期检验点CyclinA等表达并抑制肺癌细胞增殖。亚硒酸钠通过下调转录因子GLI1 及其下游干细胞转录因子SOX2 抑制肺癌细胞增殖和转移[12]。Hedgehog 通路的异常激活与晚期非小细胞肺癌对顺铂耐药具有相关性[13],且该通路关键信号转导组分SMO 和GLI1 的异常表达是导致非小细胞肺癌对内皮细胞生长因子受体(epidermal growth factor receptor, EGFR) 抑制剂耐 药 和 转 移 发 生 的 重 要 机 制[14-15]。 ZHANG 等[16]研究表明:雷公藤内酯酮通过SHH-GLI1 信号通路抑 制 肺 癌 发 生。YAO 等[3]研 究 显 示:GLI1 在 胃癌组织中明显高表达,过表达GLI1 可以促进胃癌细胞增殖和转移,并且诱导药物耐药。在卵巢癌中,过表达GLI1 可以促进肿瘤发生转移[17]。在基底细胞癌中,降低PTCH 表达后抑制细胞检验点Cyclin B1, 促 进GLI1 表 达[18]。 在 胰 腺 癌 中,GLI1 调控多种致癌基因,促进肿瘤的发生[4]。在肝癌中,GLI1 可通过ERK 信号通路促进肝癌的发生、 侵 袭 和 转 移[19]。 针 对GLI1 的 靶 向 抑 制 剂 有GANT61 和GANT58 等[20], 研 究[21-22]显 示:GANT61 以剂量依赖的方式降低癌细胞增殖能力。
本研究成功构建了GLI1 的真核表达载体,建立了GLI1 稳定过表达的肺癌细胞系,同时证明了有GLI1 促进肺癌PC9 细胞增殖的能力。
