抑制B7-H4 表达对结直肠癌HT-29 细胞增殖、凋亡和迁移的影响及其机制
2020-12-15马绪哲湛玉东盖晓东
马绪哲, 湛玉东,2, 王 丹, 历 春, 盖晓东
(1.北华大学医学院病理教研室,吉林 吉林 132013;2.湖北省荆门市第一人民医院病理科,湖北 荆门 448000;3.北华大学医学院免疫教研室,吉林 吉林 132013)
结直肠癌是世界上最常见的恶性肿瘤之一。目前虽然手术治疗、放疗和化疗等常规治疗模式使患者的生存率得到一定程度的提高,但仍不甚理想,寻找结直肠癌发病机制及新的治疗方法一直备受关注。B7-H4 属于B7 家族成员之一,是一种细胞质-核穿梭蛋白[1]。研究表明:B7-H4 在卵巢癌[2]、胆囊癌[3]、肾癌[4]、肝癌[5]、胃癌[6]、膀胱癌[7]和甲状腺癌[8]组织中高表达,其表达与肿瘤的发生发展及预后有密切关系。本课题组前期研究[9]证实:B7-H4 的表达与结直肠癌的浸润深度和淋巴结转移呈正相关关系,血清中B7-H4 的表达与结直肠癌的浸润深度、肿瘤大小及淋巴结转移呈正相关关系[10]。因此本课题组推测B7-H4 与结直肠癌的发展和转移有密切关联。目前,有关B7-H4 与结直肠癌关系的研究不多,对其作用机制的研究更少见。本实验通过转染B7-H4 shRNA 抑制结直肠癌HT-29 细 胞 中B7-H4 的 表 达, 观 察 抑 制B7-H4 对HT-29 细胞生物学特性的影响,并对其分子机制进行初步探讨。
1 材料与方法
1.1细胞、主要试剂和仪器人结直肠癌HT-29细胞购自美国模式培养物集存库(American Type Culture Collection, ATCC)。 DME/F-12 培 养 液(美国HyClone 公司),胎牛血清(美国Gemini 公司), pSilencer4.1-B7-H4-shRNA 和pSilencer4.1-scrambled shRNA (上海生工生物工程公司),G418 (美国Sigma 公司), LY294002 和雷帕霉素(上海碧云天生物技术公司),B7-H4 单克隆抗体、Bcl-2 单克隆抗体和Caspase-3 单克隆抗体(美国Cell Signaling Technology 公 司), X-tremeGENE HP DNA 转染试剂盒(美国Roche 公司),细胞周期试剂盒和细胞凋亡试剂盒(美国Millipore 公司),基质金属蛋白酶2 (matrix metalloproteinase 2,MMP-2) ELISA Kit、基质金属蛋白酶9 (matrix metalloproteinase 9,MMP-9) ELISA Kit 和CCK-8试剂盒(上海碧云天生物技术公司),Transwell 小室(美国Corning 公司), RNAiso Plus 试剂盒和PrimeScript ™RT 试 剂 盒(日 本TaKaRa 公 司)。Western blotting 电泳设备(美国Bio-Rad 公司),全自动酶标仪(瑞士Tecan 公司),实时荧光定量PCR (RT-qPCR) 检测系统(美国Thermo 公司),流式细胞仪(美国Millipore 公司)。
1.2细胞培养和转染将人结直肠癌HT-29 细胞接种于培养瓶中,加入含10% 胎牛血清和双抗的DME/F-12 培养基,置于37 ℃、5% CO2、相对饱和湿度的培养箱中培养传代。 取对数生长期的HT-29 细胞以每孔6×105个细胞的密度接种至6 孔板中, 当细胞达到70%~80% 融合时进行转染。按照X-tremeGENE HP DNA 转染试剂盒说明书操作, 分 别 转 染 pSilencer4.1-B7-H4-shRNA 和pSilencer4.1-scrambled shRNA 载 体 至HT-29 细 胞,转染24 h 后加入G418 (600 mg·L-1) 进行压力筛选,3 周后获得稳定的单克隆细胞株。将细胞分为B7-H4 shRNA 组 和scramble shRNA 组。
1.3 RT-qPCR法检测2组HT-29细胞中B7-H4 mRNA表达水平按照RNAiso Plus 试剂盒说明书提取RNA,按照PrimeScript™RT 试剂盒说明书进行逆转录, 将得到的cDNA 作为模板进行RT-qPCR 检测,反应体系为10 μL,B7-H4 引物上游序列为5′-TAT TAG CAG CCG CTC TGT GC-3′,下 游 序 列 为5′-TCA GGA TTC CAT CCT CCC CA-3′; GAPDH 引物上游序列为5′-ATG GGG AAG GTG AAG GTC G-3′, 下 游 序 列 为5′-GGG TCA TTG ATG GCA ACA ATATC-3′。反应条件: 95 ℃、 15 min, 95 ℃、 10 s, 60 ℃、10 s, 共40 个 循 环。 以GAPDH 为 内 参, 采 用2-△△Ct法 分 析 各 组HT-29 细 胞 中B7-H4 mRNA 表达水平。
1.4 Western blotting法检测2组HT-29细胞中B7-H4、Bcl-2和Caspase-3蛋白表达水平胰蛋白酶消化收集2 组细胞,PBS 充分洗涤细胞后,置于含RIPA 缓冲液的蛋白裂解液中冰上孵育30 min,4℃、 15 000 g 离心15 min 后收集上清液。 采用BCA 法测总蛋白浓度,蛋白上样量为30 μg,10%SDS-PAGE 电泳1 h, 湿转法将胶内蛋白转到PVDF 膜上,采用5% BSA 室温封闭1 h,弃去封闭液,加入B7-H4、Bcl-2、Caspase-3 和β-actin 抗体(1∶1 000) 4 ℃孵育过夜。 次日,TBST 洗涤PVDF 膜3 次,加入HRP 标记的二抗(1∶2 000)室温孵育1 h。TBST 洗涤3 次,ECL 发光并拍照,以β-actin 作为内参。目的蛋白表达水平= 目的蛋白条带灰度值/β-actin 条带灰度值。
1.5 CCK-8法检测2组HT-29细胞增殖活性将对数生长期的2 组细胞以每孔5×103个细胞的密度接种于96 孔板,每组设3 个复孔。2 组细胞分别培养24、48、72 和96 h 后 每 孔 添 加10 μL CCK-8 溶液继续培养2 h。采用酶标仪检测2 组细胞在酶标仪450 nm 处的吸光度(A) 值,以A 值代表各组HT-29 细胞增殖活性。以时间为横坐标、以A值为纵坐标绘制细胞生长曲线。
1.6流式细胞术检测2组HT-29细胞周期和细胞凋亡率细胞周期检测:取对数生长期的2 组细胞(1×106mL-1) 于EP 管中,每组收集3 管细胞,加入预冷无水乙醇,4℃固定过夜。次日,弃固定液后按照Muse™细胞周期试剂盒说明书进行操作,滤网过滤细胞,采用流式细胞术检测2 组不同细胞周期细胞百分率。细胞凋亡率检测:取对数生长期的各组细胞(1×106mL-1) 于EP 管中,每组收集3 管细胞。按照ApopNexin™FITC 凋亡试剂盒说明书进行Annexin Ⅴ/PI 双染色,采用流式细胞术检测2 组细胞凋亡率。
1.7 Transwell法检测2组HT-29细胞的迁移细胞数取对数生长期的2 组细胞,无血清培养基重悬2 组细胞,将重悬液以1×105mL-1(100 μL) 置于Transwell 小室(孔隙8 μm) 的上室, 下室加入600 μL 含有10% 胎牛血清的培养液。培养24 h 后,采用棉球擦去上室残留的细胞, 多聚甲醛固定15 min,PBS 洗涤3 次,苏木素染色5 min,蒸馏水清洗后自然风干,在倒置显微镜下观察2 组迁移细胞数。
1.8 ELISA法检测2组HT-29细胞上清液中MMP-2和MMP-9水平2 组 细 胞 培 养72 h ,2 000 g 离心10 min 后收集细胞培养上清液,然后按照ELISA 试剂盒说明书操作检测各组HT-29细胞上清液中MMP-2 和MMP-9 水平。
1.9 PI3K/Akt/mTOR信号通路调控后HT-29细胞中B7-H4 mRNA和蛋白表达水平的检测取对数生长期的HT-29 细胞以每孔5×105个细胞的密度接种于6 孔板,培养过夜。采用PI3K/Akt 抑制剂LY294002 (10 μmol·L-1, LY294002 组) 和mTOR 抑制剂雷帕霉素(50 nmol·L-1,雷帕霉素组) 24 h 持续作用于HT-29 细胞;同时设未加抑制剂 的 对 照 组。 收 集 细 胞, 分 别 采 用“1.3” 和“1.4” 中的方法检测各组HT-29 细胞中B7-H4 mRNA 和蛋白表达水平。
1.10统计学分析采用SPSS 17.0 统计软件进行统计学分析。各组细胞中B7-H4 mRNA 和蛋白表达水平、细胞增殖活性、不同细胞周期细胞百分率、 细胞凋亡率、 迁移细胞数及细胞中Bcl-2、Caspase-3、 MMP-2 和MMP-9 蛋白表达水平均符合正态分布且方差齐性,以-x±s表示,组间比较采用t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 2组HT29细 胞 中B7-H4 mRNA和 蛋白表 达情况RT-qPCR 检测结果显示: 与scramble shRNA 组(1.000 ± 0.100) 比较,B7-H4 shRNA组HT29 细胞中B7-H4 mRNA 表达水平(0.480 ±0.120) 明显降低(P<0.01)。Western blotting 检测结果显示: 与scramble shRNA 组比较, B7-H4 shRNA 组HT29 细胞中B7-H4 蛋白表达量降低。见图1。

图1 Western blotting 法检测2 组HT-29 细胞中B7-H4 蛋白表达电泳图Fig.1 Electrophoregram of expressions of B7 - H4 protein in HT - 29 cells in two groups detected by Western blotting method
2.2 2组HT-29细胞增殖活性采用B7-H4 沉默后,HT-29 细胞增殖活性明显降低。 作用72 和96 h 时,B7-H4 shRNA 组HT-29 细 胞 增 殖 活 性 低于scramble shRNA 组(P<0.05)。见图2。
2.3 2组不同细胞周期HT-29细胞百分率与scramble shRNA 组 比 较, B7-H4 shRNA 组G0/G1期和S 期HT-29 细胞百分率比较差异无统计学意义(P>0.05)。见图3 (插页四) 和图4。
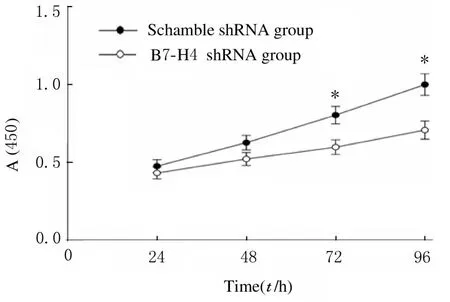
图2 CCK-8 法检测2 组HT-29 细胞增殖活性Fig.2 Proliferation activities of HT-29 cells in two groups detected by CCK-8 method
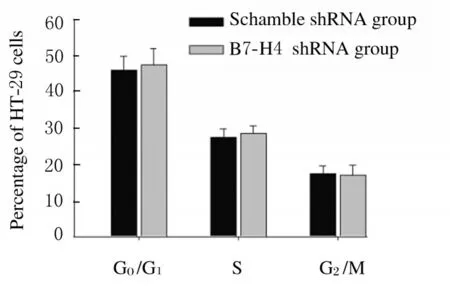
图4 2 组不同细胞周期HT-29 细胞百分率Fig.4 Percentages of HT-29 cells at different cell cycles in two groups
2.4 2组HT-29细胞 凋 亡 率B7-H4 shRNA 组 细胞 凋 亡 率 为(24.550 ± 2.810)%, scramble shRNA 组 细 胞 凋 亡 率 为(8.740 ± 1.620) % 。B7-H4 shRNA 组细胞凋亡率较scramble shRNA 组明显升高(P<0.01)。见图5。
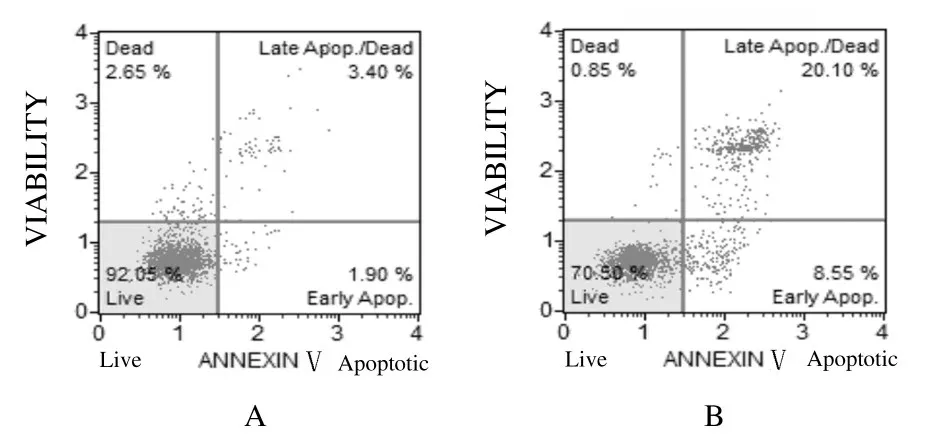
图5 流式细胞术检测2 组HT-29 细胞凋亡率Fig.5 Apoptotic rates of HT - 29 cells in two groups detected by flow cytometry
2.5 2组HT-29细胞中Bcl-2和Casapse-3蛋白表达量与scramble shRNA 组比较, B7-H4 shRNA组HT-29 细胞中Bcl-2 蛋白表达量降低,Casapse-3蛋白表达量升高。见图6。
2.6 2组HT-29细胞迁移细胞数与scramble shRNA 组[(210.000±15.600) 个] 比较, B7-H4 shRNA 组迁移细胞数[(74.000±8.200) 个]明显降低(P<0.01)。见图7 (插页四)。
2.7 2组HT-29细胞上清液中MMP-2和MMP-9水平与scramble shRNA组[(3.150±0.280) μg·L-1和 (2.120±0.300) μg·L-1] 比 较 , B7-H4 shRNA 组 HT-29 细 胞 上 清 液 中 MMP-2[ (2.000±0.340) μ g·L-1] 和 MMP-9[(1.150±0.270) μ g·L-1] 水平均明显降低(P<0.05)。
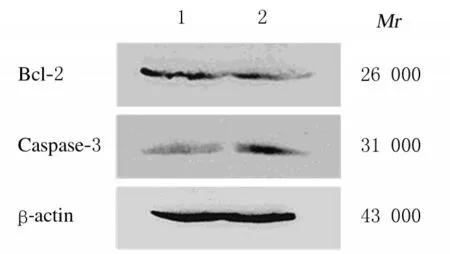
图6 Western blotting 法检测2 组HT-29 细胞中Bcl-2 和Caspase-3 蛋白表达电泳图Fig.6 Electrophoregram of expressions of Bcl - 2 and Caspase-3 proteins in HT-29 cells in two groups detected by Western blotting method
2.8 PI3K/Akt/mTOR信号通路调控前后HT-29细胞中B7-H4 mRNA和蛋白表达水平与对照组(1.000 ± 0.110 和 1.000 ± 0.100) 比 较,LY294002 组(0.560 ± 0.140) 和 雷 帕 霉 素 组(0.510 ± 0.120) HT-29 细 胞 中B7-H4 mRNA 表达水平均降低(P<0.05)。 Western blotting 法检测结果显示:与对照组比较, LY294002 组和雷帕霉素组HT-29 细胞中p-Akt、p-mTOR 和B7-H4 蛋白表达水平均降低。见图8 和图9。
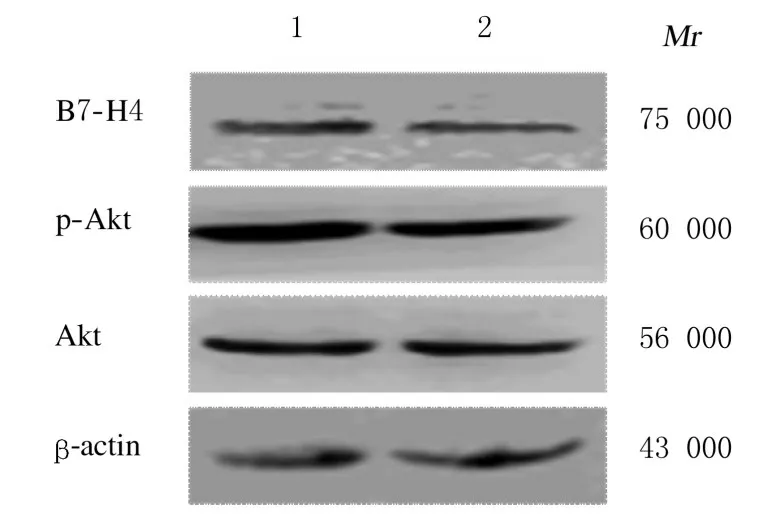
图8 Western blotting 法检测加入LY294002 前后2 组HT-29 细胞中B7-H4、p-Akt 和p-mTOR 表达电泳图Fig.8 Electrophregram of expressions of B7-H4, p-Akt,and p-mTOR proteins in HT-29 cells before and after LY294002 treatment in two groups detected by Western blotting method
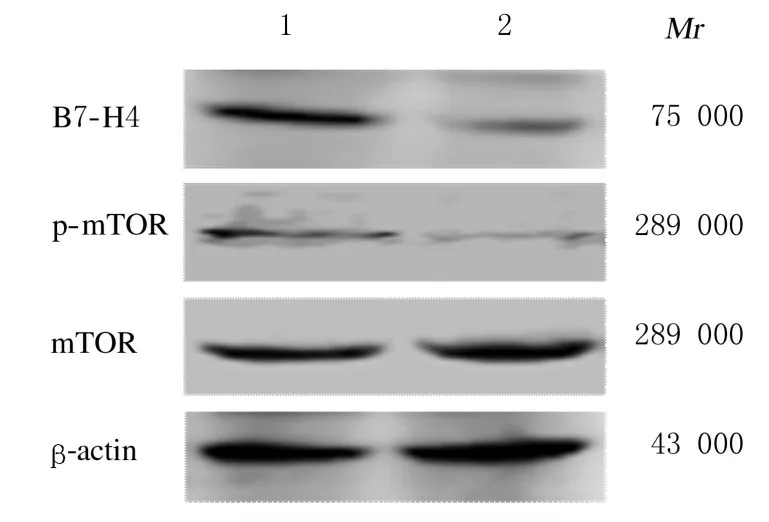
图9 Western blotting 法检测加入雷帕霉素前后2 组HT-29细胞中B7-H4、p-Akt 和p-mTOR 蛋白表达电泳图Fig.9 Electrophregram of expressions of B7-H4, p-Akt,and p-mTOR proteins in HT -29 cells before and after rapamycin treatment in two groups detected by Western blotting method
3 讨 论
B7-H4 是新近发现的B7 家族新成员,对T 淋巴细胞介导的免疫应答起重要的负性调节作用[11]。研 究[2-8,12]表 明: B7-H4 在 多 种 肿 瘤 组 织 中 高 表达,与肿瘤的发生发展和预后有密切关联。此外,在多种肿瘤患者的血液样本中也可检测到可溶性B7-H4 (sB7-H4),提示sB7-H4 可为肿瘤的诊断及预后提供一个新靶点[13-15]。本课题组前期研究[9-10]显示:结直肠癌患者的癌组织和血清中B7-H4 均高表达,且与结直肠癌的发展呈正相关关系。上述研究表明:B7-H4 可能通过某些潜在的机制促进结直肠癌的发生发展。因此,探讨B7-H4 在结直肠癌细胞增殖、凋亡和迁移中的作用可为结直肠癌的基因治疗提供依据。
本研究通过在结直肠癌HT-29 细胞中转染B7-H4 shRNA 抑制B7-H4 表达,并采用RT-qPCR 和Western blotting 法验证转染效果证实:转染B7-H4 shRNA 能够有效抑制HT-29 细胞中B7-H4 的表达;CCK-8 实验结果显示:抑制B7-H4 的表达能够明显抑制HT-29 细胞的增殖能力;流式细胞术分析结果表明: 抑制B7-H4 的表达可有效提高HT-29细胞凋亡率,但对HT-29 细胞周期分布并无影响。
细胞凋亡与肿瘤的发生发展有密切关联,诱导肿瘤细胞凋亡可抑制肿瘤进一步发展。细胞凋亡分子调控机制研究[16-17]显示:细胞线粒体中的促凋亡和抗凋亡Bcl-2 家族蛋白之间的平衡改变,可诱导Caspase-8 和Caspase-3 的活化,从而导致细胞凋亡的发生。本研究结果显示:在B7-H4 shRNA 转染的HT-29 细胞中,抗凋亡蛋白Bcl-2 表达下调,促凋亡蛋白Caspase-3 表达上调,提示B7-H4 沉默诱导的细胞凋亡机制主要是通过线粒体途径实现。
肿瘤的迁移是个复杂过程,主要表现为肿瘤细胞骨架重排、肿瘤细胞和基底膜黏性增加,细胞外基质(extracellular matrix, EMC) 分泌金属蛋白酶(matrix metalloproteinase,MMPs)[18]。MMPs,尤其是MMP-2 和MMP-9,能够降解多种ECM 大分子加快肿瘤细胞的侵袭[19]。 此外, MMP-2 和MMP-9 的高表达与肿瘤患者的不良预后有关联[20-21]。 本 研 究 沉 默B7-H4 表 达 后 发 现: HT-29 细胞迁移能力、 MMP-2 和MMP-9 表达水平均降低,即B7-H4 表达受到抑制后,HT-29 细胞迁移能力降低可能与MMPs 分泌减少有关联。
信号通路的异常激活与肿瘤的发生发展有密切关 联[22]。 PI3K/Akt/mTOR 信 号 通 路 是 近 二 十 年来研究最为广泛的信号通路之一,研究[23-25]显示:PI3K/Akt/mTOR 信号通路的激活可促进结直肠癌的发生发展。本研究探讨PI3K/Akt/mTOR 信号通路对HT-29 细胞中B7-H4 表达影响的结果显示:抑制p-Akt 和p-mTOR 蛋白表达后,B7-H4 mRNA和蛋白质的表达均明显降低,提示B7-H4 可能通过PI3K/Akt/mTOR 信号通路调节结直肠癌细胞的生物学行为。
本研究结果证实:靶向性shRNA 沉默B7-H4能够有效抑制HT-29 细胞增殖、细胞凋亡和细胞迁移,其机制可能与调控PI3K/Akt/mTOR 信号通路有关联。本研究为探讨结直肠癌的致病机制和靶向治疗提供了实验依据。
