电离辐射对小鼠骨髓造血干/祖细胞中CD47 表达的影响
2020-12-15谢光耀刘岩厚杨永广
谢光耀, 王 锋, 张 婷, 刘岩厚, 杨永广
(吉林大学第一医院转化医学研究院 人类疾病动物模型国家地方联合工程实验室,吉林 长春130062)
骨髓抑制是临床肿瘤患者接受放疗或化疗药物后常见的不良反应之一。骨髓抑制也是意外暴露于电离辐射所致的造血系统严重损伤和致死原因。因此如何避免电离辐射诱导的骨髓抑制及后续造血系统功能障碍是目前辐射损伤医学和临床肿瘤治疗面临的重大问题。造血干/祖细胞具有自我更新和增殖能力,与神经组织等比较,其对辐射损伤更为敏感。研究[1]显示:与处于相对静息状态的造血干细胞(hematopoietic stem cells, HSCs) 比较,快速增殖的造血祖细胞(hematopoietic progenitor cells, HPCs) 更容易通过诱导凋亡等方式发生损伤。除急性损伤外,受到全身辐射的患者还可能发生HSCs 储备减少,自我更新能力下降等,进而产生长期造血功能障碍[2-4]。CD47 是一种广泛表达于各种细胞的跨膜蛋白,是巨噬细胞识别 “自我” 的关键分子。CD47 作为配体与巨噬细胞表面信号调节 蛋 白α (surface signaling regulatory protein α,SIRPα) 结合, 抑制巨噬细胞的吞噬功能[5]。 研究[6] 显 示: HSCs 在 活 化 剂 的 刺 激 下 可 以 上 调CD47 的表达,降低被巨噬细胞吞噬的风险。细胞膜表面CD47 构象改变不仅影响表达量,而且也会影响巨噬细胞吞噬的敏感性[7]。CD47 本身也是一种信号分子,可通过不同机制影响细胞功能[8-10]。阻断CD47 信号可提高内皮细胞和肌肉组织等对电离辐射损伤的抵抗能力[11-13],但电离辐射对HSCs中CD47 表达的影响国内外尚未见报道。因此,深入研究HSCs 中CD47 信号通路与放射损伤的关系具有重要意义。本研究检测接受全身电离辐射小鼠骨髓HSCs/HPCs 比例及CD47 表达水平的变化,探讨HSCs 在照射后高表达CD47 与其自我更新能力下降的关系,为干预电离辐射造成的HSCs 损伤提供实验依据。
1 材料与方法
1.1实验动物、主要试剂和仪器24 只6 ~8 周龄C57BL/6 雄性健康小鼠,小鼠购自北京维通利华实验动物技术有限公司, 动物生产许可证号:SCXK (京) 2016-0011,动物饲养于吉林大学第一医院实验动物中心无特定病原体(SPF) 级动物房,本实验获得吉林大学第一医院动物伦理委员会批准。 所用细胞均为取自小鼠骨髓的原代细胞。FITC 抗鼠lineage 鸡尾酒抗体、PE/Cy7 抗鼠c-Kit抗体和7-AAD 细胞活性染液购自美国Biolegend 公司, Percp/Cy5.5 抗 鼠 Sca-1 抗 体 购 自 美 国eBioscience 公司, 荧光素原位凋亡检测试剂盒(S7110) 购 自 德 国Merck 公 司。 小 动 物 辐 照 仪(RS2000) 购自美国Rad Source 公司,流式细胞仪(LSR Fortessa) 购自美国BD 公司,激光共聚焦显微镜(LSM 880) 购自德国ZEISS 公司。
1.2电离辐射损伤模型的建立将C57BL/6 小鼠分为未照射组(5 只) 和照射组(20 只),其中照射组小鼠分为照射后18 h 组、 5 d 组、 11 d 组和6 周组,每组5 只。除未照射组小鼠外,其他小鼠均一次性给予3.0 Gy X 射线全身照射。采用X 射线辐照仪对小鼠进行全身照射, 照射剂量率为1.63 Gy·min-1,依实验需求一次性给予总剂量为3 Gy 或9 Gy X 射线照射。照射前1 周和照射后1 周小鼠饮水中添加庆大霉素。
1.3流式细胞术检测各组小鼠HSCs/HPCs比例和骨髓细胞中CD47表达水平电离辐射后不同时间点处死小鼠,取股骨和胫骨,采用注射器吹出骨髓,取新鲜骨髓细胞制备单细胞悬液。经红细胞裂解液裂解红细胞,以FACS 缓冲液洗涤后,取5×106个细胞,采用抗体稀释液重悬,加入流式抗体,轻微震荡混匀后冰浴避光染色30 min, 经PBS 洗涤2 次,采用流式细胞术检测HSCs/HPCs比例及骨髓细胞中CD47 表达水平。
1.4各组小鼠骨髓组织中细胞凋亡情况检测分别取未照射小鼠和9 Gy 照射后小鼠股骨,4% 多聚甲醛固定24 h, PBS 洗涤后, 置于10% EDTA(pH 7.4) 中,4 ℃振荡脱钙72 h。PBS 洗涤3 次,进行脱水、置换、石蜡包埋及切片。采用荧光素原位凋亡检测试剂盒进行骨髓组织凋亡染色,采用Hoechst 33342 对细胞核进行复染,骨髓组织中凋亡细胞发出绿色荧光,采用激光共聚焦显微镜对股骨切片样品进行成像。
1.5统计学分析采用GraphPad Prism 7.0 统计软件进行统计学分析。各组小鼠HSCs/HPCs 比例以x±s表示,组间样本均数比较采用独立样本t检验。HPCs 占lin-细胞百分率不符合正态分布,多组间比较采用非参数检验;HSCs 占骨髓单个核细胞和占骨髓lin-细胞百分率,HPCs 和HSCs 及其他骨细胞表面CD47 的表达水平均符合正态分布,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.01 为差异有统计学意义。
2 结 果
2.1未照射组小鼠HSCs/HPCs中表达CD47水平与成熟(lineage-positive, lin+) 造血系细胞比较,在正常小鼠骨髓细胞中,富含小鼠HSCs/HPCs 的细胞亚群中CD47 表达水平更高(图1)。其中,富含HPCs 的lin-c-kit+Sca-1-细胞中CD47表达水平高于成熟细胞1 倍以上(P<0.01),富含HSCs 的LSK (lin-Sca-1+c-kit+) 细 胞 中CD47 表达水平也高于成熟细胞,而低于HPCs (图2)。
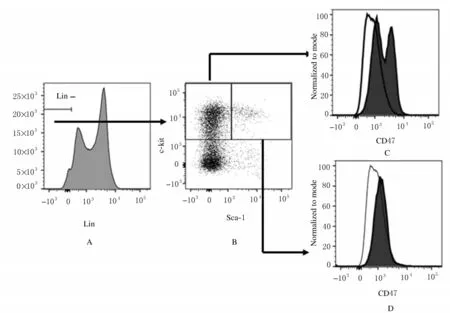
图1 未照射组小鼠骨髓造血干/祖细胞中CD47 表达Fig.1 Expressions of CD47 in bone marrow HSCs/ HPCs of mice in non-irradition group
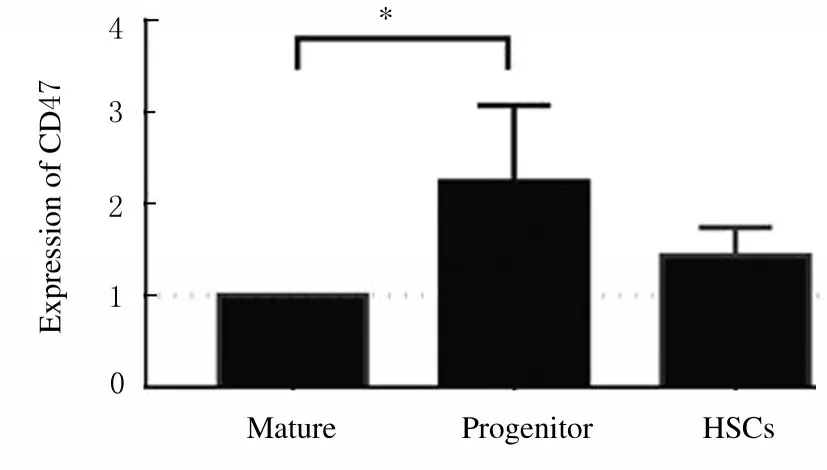
图2 流式细胞术检测未照射组小鼠骨髓HSP/HPCs 中CD47 表达Fig.2 Expressions of CD47 in bone marrow HPCs/HSCs of mice in non-irradition group detected by flow cytometry
2.2各组小鼠骨髓HSCs和HPCs百分率与未照射组比较,9 Gy X 射线照射组小鼠骨髓组织中存在大量凋亡细胞(图3,见插页四);3 Gy X 射线照射组小鼠骨髓HPCs 百分率短期降低,LSK 细胞百分率降低(图4)。
与照射前(46.64%±10.41%) 比较, 3 Gy X 射线照射后18 h 组,小鼠骨髓HPCs (lin-c-kit+Sca-1-) 占lin-细胞的百分率(18.53%±6.08%)明显降低(P<0.05);与照射后18 h 组比较,照射后5 d 组小鼠, 骨髓HPCs 占lin-细胞的百分率(9.50%±2.16%) 进一步降低(P<0.01);照射后6 周 组 小 鼠 骨 髓HPCs 占lin-细 胞 的 百 分 率(48.53%±17.15%) 恢复正常。与未照射组比较,经3 Gy X 射线照射组小鼠HPCs 占全骨髓单个核细胞的百分率降低。照射18 h 组(0.31%±0.29%)和照射11 d 组(0.38%±0.11%) 小鼠HPCs 占全骨髓单个核细胞的百分率明显降低(P<0.01),并在照射后6 周恢复至未照射组水平(2.05%±0.13%)。3 Gy X 射线照射后18 h 组小鼠骨髓LSK HSCs 占lin-细胞百分率(11.77%±3.54%) 高于照射前(2.96%±0.98%)(P<0.01),占全骨髓单个核细胞的百分率变化不明显。 照射后5 d 和11 d 组HPCs占lin-细胞的百分率(0.14%±0.09%)和占全骨髓细胞的百分率(0.008%±0.003%) 降低(P<0.01),照射后6周组未恢复到正常水平。见图5。
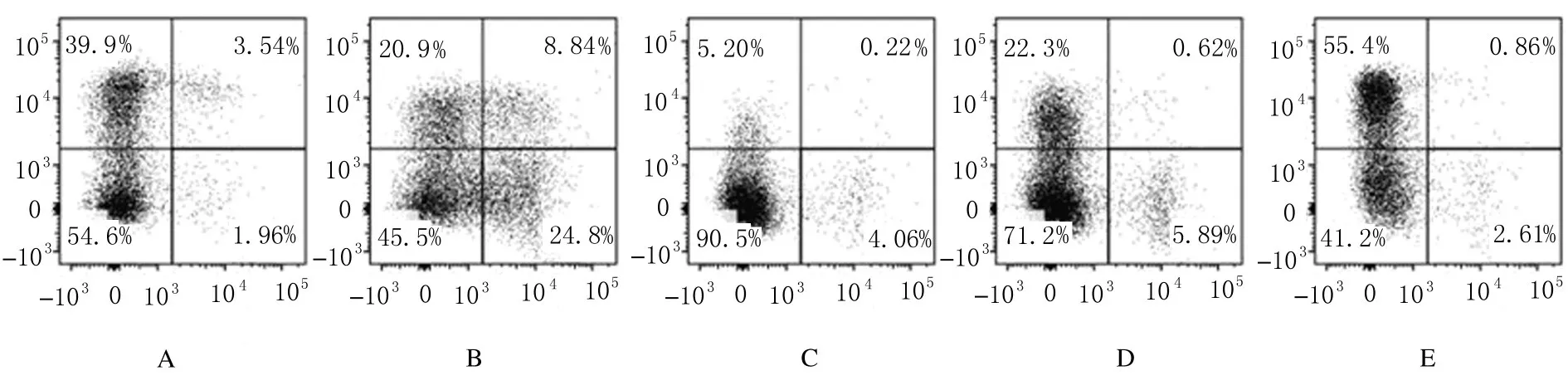
图4 3 Gy X 射线照射后各组小鼠HPCs 和HSCs 百分率流式图Fig.4 Flow cytometry diagram of percentages of HPCs and HSCs of mice after 3 Gy X-ray irradiation
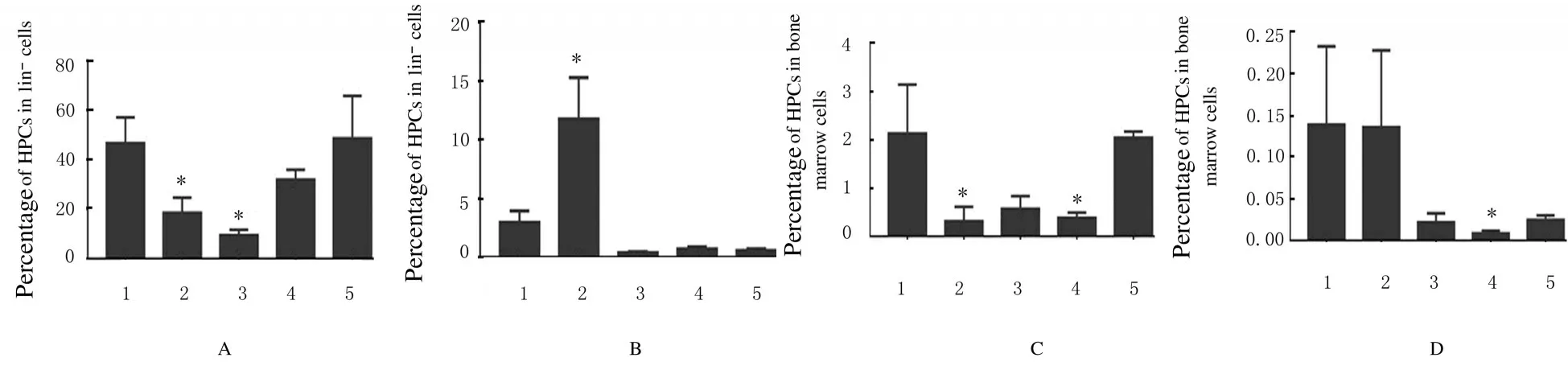
图5 流式细胞术检测3 Gy X 射线照射后不同时间点各组小鼠HSCs 和HPCs 百分率Fig.5 Percentages of HPCs and HSCs of mice at different time points after 3 Gy X-ray irradiation detected by flow cytometry
2.3各组小鼠骨髓HSCs和HPCs中CD47表达水平经3 Gy X 射线全身照射后18 h ~6 周,小鼠骨髓成熟造血系细胞中CD47 表达水平与未照射组比较差异无统计学意义(P>0.05)(图6)。同样条件下,与未照射组比较,照射后18 h 组、照射后5 d 组和照射后11 d 组小鼠骨髓HPCs 中CD47 表达水平有所升高, 但差异无统计学意义(P>0.01)(图7)。与未照射组比较,照射后18 h 组小鼠骨髓LSK HPCs 中CD47 表达水平升高近1 倍(P<0.01);照射后5 d 组小鼠骨髓LSK HPCs 中CD47 表达水平恢复到未照射组水平(图7)。
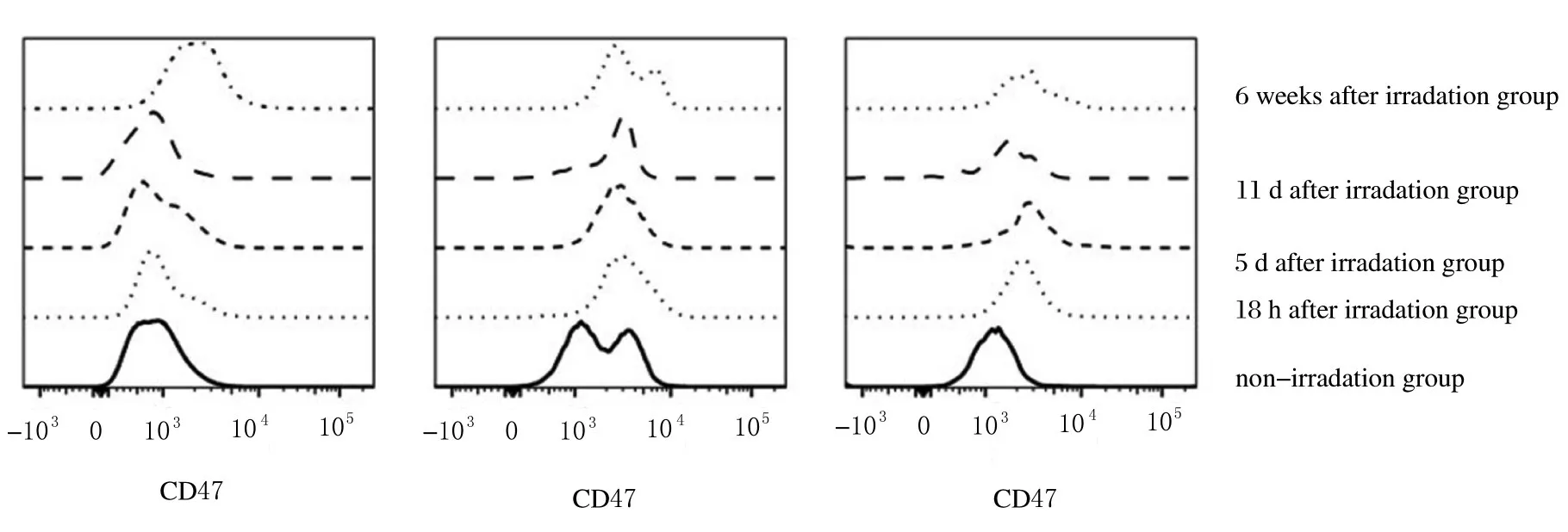
图6 3 Gy X 射线照射后不同时间点小鼠HSCs 和HPCs 中CD47 表达水平趋势图Fig.6 Trend chart of expressions of CD47 in HSCs and HPCs of mice at different time points after 3 Gy X-ray irradiation
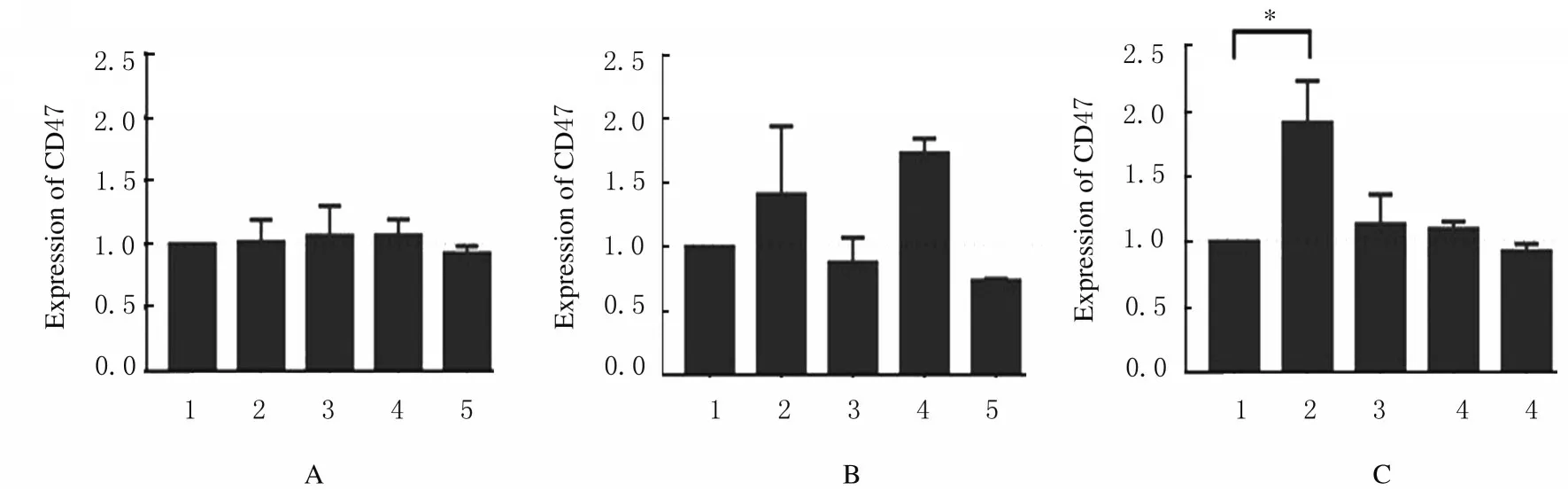
图7 3 Gy X 射线照射后不同时间点各组小鼠HSCs/HPCs 中CD47 表达水平直条图Fig.7 Histogram of expression levels of CD47 in HPCs and HSCs of mice in various groups at different time points after 3 Gy X-ray irradiation
2.4各组小鼠骨髓HPCs中CD47低表达亚群百分率正常小鼠骨髓HPCs 分为CD47 高表达与低表达2 个亚群(图8)。经3 Gy X 射线照射组CD47 高表达和低表达亚群的CD47 表达水平与未照射组(4.85%±2.11%) 接近(图9A)。 但3 Gy X 射线照射后18 h 组CD47 低表达亚群百分率(4.85%±2.11%) 与 未 照 射 组 (58.83%±19.56%) 比较明显降低(P<0.01),随后恢复至未照射组水平(图9B)。
3 讨 论
因肿瘤治疗而接受放疗或意外暴露于电离辐射后造成骨髓抑制是引起造血功能损伤甚至患者死亡的重要原因。辐射引起的HSCs/HPCs 损伤是其自我更新能力下降的原因之一。 有研究[11-13]表明:CD47 在肿瘤和正常组织的电离辐射损伤中发挥重要作用。因此研究HSCs/HPCs 损伤与CD47 的表达变化,对于发现靶点和干预电离辐射引起的骨髓抑制及改善造血重建意义重大。
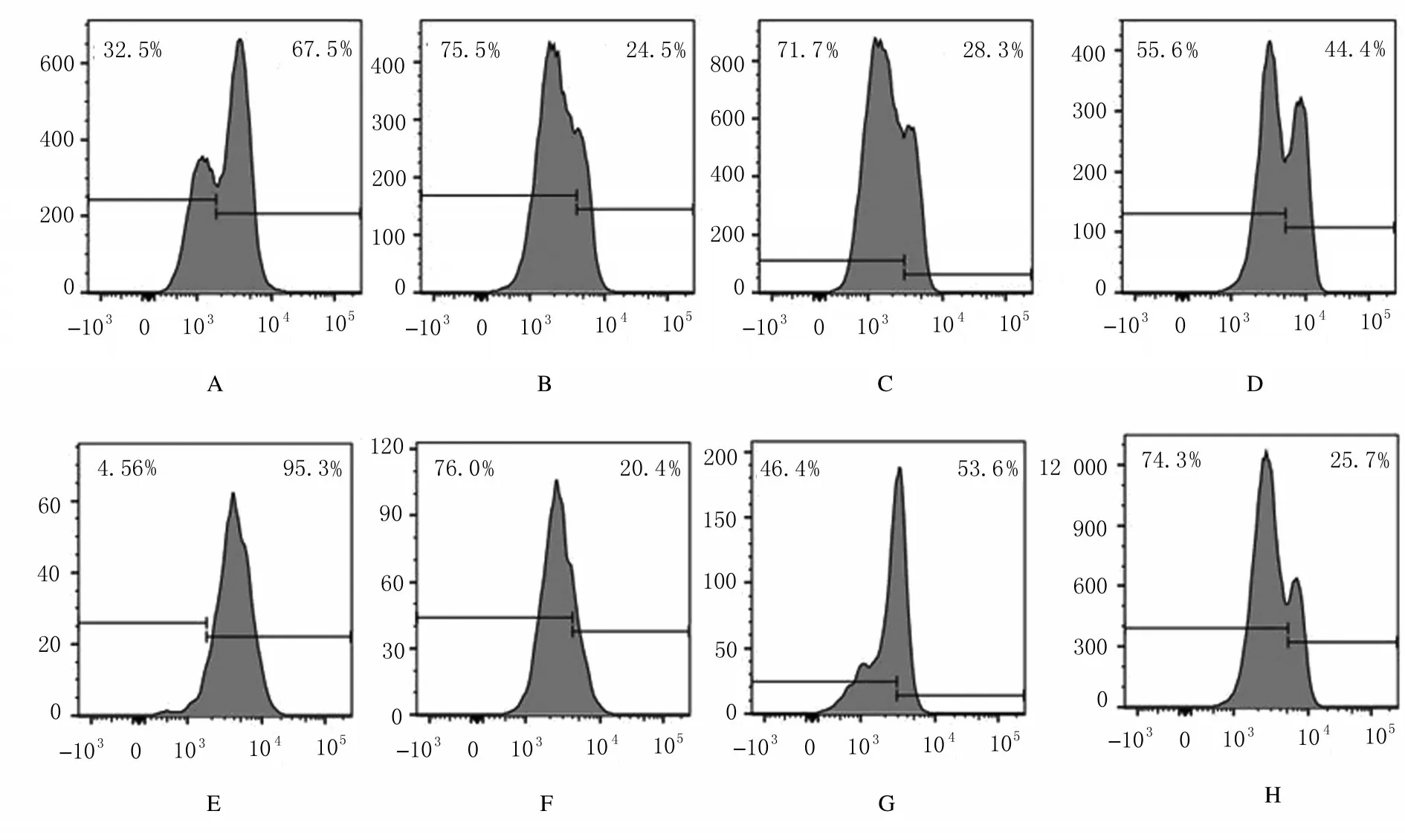
图8 3 Gy X 射线照射后不同时间点小鼠HPCs 中CD47 表达水平流式图Fig.8 Flow cytometry diagram of expressions of CD47 in HPCs of mice in various groups at different time points after 3 Gy X-ray irradiation
机体受到电离辐射后数小时至数日内即可发生急性放射性综合征(acute radiation syndrome,ARS)。接受大于5.5 Gy X 射线的全身照射会引起胃肠道ARS,大于20 Gy X 射线的全身照射会引起神经组织ARS。低于1.0 Gy 的全身照射即可引起骨髓抑制,进而造成造血系统损伤,说明与其他组织比较,HSCs/HPCs 对辐射损伤更为敏感[14]。本文作者发现:经3 Gy X 射线照射后小鼠急性损伤期LSK HSCs 由于处于相对静息状态,其数量并未立即大量减少,但在随后骨髓造血祖细胞和成熟细胞逐渐恢复时,LSK HSCs 的比例一直维持在较低水平,可见其自我更新能力受到了损伤。电离辐射损伤HSCs 的机制包括诱导凋亡、诱导分化、诱导老化和损伤骨髓造血微环境等[15-17],也可能与HSCs/HPCs 表面受体有关联。
HSCs 表面CD47 对其存活具有重要功能。一方面CD47 作为巨噬细胞SIRPα 的配体,抑制巨噬细胞的吞噬。本研究中,与成熟细胞比较,未照射组骨髓造血祖细胞高表达CD47, 在照射后早期HSCs 中CD47 低表达亚群减少,除照射的直接损伤外,也可能与照射后骨髓应激环境下活化的巨噬细胞吞噬有关联。HSCs 被炎症信号动员进入循环时,表面CD47 表达水平上调,以保护自身不被巨噬细胞吞噬[6],该报道与本研究结果一致。嗜血细胞综合征患者HSCs 表面CD47 表达水平降低是导致其被巨噬细胞吞噬和全血细胞减少的主要病理机制[18];采用抗体阻断造HSCs 表面CD47,可帮助清除小鼠骨髓HSCs,改进骨髓移植中预处理的方案[19- 20]。 另一方面, CD47 作为细胞表面受体对HSCs 的存活发挥作用。本研究结果提示:小鼠在受到全身电离辐射后短期内骨髓LSK HSCs 中CD47 表达水平明显升高。缺失或阻断CD47 信号通路对照射损伤有保护作用。CD47 通过调控凋亡、代谢和氧化应激等多种机制影响细胞系、内皮细胞、 皮肤及肺等多种细胞和组织的电离辐射损伤[11-12,21-22]。 本 文 作 者 前 期 研 究[23]结 果 显 示:CD47 信号是抑制内皮细胞周期和诱导其老化的重要 机 制。此 外,有 研 究[24]显 示:CD47 信 号 通 过调控c-myc 等转录因子抑制细胞自我更新。结合上述报道,本研究中电离辐射模型小鼠HSCs 一过性的高表达CD47,一方面可能抑制了照射后骨髓应激条件下活化巨噬细胞的吞噬作用,另一方面也可能通过凋亡、衰老和调控转录因子等机制损伤了HSCs 的自我更新能力,使HSCs 的储备难以恢复。
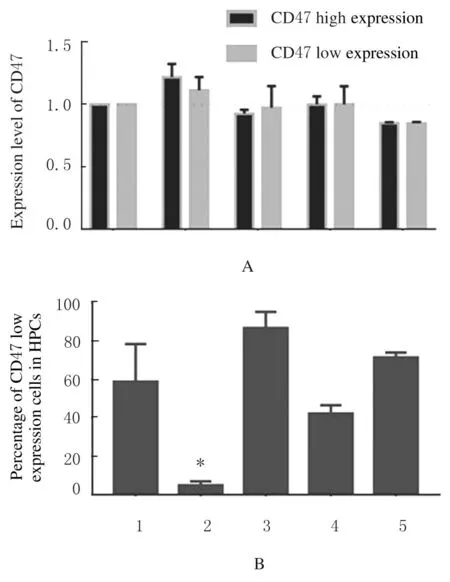
图9 3 Gy X 射线照射后不同时间点各组小鼠HPCs 中CD47 表达直条图Fig.9 Histogram of expression of CD47 in HPCs of mice at different time points after 3 Gy X-ray irradiation
HPCs (lin-c-kit+Sca-1-) 和LSK HPCs 是具有异质性的细胞群。共同髓系前体细胞(CMP,lin-c-Kit+Sca-1lowFcγRlowCD34+)、 粒/单核细胞前 体 细 胞(GMP, lin-c-Kit+Sca-1lowFcγRhighCD34+)、巨核/红系前体细胞(MEP, lin-c-Kit+Sca-1lowFcγRlowCD34-) 和LSK 细胞的亚群(LTHSC, LSK CD34-; ST-HSCs: LSK CD34+)在全身电离辐射后CD47 的表达发生变化,但其与自我更新、分化和克隆形成能力的关系尚待进一步研究。
综上所述, 与成熟造血系细胞比较, 小鼠HPCs 高表达CD47。 在全身电离辐射后, LSK HPCs 短期内CD47 表达水平升高,长期储备量降低,提示电离辐射可能通过CD47 信号通路损伤了HSCs 的长期自我更新能力。本研究为寻找干预造HSCs/HPCs 凋 亡 的 新 靶 点、 改 善HSCs/HPCs 电离辐射损伤后自我更新能力提供了实验依据。
