不同氮/碳源组合条件下斜生栅藻的生长、光合及油脂产率
2020-12-15杨宋琪魏喜红王丽娟杨生辉罗光宏
杨宋琪,魏喜红,王丽娟,杨生辉,罗光宏
(1.河西学院 甘肃省微藻工程技术创新中心,甘肃省河西走廊特色资源利用重点实验室,甘肃 张掖 734000;2.西南大学 三峡库区生态环境教育部重点实验室,重庆 400715)
微藻因生长周期短、繁殖速率快、油脂含量高、无污染以及培养不占耕地等特点,在众多生物质能源原料中备受关注[1]。斜生栅藻(Scenedesmusobliquus)是广泛分布于河、湖、库、塘、土壤等生境的一种绿藻,容易分离纯化获得。近年来,斜生栅藻因其相对较高的油脂产率而被广泛研究[2-5]。研究表明,斜生栅藻油脂组成以C16、C18系脂肪酸为主,且油脂含量占干重的11%~55%[6],适宜于生产生物柴油。
氮是藻类生长必需的元素之一,是蛋白质和叶绿素等物质的重要组成部分,对藻类生长、繁殖等生理活动有着重要的作用[7]。自然界中,藻类可利用硝酸盐、亚硝酸盐、铵盐、氮气、尿素等作为必需氮源[8]。培养过程中,氮源的选择以及浓度的变化可以显著影响藻的生长速率、光合、油脂的积累及成分组成[9]。碳元素约占藻细胞干重的50%,是藻细胞的主要组成部分[10],也是保证藻细胞大量积累油脂的必要条件[11]。碳源作为营养物质被藻类利用进行有机物的合成和代谢产物的积累,一些藻类可以利用不同外加碳源进行自养和异养生长并显著提升生物量和油脂产率[12],小球藻亦可利用不同无机碳进行快速生长并显著提升油脂产率[13]。
目前,许多学者集中在单一氮、碳、磷营养盐对微藻油脂积累的影响研究,而针对不同氮、碳源组合培养探究藻类生长及油脂产率的研究较少。因此,本研究以斜生栅藻为研究材料,为获得其适宜的氮源与碳源组合培养条件,选取4种常见氮源和3种不同形式碳源两两组合进行室内培养,对其生长、光合、油脂产率及油脂脂肪酸组成进行比较分析,为斜生栅藻生物量和油脂积累条件的筛选提供新的思路和方法。
1 材料与方法
1.1 实验材料
斜生栅藻(Scenedesmusobliquus)FACHB-416,购自中国科学院水生生物研究所藻种库。培养基所用氮源为尿素、硝酸钠、亚硝酸钠、氯化铵,碳源为碳酸钠、葡萄糖和乙酸钠。
DR6000紫外-可见分光光度计(美国哈希),植物效率分析仪(英国汉莎科技有限公司),BT48冷冻干燥机(Millrock),RE-2000A旋转蒸发仪,氮吹仪,GC-2014C气相色谱(日本岛津)。
1.2 实验方法
1.2.1 藻种培养
根据表1将4种氮源和3种碳源两两组合,并以BG-11培养基氮、碳含量为依据分别进行相应氮、碳源的添加,共计12组。首先将斜生栅藻扩大培养至对数期,再将藻液进行离心、洗涤,并转接至无氮、无碳培养基中饥饿培养3 d。饥饿培养后的藻离心收集后分别接入1.5 L含有不同氮、碳源培养基的柱状反应器中,初始藻密度(OD680)为0.1。整个培养过程温度(25±1)℃,光照强度80 μmol/(m2·s),光暗比12 h∶12 h,培养期间每天定时搅动藻液3次。
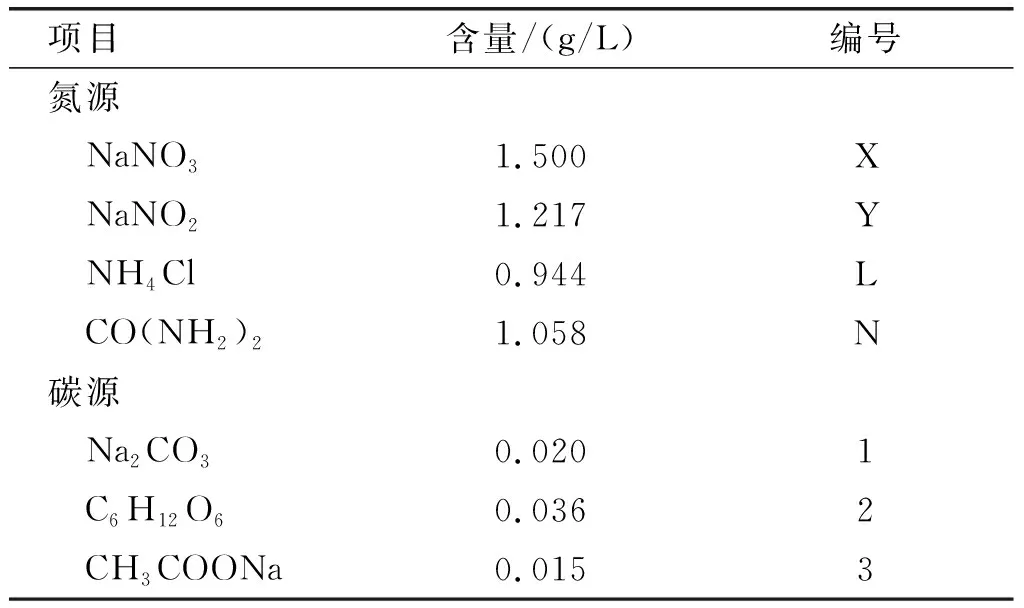
表1 斜生栅藻培养的不同氮、碳源含量及编号
1.2.2 生长曲线及比生长速率
每24 h测定培养藻液的OD680,制作斜生栅藻生长曲线。
比生长速率计算公式为:
(1)
μmax=max(μ1,μ2,μ3,…μn)
(2)
式中:μ为斜生栅藻在某一时间段内的比生长速率;μmax为最大比生长速率;x2为t2时间的藻类生物量;x1为t1时间的藻类生物量。
1.2.3 叶绿素a含量的测定
参照文献[14]方法,各取5 mL的藻液进行离心(7 000 r/min,10 min),去除上清液后的藻细胞用90%的丙酮在4℃条件下黑暗提取24 h,提取液定容至10 mL后用紫外-可见分光光度计分别测定663、645 nm处吸光值。叶绿素a含量(C)按下式计算。
C=(8.02OD663+20.21OD645)
(3)
1.2.4 最大光量子产率(Fv/Fm)的测定
取对数期藻液2.3 mL暗适应20 min后,采用植物效率分析仪测定斜生栅藻最大光量子产率(Fv/Fm),测定光强为3 000 μmol/(m2·s),最大激发波长为650 nm。
1.2.5 油脂产率的测定
所有藻液进行离心(6 000 r/min,10 min),藻泥经纯水反复洗涤3~5次后收集至50 mL离心管中冷冻干燥,获得的冻干藻粉使用甲醇-氯仿法[15]提取油脂。按下式计算油脂产率(y)。
y=m/m0×100%
(4)
式中:m为藻油质量;m0为冻干藻粉质量。
1.2.6 脂肪酸组成分析
根据Lepage等[16]的方法进行脂肪酸甲酯(FAMEs)的分析。气相色谱条件为: DB-5 ms毛细管柱(60 m×0.25 mm,0.25 μm);载气为N2,进样口温度和检测器温度分别为250℃和290℃;初始柱温120℃,保持3 min,然后以4℃/min的速率升至220℃,保持5 min,再以3℃/min的速率升至280℃,保持20 min;进样量1 μL。
1.2.7 数据分析
实验数据用SPSS 13.0进行单因素方差分析(One Way ANOVA),并用LSD法进行多重比较,使用Origin 8.5软件作图。
2 结果与分析
2.1 不同氮、碳源组合培养条件下斜生栅藻的生长及最大比生长速率
不同氮源、碳源组合培养条件下斜生栅藻的生长曲线如图1所示。
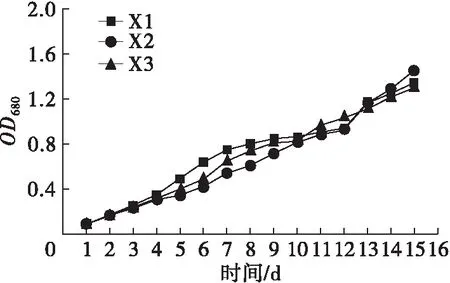
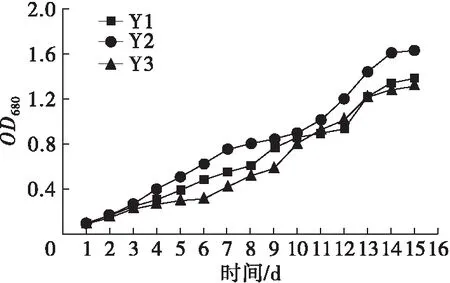
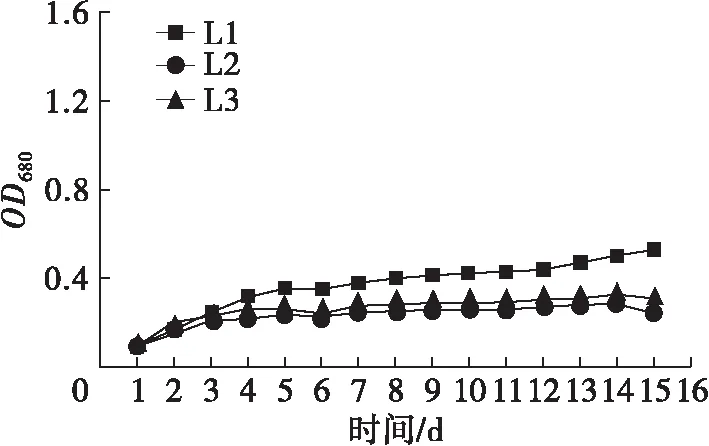
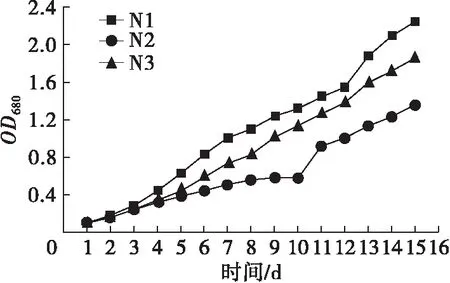
图1 不同氮、碳源组合培养条件下斜生栅藻的生长曲线
由图1可以看出,NaNO3、NaNO2和CO(NH2)2作为氮源时,斜生栅藻藻密度随着培养时间延长而显著增加(P<0.05),而NH4Cl作为氮源时,斜生栅藻的藻密度随时间延长变化不显著(P>0.05)。相同氮源环境中,NaNO3与3种碳源组合培养时斜生栅藻藻密度在整个培养过程中差异不显著(P>0.05);以NaNO2为氮源时,在斜生栅藻生长至稳定期后(14~15 d),Y2组藻密度显著高于Y1和Y3组(P<0.05);CO(NH2)2作氮源时,3种碳源对斜生栅藻藻密度影响较大,培养至对数期后藻密度由大到小依次为N1>N3>N2,并呈显著差异(P<0.05)。
对12组处理的最大比生长速率(μmax)进行计算,可知在培养的2~4 d,斜生栅藻μmax均达到最大,具体见图2。从图2可以看出: N1、N3组μmax分别为(0.633±0.003)、(0.630±0.031) d-1,显著高于其他10组(P<0.05);μmax最低值出现在L2和L3组,仅为(0.214±0.003)、(0.234±0.003) d-1,均显著低于其他各组(P<0.05)。

注:不同字母表示组间差异显著(P<0.05)。
2.2 不同氮、碳源组合培养对斜生栅藻叶绿素a含量及最大光量子产率的影响
培养至对数期中段(培养8 d)斜生栅藻叶绿素a含量及Fv/Fm变化如图3所示。

注:不同大写字母表示组间叶绿素a含量差异显著(P<0.05),不同小写字母表示组间Fv/Fm差异显著(P<0.05)。
从图3可以看出,NH4Cl作为氮源显著降低了斜生栅藻叶绿素a的含量(P<0.05),但Na2CO3作为碳源时,叶绿素a含量高于CH3COONa和C6H12O6处理。另外3种氮源中,CO(NH2)2处理后的斜生栅藻叶绿素a含量整体较高,其中N1组叶绿素a含量达到4.76 mg/L,显著高于其他各组(P<0.05),而在NaNO3和NaNO2处理组中斜生栅藻叶绿素a含量差异不大。
Fv/Fm表示PSⅡ最大光化学效率,指所有PSⅡ反应中心处于开放状态时的量子产量,反映PSⅡ的功能,一般而言,该指标较为稳定,但当处于胁迫环境时,Fv/Fm会显著降低。本研究发现:12组处理中斜生栅藻Fv/Fm受到NH4Cl的影响更为突出,L1、L2和L3组Fv/Fm均小于0.60,可见NH4Cl对斜生栅藻具有一定的胁迫效应,使得斜生栅藻光合作用受到显著抑制;当氮源为CO(NH2)2时,斜生栅藻平均Fv/Fm均高于其他3个氮源组。另外还发现,碳源为Na2CO3时,斜生栅藻Fv/Fm均高于同种氮源中其他两种碳源的处理。
2.3 不同氮、碳源组合条件下斜生栅藻的油脂产率及脂肪酸组成
不同氮源、碳源组合处理下,生长至稳定期末(培养15 d)斜生栅藻的油脂产率如图4所示。
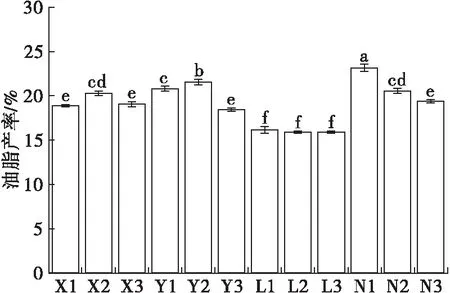
注:不同字母表示组间差异显著(P<0.05)。
从图4可以看出,所有处理组中斜生栅藻油脂产率在15.80%~23.14%之间。其中,NH4Cl环境中斜生栅藻油脂产率均值仅为15.94%,显著低于其他各组(P<0.05);油脂产率最高的两组为Y2和N1,分别为21.54%和23.14%,显著高于其他各组(P<0.05)。可见,所有处理中NaNO3和NaNO2为氮源且C6H12O6作为碳源时,斜生栅藻更容易积累油脂,不同的是,CO(NH2)2环境中,添加Na2CO3使得斜生栅藻油脂产率最高。
表2为斜生栅藻油脂脂肪酸组成及相对含量。
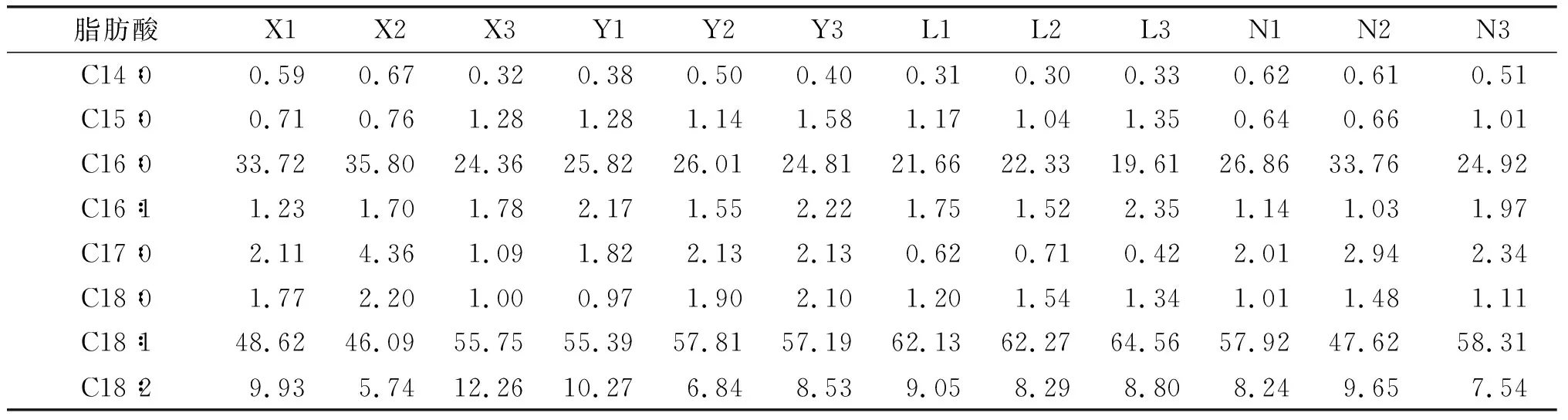
表2 不同处理组斜生栅藻油脂脂肪酸组成及相对含量 %

续表2%
从表2可以看出,脂肪酸组成中饱和脂肪酸C16∶0(棕榈酸)、单不饱和脂肪酸C18∶1(油酸)和多不饱和脂肪酸C18∶2(亚油酸)3者之和占总脂肪酸含量的87.63%~93.02%。其中,饱和脂肪酸C16∶0相对含量在19.61%~35.80%之间,单不饱和脂肪酸C16∶1和C18∶1含量在47.79%~66.91%之间,多不饱和脂肪酸C18∶2相对含量在5.74%~12.26%之间。
2.4 讨论
Berman[8]研究表明,自然界氮源种类丰富,包括硝酸盐、亚硝酸盐、铵盐、氮气、尿素、腐殖质、氨基酸等。然而,除少数固氮蓝藻能固定利用大气中的氮气外,更多的藻类必须从外界环境中摄取化合态氮源来满足自身所需,同时不同藻对氮源种类的需求存在很大差异[17-18]。马红芳等[19]研究发现栅藻LX1在养殖废水中能够优先利用氨氮,再依次利用硝态氮和亚硝态氮。胡章喜等[20]指出NaNO3是葡萄藻生长及油脂积累的理想氮源。在微藻培养过程中加入适量相应碳源,有助于提高微藻生长的密度。在生活污水培养时补充碳源Na2CO3、NaHCO3和CO2时,栅藻LX1生长及油脂积累特性与对照组无显著差异[21];在兼性培养时,碳源甘油、葡萄糖和乙酸钠均支持三角褐指藻的生长并提高生物量的积累[22]。本研究发现,CO(NH2)2使得斜生栅藻生长状况相对较好,藻密度、叶绿素a含量及Fv/Fm均较高,而NH4Cl不利于斜生栅藻的生长,原因可能是藻优先对铵态氮的利用导致培养基pH迅速降低阻碍了生长[23]。NaNO3、NaNO2和NH4Cl为氮源时,3种碳源对斜生栅藻生长的影响不显著(P>0.05),然而在CO(NH2)2环境中,Na2CO3的添加使得斜生栅藻生物量显著高于其他两组(P<0.05),相应地叶绿素a含量、Fv/Fm在所有组别中均为最高。说明在不同氮、碳源的组合中,CO(NH2)2和Na2CO3更有利于斜生栅藻的生长。
为使微藻能够积累更多油脂,尝试使用不同氮源、碳源培养成为可行的方案。王立柱等[24]研究表明,NaNO3是Chorellavulgaris积累油脂的最优氮源;窦晓等[25]发现NaNO3对眼点拟微绿球藻油脂积累的影响较大,同时NaHCO3是其积累油脂的最优碳源。本研究结果表明,当氮源为CO(NH2)2,碳源为Na2CO3时斜生栅藻油脂产率最高(23.14%),同时NaNO2和C6H12O6组合中斜生栅藻油脂产率也可达到21.54%。可见从单一碳源角度,无论Na2CO3作为碳源时的自养还是C6H12O6作为碳源时的兼养均能使得斜生栅藻生长良好并积累较多的油脂。Knothe[26]研究表明,单不饱和脂肪酸更适合生产生物柴油,制备生物柴油的油脂原料中,C18∶1是重要组成之一,可以使生物柴油具有良好的低温流动性能,并可有效减缓或降低多不饱和脂肪酸易氧化特性。油脂成分中拥有较长的碳直链且无碳支链,尽可能少的双键并含一定量氧元素,且不含有芳香烃结构时[27]可作为理想的生物柴油原料。本研究中不同氮源、碳源组合培养后斜生栅藻脂肪酸以饱和脂肪酸C16∶0(棕榈酸)、单不饱和脂肪酸C18∶1(油酸)和多不饱和脂肪酸C18∶2(亚油酸)为主,三者之和占总脂肪酸的87.63%~93.02%。其中,饱和脂肪酸C16∶0相对含量在19.61%~35.80%之间,单不饱和脂肪酸C16∶1和C18∶1相对含量在47.79%~66.91%之间,多不饱和脂肪酸C18∶2相对含量在5.74%~12.26%之间。培养基中氮源种类能影响微藻脂肪酸比例[23],本研究中,NH4Cl作为氮源时,斜生栅藻油酸含量在62.13%~64.56%之间,显著高于其他处理组(P<0.05),但该条件不利于斜生栅藻生物量的积累;而油脂产率最高的两个处理组N1和Y2油酸含量分别为57.92%和57.81%,相比其他组均处于较高水平。可见从脂肪酸组成及相对含量看,斜生栅藻积累的油脂符合生物柴油的要求,同时在生物量积累和油脂产率方面,CO(NH2)2和Na2CO3可作为斜生栅藻生产生物柴油的理想氮源和碳源。
3 结 论
本研究对比了4种常见氮源和3种常见碳源进行两两组合培养条件下斜生栅藻的生长、光合、油脂产率及脂肪酸组成。结果表明,NH4Cl不利于斜生栅藻的生长。NaNO3、NaNO2和NH4Cl分别为氮源时,3种碳源对斜生栅藻生长的影响不显著,而在尿素环境中,Na2CO3的添加使得斜生栅藻生物量显著高于其他两组(P<0.05)。同时,12组处理中,CO(NH2)2和Na2CO3组合、NaNO2和C6H12O组合培养斜生栅藻时油脂产率最高,分别占细胞干重的23.14%和21.54%,且单不饱和脂肪酸油酸含量分别达57.92%和57.81%。因此,无论从生物量的积累还是油脂产率看,CO(NH2)2和Na2CO3可作为斜生栅藻生产生物柴油的理想氮、碳源。然而,本文中的CO(NH2)2和Na2CO3的含量都相对充足,因此通过控制其含量来获得更高的生物量及油脂产率有待进一步研究。
