基于斑马鱼胚胎急性毒性测试预测食用油毒性可行性研究
2020-12-15朱燕华王钟凰李昱宗EINEZAMIHaniNORINDERUlfCOTGREAVEIanDEVITTEPeter陈雪平
朱燕华,王钟凰,李昱宗,EI-NEZAMI Hani, NORINDER Ulf , COTGREAVE Ian A, DE VITTE Peter, 陈雪平
(1.台湾食品工业发展研究所,台湾 新竹 30062; 2.长庚学校财团法人长庚科技大学 民生学院保健营养系,台湾 桃园 33303;3.香港大学 生物科学学院科学部,香港特别行政区 999077; 4.卡罗林斯卡学院 瑞典毒理科学研究中心,瑞典 斯德哥尔摩 15136; 5.鲁汶大学 制药和制药科学系分子生物发现实验室,比利时 鲁汶 3000;6.水中银(国际)生物科技有限公司,香港特别行政区 999077)
食用油对维持人体正常的新陈代谢起着极其重要的作用,除为生命体提供能量外,一些重要的脂肪酸(如亚油酸、二十碳五烯酸、二十二碳六烯酸等)是脂溶性维生素的重要载体。一系列食用油污染事件的发生严重影响消费者的健康安全[1-2]。目前对食用油的检测主要是依赖理化方法,如质谱、远红外、核磁共振等[3-5]。虽说化学法检测食用油具有权威性和法律效力,但仍有不足[1]。一方面,化学法只能检测出已知的有毒物质,对未知物质的毒性无能为力;另一方面,虽然有些化学物质具有潜在毒性,但由于一些模式生物(如老鼠)生长发育比较缓慢,短期内无法快速有效地预测食物毒性[6]。因此,亟需研发一种快速有效的方法用来检测食用油毒性。
斑马鱼(Danio rerio)拥有人类70%的同源基因以及高达84%的同源疾病相关基因,是一个新的理想的研究人类疾病的模式生物[7]。斑马鱼具有体外受精、产卵量大、胚胎发育快、通体透明等特点,被广泛应用于药物的毒理评价和功效预测[8]。此外,基于斑马鱼胚胎建立的国际经济合作与发展组织测试指南236(OECD TG 236)被广泛用于化学品的毒性测试和评估[9]。虽然有报道将油脂注射到斑马鱼胚胎或者用乳化剂处理样品然后暴露斑马鱼胚胎来检测油脂的安全性[10],但是这些方法操作缺乏便利性,不利于大规模检测,而且也难保证有毒物质被鱼胚胎充分吸收。本研究利用斑马鱼胚胎毒性测试来检测不同来源的猪油(含已知劣质油)的毒性,并进一步用非靶标化学及计算分析的方法预测劣质猪油中的毒性成分。
1 材料与方法
1.1 实验材料
1.1.1 样本
7个猪油样本来自我国台湾地区,包括2个正常精炼猪油,2个未精炼地沟猪油,3个精炼地沟猪油,样本封样编号,并匿名提供给实验室进行单盲提取和斑马鱼胚胎毒性测试实验,具体样品名称和相关信息在测试完成后提供。样本采集后在室温保存。
1.1.2 主要试剂、仪器和软件
乙腈(CAS No. 75-005-8; 34851,Sigma-Aldrich)、正己烷(CAS No. 110-54-3; 32293, Sigma-Aldrich)、甲醇(CAS No. 67-56-1; 34860, Sigma-Aldrich),安捷化工(香港)有限公司。
Memmert INE600恒温培养箱;Millipore Milli-Q Synthesis A10反渗水循环系统,香港默克公司;96孔细胞培养板,美国Corning;XCV-5400氮气干燥系统;Leica MZ 10F体式显微镜,香港莱卡公司;高分辨率Q-ExactiveTM复合四极杆质谱仪,美国Thermo Finnigan;Dionex UltiMateTM3000 RS超高效液相色谱(UHPLC)系统,美国Thermo Scientific;Bransonic® 5510超声仪,香港生物公司;Optima XPN 100离心机,香港贝克曼库尔特公司。
CT-link软件(2017版,http://www.chemotargets.com);Vega 软件 (version 1.0.8, http://vega-qsar.eu)的3种不同模式,分别为2.1.12版CAESAR、1.0.6-DEV版SarPy及1.0.0-DEV版Benigni-Bossa Mutagenicity(TOXTREE),均为在线软件;Progenesis QI,美国Waters;Ezinfo软件,瑞典Umetrics。
1.2 实验方法
1.2.1 样品处理
猪油与乙腈按体积比1∶3进行混合,旋涡振荡和超声波处理后5 000g室温离心10 min。将上清液和正己烷以体积比3∶1进行混合,旋涡振荡和超声波处理后5 000g室温离心10 min。上清液于氮气气流下干燥后,加入猪油样本2%体积的甲醇进行溶解,得到猪油提取物,-20℃保存备用。每个样本做3次重复。
1.2.2 鱼胚胎急性毒性测试
斑马鱼(AB系)的饲养方法参照OECD TG 236[9],人工饲养水箱的温度为(26±1)℃,光周期为14 h光照、10 h黑暗。4~128细胞期斑马鱼胚胎用于毒理实验。暴露实验在96孔板中完成,每个孔中含有1颗鱼胚胎和200 μL不同浓度的猪油提取物或者溶剂对照,每个浓度用20颗鱼胚胎测试。将96孔细胞板置于26℃恒温箱中孵育48 h后,于体式显微镜下检查胚胎死亡率并计算半致死浓度(LC50)。鱼胚胎如发生凝聚,尾部未分离,或者没有心跳都被判定为死亡。所有实验和操作都依据美国国家卫生研究院实验动物指南(No.8023, 1978修订)并且由香港特区政府健康署批准[Refs. (15-10) in DH/HA & P/8/2/5 Pt.3]。
1.2.3 化学成分分析
猪油提取物成分用高分辨率Q-ExactiveTM复合四极杆质谱仪偶联Dionex UltiMateTM3000 RS 超高液相色谱(UHPLC)系统进行分析。超高液相色谱系统包括3000 RS泵、WPS-3000 RS 自动加样仪及热电喷雾(HESI)探针。液相色谱分离使用 Phenomenex Luna® C18色谱柱(150 mm×4.6 mm, 3 μm),流动相A为0.1%醋酸水溶液、流动相B为0.1% 醋酸乙腈溶液,洗脱速度200 μL/min。液相色谱梯度洗脱按照如下操作:5%~100% B(0~12 min), 100% B(13~15 min), 5% B(15~15.1 min)。HESI质谱(MS)分析使用氮气作为气帘气和辅助气体,正负离子检测模式操作参数为:喷雾电压3.3 kV; 毛细管温度330℃; 辅助气体加热温度60℃, 气帘气流速15 mL/min, 辅助气体流速1 mL/min。质谱数据取质荷比(m/z)100~1 500范围的数值,每组数据的归一化碰撞能量分别取35%、70%和100%。液质联用 (LC-MS) 设备的分析软件分别为Progenesis QI和Ezinfo。使用CT-link 软件预测有毒成分的结构,用Vega软件的3种模式(CAESAR,SarPy,Benigni-Bossa Mutagenicity)预测成分的诱变性。
1.2.4 数据分析
斑马鱼胚胎急性毒性测试结果用Prohibit Analysis软件计算LC50(代表样本急性毒性)。对于化学成分分析结果,将各种猪油提取物在同一电荷模式下全质谱m/z的分布聚类在一个图中,并进行多变量成分分析(PCA)。通过PCA散点图鉴定不同样本中特定的化学成分后,用隐结构的正交投影判别分析(OPLS-DA)鉴定高毒性样本中的特征性m/z离子,有差异的m/z离子被选作相关S-plot图(y轴最大值大于0.8)。S-plot的y轴代表组内差异标记分布的置信值。PCA、OPLS-DA和S-plot软件为Ezinfo。
2 结果与分析
2.1 猪油的斑马鱼胚胎急性毒性
猪油样本经过乙腈和正己烷先后提取,用甲醇作为溶剂用于斑马鱼胚胎暴露实验,结果见表1。
由表1可知,正常精炼的猪油(LN1, LN2)毒性比较低,半致死浓度 (LC50) 大于173.3 mL/L, 而未精炼地沟猪油(LT1,LT2)毒性较高,LC50均小于14.3 mL/L,精炼地沟猪油(LT3, LT4, LT5)毒性介于前两者之间,LC50为21.7~48.3 mL/L。研究表明,LC50值与斑马鱼骨骼畸形、神经缺陷、形体非正常等发育密切相关,而且与老鼠LD50值呈正相关,被广泛用作毒理评价指标[9,11-13]。因此,本研究结果显示未精炼地沟猪油和精炼地沟猪油LC50明显小于正常精炼猪油,意味着地沟油中可能存在有毒物质。
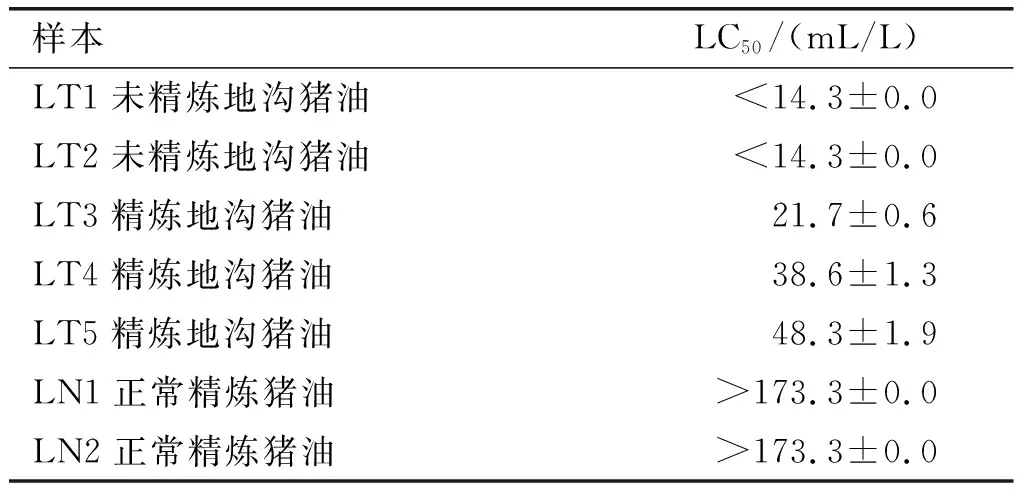
表1 猪油样品的斑马鱼胚胎急性毒性测试结果
2.2 猪油中潜在有毒物质的分析
为了进一步阐述不同猪油表现出来的斑马鱼胚胎毒性,我们利用非靶标高分辨率LC/MS和多因素分析方法研究低毒样本(LN1, LC50>173.3 mL/L)、中毒样本(LT5, LC50=48.3 mL/L)和高毒样本(LT1, LC50<14.3 mL/L)猪油提取物的化学成分,结果见图1。
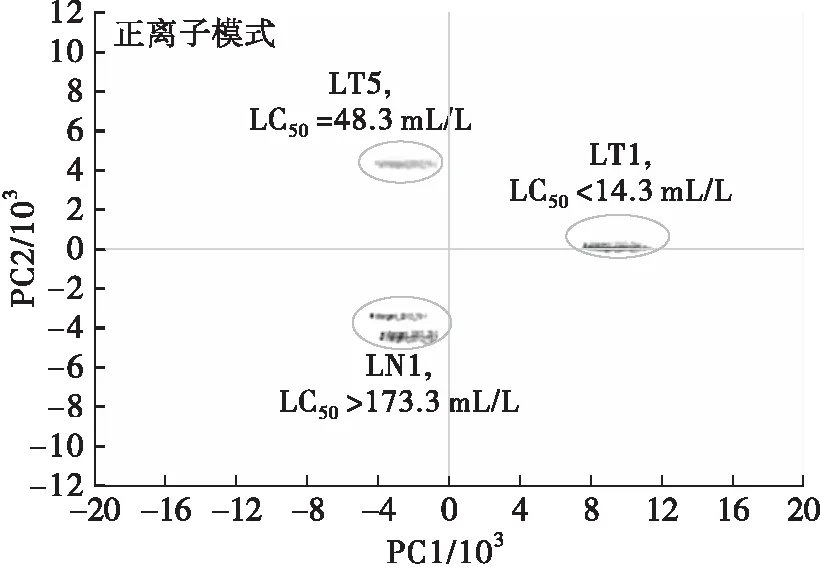
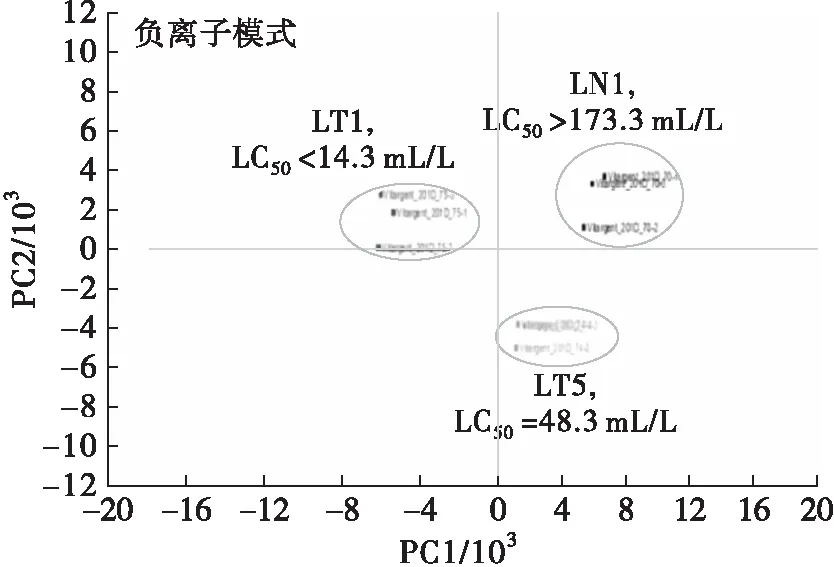
图1 不同斑马鱼胚胎毒性(LC50)的猪油提取物在正、负离子模式下高分辨LC/MS所得m/z值的PCA
由图1可以看出,PCA的m/z信号结果显示3种猪油提取物存在着明显的差异。另外从高毒性猪油样本(LT1)中鉴定出16个(正离子模式7个,负离子模式9个)强度在293.210 9~445.278 6的特征性m/z信号作进一步鉴定,结果见表2。
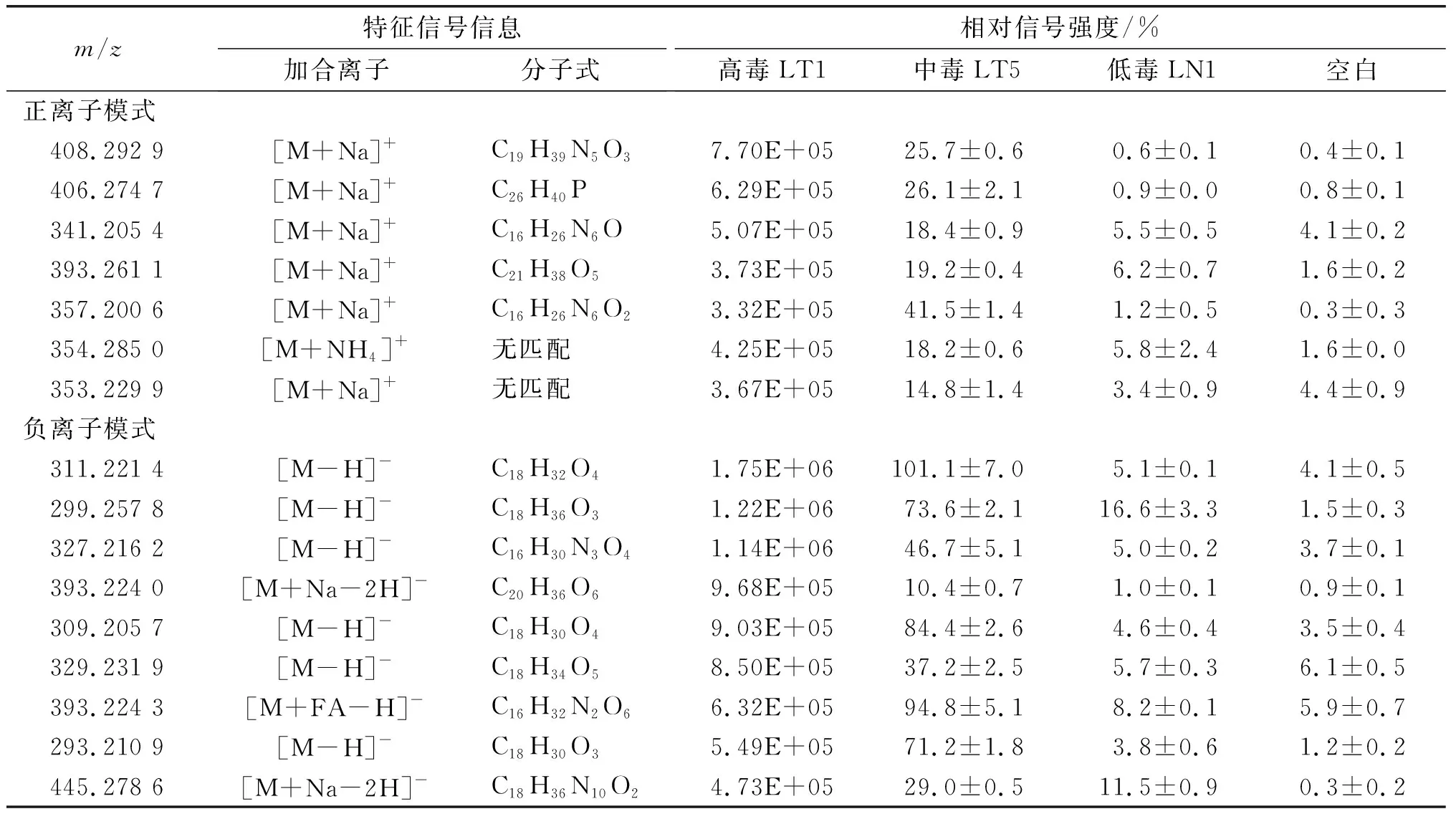
表2 不同毒性的猪油提取物中的特征性质荷比对应的潜在化学物质
由表2可知,LT1的相对信号强度在(3.32E+05)%~(1.75E+06)%之间,相比之下,LT5和LN1的相对信号强度分别为10.4%~101.1%和0.6%~16.6%,且LN1的相对信号强度和空白对照比较相似。这些结果意味着候选m/z表达特征很可能是高毒样本中的潜在有毒成分。
2.3 猪油中潜在有毒物质的鉴定
我们进一步用ChemSpider软件分析这些候选特征性m/z信号,发现大部分信号(除了m/z354.285 0和353.229 9)都可以和一些已知的物质相匹配,非靶标化学分析显示一些脂肪酸的衍生物是这些高毒性猪油中的特异性成分(表2)。负离子模式中,CT-link 软件分析预测m/z为311.221 4、309.205 7和329.231 9的3种物质最有可能分别是8-{3-[(1E)-3-羟基-1-辛烯-1-醇]-2-环氧乙烷基}辛酸(表3,图2A)、9-羟基-11-(3-戊基-2-环氧乙烷基)-7,10-十一烷二酸(表3,图2B)或9,10,13-三羟基-11-十八烯酸(表3,图2C,异构体)和乙基 (6R)-6-羟基-6-{(2R,5R)-5-[(1S)-1-羟基己基]4氢-2-呋喃}己酸(表3,图2D),这几种化合物均为脂肪酸的氧化产物。Vega软件预测这些脂肪酸氧化产物可能会削弱线粒体功能,具有细胞毒性。之前的研究表明一些源自氧化产生的环氧化合物具有毒性,这些环氧化合物通过本身的化学活性或者通过干扰花生四烯酸信号影响细胞分裂来发挥其毒性作用[14-16]。因此,地沟油中存在的脂肪酸氧化物可能是影响其毒性的主要物质。

表3 猪油提取物中导致斑马鱼胚胎死亡的潜在的毒性成分和结构
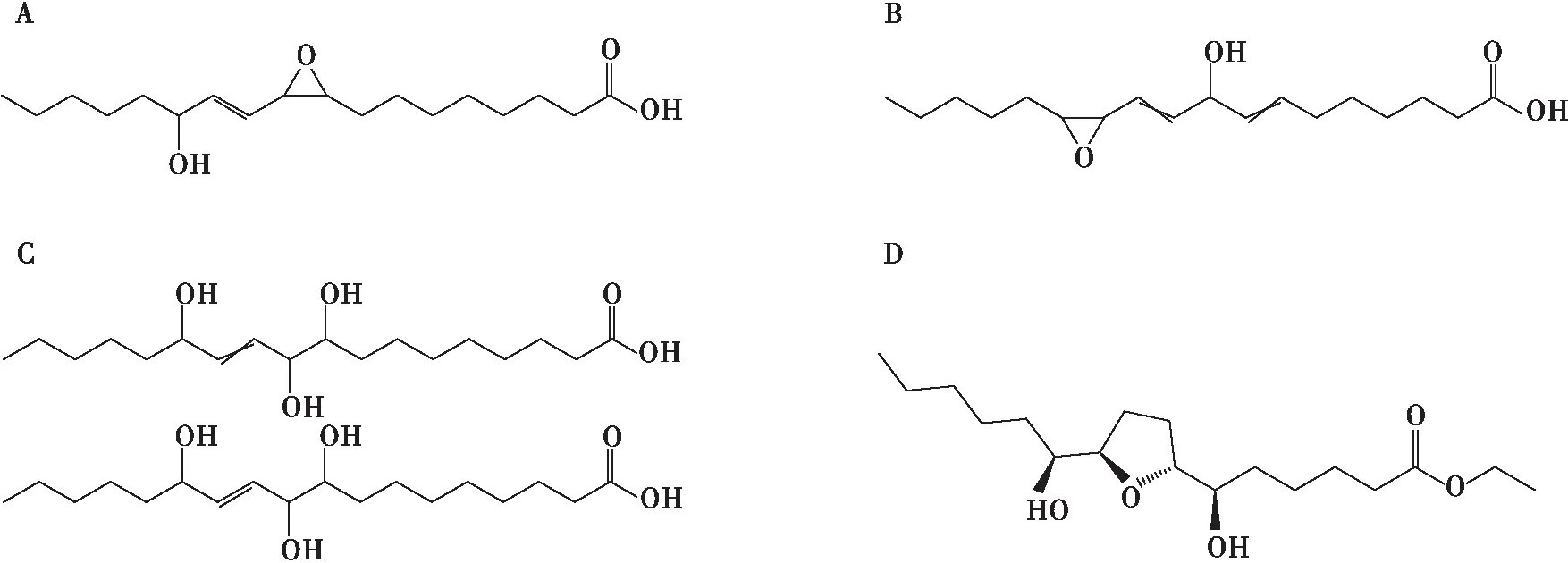
图2 猪油样本中潜在有毒物质的化学结构
3 结 论
本研究运用斑马鱼胚胎单盲测试不同来源和加工方式程度的猪油样本的急性毒性,测试结果LC50值直观反映出地沟猪油的毒性比较大,其次是精炼的地沟猪油,正常精炼猪油的毒性则比较小。进一步非靶标高分辨率LC/MS分析找出高毒性样本的特征性m/z信号,进一步由ChemSpider和CP-link软件分析证实潜在毒性成分主要为脂肪酸氧化物。因此,本研究建立的用乙腈和正己烷联合提取并结合斑马鱼胚胎测试可以有效地检测食用油的生物毒性,为食用油的安全性检测提供了一个新的解决方案。
