鲍曼不动杆菌三价抗原融合蛋白的制备及其免疫原性研究
2020-12-15董瑶吕琳曦关丽娜王朝莉冯莉谢勇恩
董瑶 吕琳曦 关丽娜 王朝莉 冯莉 谢勇恩
川北医学院免疫与分子生物学研究所(四川南充637000)
鲍曼不动杆菌(Acinetobacter baumannii)是不动杆菌种属中一种常见的条件致病菌。它能引起多部位感染,如肺部、尿路感染及皮肤、伤口等部位的感染等[1],对免疫功能低下以及使用机械通气、气管插管、尿路插管等辅助治疗手段的患者威胁较大,特别是居住在ICU中的重症患者[2]。由于鲍曼不动杆菌能在非生物表面形成生物膜和抗干燥的能力[3],以及能侵袭人上皮细胞[4],使得它能在环境中长期生存。近年来,鲍曼不动杆菌多重耐药性菌株感染日渐增多,使其有效防治面临巨大挑战[5-6]。因此,亟需寻找强有力的综合性防治措施。疫苗接种是控制病原微生物感染的一种有效手段,鲍曼不动杆菌候选疫苗研究也成为国内外学者的研究热点之一[7-9]。
本研究通过分子克隆技术将鲍曼不动杆菌三种抗原基因,即smpA基因、omp22基因及nlpA基因5′端384 bp片段进行融合获得融合基因,将其克隆到质粒载体pColdI中,构建重组质粒pColdI⁃SON,并将表达纯化的重组蛋白作为抗原免疫小鼠,检测该重组融合蛋白的免疫原性,为进一步探讨其免疫保护性等研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物、菌株和质粒Balb/c雌性小鼠购买于斯贝福(北京)生物技术有限公司,鲍曼不动杆菌ATCC19606由本实验室保存,大肠杆菌E.coli BL21菌株及质粒载体pColdI购自Takara公司。
1.1.2 主要试剂PrimerStar Max试剂盒购自Takara公司,质粒DNA小量抽提试剂盒、DNA胶回收试剂盒、Bradford蛋白定量检测试剂、限制性内切酶KpnⅠ和SalⅠ、Ni⁃Agarose His标签蛋白纯化试剂盒购自上海生工生物工程公司,完全/不完全弗氏佐剂购自Sigma公司,动物脾脏组织淋巴细胞分离试剂盒、CCK⁃8增殖活性检测试剂盒、IFN⁃γ及IL⁃4测定试剂盒购自上海茁彩生物科技有限公司。
1.2 方法
1.2.1 重组质粒pColdI-SON 的构建及鉴定携带smpA/omp22/nlpA三种抗原基因完整编码区序列和相应连接区序列的质粒pcDNA3.1⁃SON由上海生工生物工程公司协助合成和构建,以此质粒为模板,通过自行设计的引物(上游引物:5′⁃GCGG⁃TACCATGCAAAAACTCGTGCTGACG⁃3′和下游引物5′⁃GCGTCGACTTAATTTGCATAAATACCCATTGG⁃3′)进行PCR扩增获得包含smpA、omp22基因完整编码区序列及nlpA基因5′端384个碱基的融合基因片段(其编码区总长度为1 485 bp),将其定向克隆入原核表达质粒pColdI,对重组质粒进行酶切和DNA测序鉴定。
1.2.2 重组蛋白的诱导表达及纯化分别挑取含重组质粒及含pColdI空载体的E.coli BL21单菌落接种含100 μg/mL氨苄青霉素的5 mL LB液体培养基中,37 ℃震荡培养12 h,分别加入终浓度为1、2、5 mmol/L的IPTG,调节为15 ℃恒温诱导培养24 h。取上述菌液1 mL离心收集菌体与等量2×SDS凝胶加样缓冲液混合后进行SDS⁃PAGE电泳,分析诱导表达情况。将含pColdI⁃SON的E.coli BL21单菌落接种200 mL含100 μg/mL氨苄青霉素的LB液体培养基,以上述最优条件诱导表达后,离心收集菌体,用30 mL Binding washing Buffer将细菌重悬。超声波粉碎机冰浴裂解细胞20 min,4 ℃、12 000 r/min离心10 min。离心后的上清和沉淀分别做SDS⁃PAGE,以确定纯化方法。按照Ni⁃Agarose His标签蛋白纯化试剂盒说明书对重组蛋白进行纯化。
1.2.3 重组蛋白的Western blot 鉴定将保存的纯化重组蛋白与相应的空白质粒转化菌和重组质粒转化菌全菌蛋白经SDS⁃PAGE电泳后,转移至PVDF膜上,用含5%脱脂奶粉的TBST封闭2 ~3 h,充分洗膜后加入经封闭液稀释1 000倍的抗6×His标签抗体,4 ℃孵育过夜,充分洗膜后再加入经封闭液稀释5 000倍的HRP⁃羊抗鼠IgG孵育2 h,以Boster公司的DAB显色试剂盒显色。
1.2.4 免疫接种Balb/c 小鼠将18只6 ~8周龄的雌性Balb/c小鼠随机分为3组(每组6只),即:重组蛋白免疫组、佐剂对照组、PBS对照组。重组蛋白免疫组每只小鼠注射入20 μg重组融合蛋白(溶于100 μL PBS)与等体积的弗氏佐剂混合;佐剂组每只小鼠注射100 μL佐剂,PBS对照组每只小鼠注射100 μL PBS缓冲溶液。首次免疫后第14、28 d分别以上述剂量各加强免疫1次。末次免疫第7、21天进行内眦静脉采血,分离血清,于-80 ℃保存。
1.2.5 ELISA 检测血清抗体滴度以200 ng重组蛋白包被,4 ℃过夜。次日用封闭液37 ℃封闭3 h,加入连续两倍稀释的抗血清样本,37 ℃孵育1 h,再分别加入稀释倍数为1∶10 000的HRP标记羊抗鼠IgG二抗,37 ℃孵育2 h后加入TMB避光显色30 min,2 mol/L H2SO4终止反应,测定450 nm处OD值。以样品测定孔比PBS对照孔比值2.1的最高稀释倍数为待测血清的抗体滴度。
1.2.6 脾淋巴细胞增殖实验末次采血后处死小鼠,无菌条件下分离脾脏组织,利用小鼠脾组织淋巴细胞分离试剂盒分离脾淋巴细胞,以纯化的重组蛋白刺激24 h后,CCK⁃8试剂盒测定细胞增殖活性。以细胞刺激指数(SI)判断淋巴细胞增殖活性(SI=待测孔OD450/对照孔OD450)
1.2.7 脾淋巴细胞IFN-γ、IL-4 测定脾淋巴细胞经重组蛋白刺激培养72 h后,收集上清,离心去除颗粒沉淀后分别用IFN⁃γ及IL⁃4试剂盒测定脾淋巴细胞培养液中IFN⁃γ、IL⁃4的产生情况(具体操作按试剂盒说明书进行)。
2 结果
2.1 重组质粒的构建及鉴定PCR扩增获得约1 500 bp的基因片段,将其定向克隆入pColdⅠ后获得了大小为5.9 kb的重组质粒,该重组质粒经KpnⅠ和SalⅠ酶双酶切可释放出大小约为1 500 bp的插入片段,初步表明重组质粒构建成功,并将其命名为pColdI⁃SON(图1),DNA测序结果亦表明重组质粒构建成功。
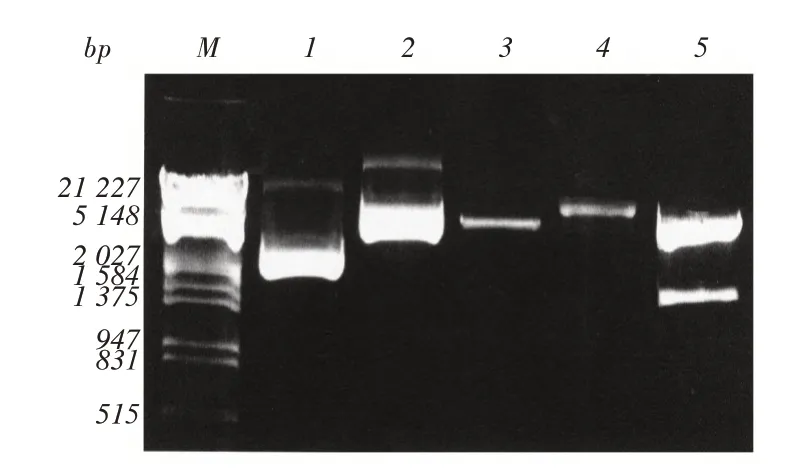
图1 重组质粒酶切鉴定的琼脂糖凝胶电泳图Fig.1 Agarose gel electrophoresis identified by recombinant plasmid digestion
2.2 重组蛋白的诱导表达、纯化及鉴定以不同浓度的IPTG诱导重组菌后,经SDS⁃PAGE电泳确定出最优的IPTG诱导浓度为1 mmol/L,从200 mL培养液中收集重组菌,经超声裂解后用镍亲和纯化柱纯化到分子量约为56 kDa的重组蛋白(图2),蛋白浓度为1.8 mg/mL。Western blot分析表明该重组蛋白能被抗6×His标签抗体特异性识别(图3)。

图2 重组蛋白的SDS⁃PAGE 分析Fig.2 SDS⁃PAGE analysis of recombinant protein

图3 重组蛋白的Wstern blot 检测(抗6×His 标签抗体)Fig.3 Wstern blot detection of recombinant protein
2.3 血清抗体滴度检测重组蛋白免疫小鼠后产生了较强的免疫应答,血清中可检出较高滴度的抗原特异性IgG抗体(图4),而佐剂对照组及PBS对照组血清中未检测到相应的抗原特异性抗体。

图4 重组蛋白免疫小鼠抗血清滴度检测(n=6)Fig.4 Antiserum titer detection of mice immunized with recombinant protein(n=6)
2.4 脾淋巴细胞增殖活性用CCK⁃8试剂盒检测脾淋巴细胞增殖活性,结果显示,脾淋巴细胞经重组融合蛋白刺激培养后,重组融合蛋白免疫小鼠脾细胞的增殖活性显著高于佐剂及PBS对照组(P <0.001,图5)。

图5 脾淋巴细胞增殖活性检测结果(n=6)Fig.5 Results of detection of splenic lymphocyte proliferation activity(n=6)
2.5 IFN-γ及IL-4 分泌水平检测脾淋巴细胞经重组融合蛋白刺激培养72 h后,重组融合蛋白免疫组小鼠脾淋巴细胞产生比对照组更高水平的IL⁃4(P <0.01,图6),而各组间IFN⁃γ分泌水平差异无统计学意义(P >0.05,图7)。
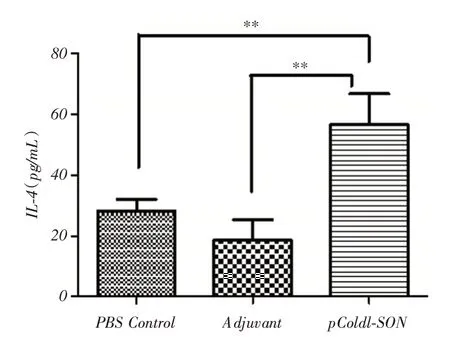
图6 脾淋巴细胞经抗原刺激后IL-4 分泌水平(n=6)Fig.6 IL⁃4 secretion level of splenic lymphocytes stimulated by antigen(n=6)
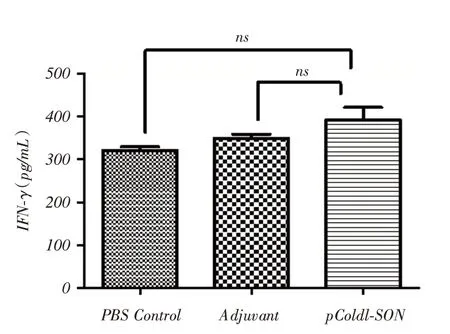
图7 脾淋巴细胞经抗原刺激后IFN⁃γ分泌水平(n=6)Fig.7 IFN⁃γ secretion level of splenic lymphocytes stimulated by antigen(n=6)
3 讨论
鲍曼不动杆菌作为一种革兰氏阴性杆菌,灭活全菌疫苗自然成为最初的候选疫苗研究对象。研究发现鲍曼不动杆菌灭活全菌疫苗经动物免疫接种后可诱导高水平的抗体应答和较好的免疫保护效应[10],这种类型的疫苗具有将细菌的多种抗原呈递给免疫系统的优点[11]。但随后研究表明灭活全菌疫苗在制备过程中可能出现灭活不全或内毒素残留,机体免疫接种后可能引起严重的炎症反应,灭活全菌疫苗中的某些抗原蛋白可能诱导免疫耐受,而某些蛋白成分可能对人体组织细胞造成损害等缺点,灭活全菌疫苗并非鲍曼不动杆菌最理想的候选疫苗[12-13]。基因重组亚单位疫苗具有抗原成分可控、重复性好、易于去除细菌内毒素影响等优点。因此,研制安全高效的鲍曼不动杆菌基因重组疫苗成为目前国内外学者研究的热点。
SmpA被认为是革兰阴性杆菌的重要毒力分子。研究表明[14]它是大肠杆菌中组装外膜蛋白的YaeT复合物的组成部分,在伤寒杆菌属E调节因子,其表达受远近两端启动子的调控[15]。此外,smpA编码的蛋白与铜绿假单胞菌的OmlA属于同一家族[16],尽管目前对鲍曼菌的SmpA功能尚未研究,但它在上述三类细菌中的功能均与维持细胞膜结构和功能的完整性有关。NlpA是一种内膜锚定脂蛋白,它参与细菌外膜囊泡(OMVs)的发生[17],对蛋氨酸摄入发挥重要作用[18]。已有研究[19]报道了NlpA可作为鲍曼不动杆菌的候选抗原,开发疫苗来预防其感染。研究发现,基于单个抗原蛋白的重组亚单位疫苗的免疫保护效应不理想,因而,目前更倾向于鲍曼不动杆菌多价亚单位疫苗研究。GUO等[20]构建了OmpK/Omp22双价融合亚单位疫苗,发现其动物免疫保护效应明显强于单价重组疫苗,但双价疫苗的免疫保护效应仍然不十分理想,仍需进一步筛选免疫优势抗原、寻找最佳的抗原组合,以便进一步增强其免疫原性和免疫保护性。因而,本研究选了SmpA和NlpA两种抗原蛋白,将其与Omp22融合构建三价融合亚单位疫苗,为了避免融合抗原分子量太大,给蛋白纯化带来不便,本研究只选择了NlpA蛋白N末端128个氨基酸的肽段,为了尽可能保持抗原分子的天然构象,在抗原蛋白相互融合部位添加了柔性连接子GGGGSGGGG。将纯化到的SmpA/Omp22/NlpA(1⁃128)免疫小鼠后可诱导高滴度的抗原特异性IgG抗体。IL⁃4和IFN⁃γ作为细菌的关键细胞因子,参与了细菌感染的免疫防御[21],本研究结果表明免疫小鼠脾淋巴细胞经SmpA/Omp22/NlpA(1⁃128)融合蛋白刺激培养后所产生的IL⁃4水平明显高于佐剂组和PBS对照组,而脾淋巴细胞体外刺激培养后IFN⁃γ产生水平各组间无显著性差异,这表明该融合蛋白主要诱导小鼠产生Th2型免疫应答。
总之,本研究成功制备了鲍曼不动杆菌SmpA/Omp22/NlpA(1⁃128)融合蛋白,小鼠免疫接种后显示出较强免疫原性,为进一步比较分析和评估其免疫保护性奠定了基础。
