骨髓Sca⁃1间充质干细胞对肺移植后急性肺损伤的影响
2020-12-15朱国松王广治王开伟
朱国松 王广治 王开伟
河南省人民医院麻醉与围术期医学科(郑州450000)
肺移植(lung transplantation)是治疗终末期肺疾病的唯一有效手段,但患者术后的生存率持续较低[1]。急性肺损伤(acute lung injury,ALI)是导致肺移植后患者死亡的重要原因之一[2]。目前,肺移植后急性肺损伤的防治主要从保护线粒体功能、抑制还原型辅酶Ⅱ(DADPH)氧化酶活性、气体治疗、表面活性剂、前列腺素以及高压氧疗法等方面进行,但并未取得令人振奋的疗效[3-4]。目前临床上急需治疗肺移植后ALI的积极有效的措施。尽管骨髓Sca⁃1间充质干细胞移植治疗肺移植后ALI还未见报道,但是已有研究证实,骨髓Sca⁃1间充质干细胞能够引起机体中抑炎因子IL⁃10和TGF⁃β水平的升高,并增加体内调节型T细胞及树突细胞的比例,从而降低炎性反应,维持机体内环境平衡[5]。骨髓Sca⁃1间充质干细胞增多时,肺组织损伤明显减轻,肺泡细胞凋亡减少,肺泡上皮细胞损伤减轻,肺功能得到明显改善[6]。本研究拟评价骨髓Sca⁃1间充质干细胞对肺移植后急性肺损伤的影响。
1 材料与方法
1.1 大鼠骨髓Sca-1 间充质干细胞的分离及鉴定选择2周龄体质量30 ~40 g雄性SD大鼠,拉颈处死后无菌取胫骨和股骨,剪开两端骨骺,用PBS缓冲液(磷酸盐缓冲液)通过7号针头冲洗骨髓腔取大鼠骨髓。用Sca⁃1+磁性分选试剂盒(Stem Cell公司)无菌条件下分选得到Sca⁃1+骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs),培养于大鼠间充质干细胞专用培养基,传代培养至第3代(P3),应用PBS缓冲液稀释成2×106/mL细胞,鉴定后备用。
1.2 建立大鼠自体左肺原位移植模型为了既能排除免疫排斥反应对实验的干扰,又能模拟临床肺移植过程,本研究采用了大鼠自体左肺原位移植模型。参考相关文献[7-8]并结合本研究特点,将大鼠麻醉后右侧卧位固定在手术台上,气管切开插管连接微型动物呼吸机(型号HX⁃300,成都泰盟科技有限公司)辅助呼吸,辅助呼吸参数为:呼吸频率(RR)75次/min,潮气量10 mL/kg,吸入氧浓度(FiO2)1.0。经左侧第五肋间隙切口进胸腔并打开纵膈,静脉注射肝素钠(375 U/kg),游离肺门处的左肺动脉、静脉和气管。无损伤夹分别夹毕左肺动脉、静脉和气管,此时潮气量呼吸频率(RR)100次/min,潮气量8 mL/kg。左肺灌注器官保护液,然后把套有塑料袋的左肺上提至切口平面(勿与心脏接触),加入冷生理盐水使袋内温度维持在4 ℃左右。1 h后,去除塑料袋,左肺复温30 min后模拟临床肺移植过程,开放左肺气管、动脉和静脉。逐层缝合关闭胸腔,最终获得模拟临床肺移植全过程的大鼠自体左肺原位移植模型。
1.3 分组试验动物分为3组:成年SD大鼠24只,由郑州大学动物实验中心提供,体质量250 ~300 g,采用随机数字表法分为3组。C组:空白对照组(n = 8只),不做任何处理,仅做空白对照;M组(n = 8只):模型组,SD大鼠行自体左肺原位移植术,术后立即经尾静脉注射PBS缓冲液,共0.5 mL;B组(n = 8只):模型+骨髓Sca⁃1间充质干细胞,SD大鼠行自体左肺原位移植术后,经尾静脉注射骨髓Sca⁃1间充质干细胞2 × 106/mL,共0.5 mL。术后48 h处死所有大鼠,取肺部组织标本进行相关检测。
1.4 病理学检查取左肺上叶,于10%多聚甲醛液固定,常规石蜡包埋,切片HE染色,中性树脂封片,在光镜下观察肺病理学改变。
1.5 血气分析大鼠麻醉后剪开胸腔,暴露心脏,动脉血气针穿刺左心室取血,采用动脉血气分析仪进行血气分析。
1.6 肺含水率取左肺下叶,用滤纸擦去肺组织的水分,称重记为湿重。然后置于80 ℃烤箱内,烘烤24 h后称重记为干重,肺含水率(%)=(湿重⁃干重)/湿重×100%。肺组织中H2O2、MDA、IL⁃6以及TNF⁃α检测肺组织组织匀浆后,分别采用H2O2、MDA、IL⁃6以及TNF⁃α测试剂盒(南京凯基公司)检测肺组织中H2O2、MDA、IL⁃6以及TNF⁃α浓度。
1.7 Western blot 方法检测肺组织SPB和CC10表达水平加液氮在研钵中将肺组织研磨至混悬液提取蛋白。蛋白定量后上样、电泳、转膜,分别加入一抗小鼠抗SPB(批号sc⁃53137,稀释度1∶200,Santa Cruz公司,美国),一抗小鼠抗CC10(批号sc⁃390313,稀释度1∶200,Santa Cruz公司,美国)和小鼠抗β⁃actin(稀释度1∶2 000,武汉三赢生物技术有限公司)4 ℃摇动孵育过夜,然后加入辣根过氧化物酶标记的羊抗鼠二抗(稀释度1∶2 000,武汉三赢生物技术有限公司),37 ℃孵育120 min,按照ECL发光试剂盒(碧云天生物技术有限公司)操作步骤暗室曝光、显影、定影。
1.8 统计学方法采用SPSS 19.0统计学软件进行分析,计量资料以均数±标准差表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 病理学结果与C组比较,M组肺组织镜下见肺泡腔内渗出增多,肺泡腔狭窄,肺间质明显出血充血,肺泡间隔增厚,细胞浸润明显,肺实质所占的比例增加。与M组比较,B组肺组织镜下见轻度的病理改变,有少量的渗出物,肺间质出血充血减少,少量的细胞浸润,肺泡间隔轻微增厚,见图1。
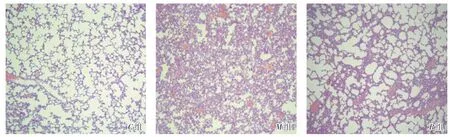
图1 3 组大鼠肺组织切片HE 染色后,在光镜下肺病理学改变(×100)Fig.1 Histopathological changes of lung in 3 groups of rats after HE staining(×100)
2.2 肺功能相关指标与C组比较,M组大鼠动脉血中氧分压(PaO2)降低,肺含水率和二氧化碳分压(PaCO2)升高(P <0.05);与M组比较,B组大鼠动脉血中氧分压升高,肺含水率降低(P <0.05),二氧化碳分压改善不明显,见表1。
表1 3 组大鼠肺组织含水率和动脉血中PaO2、PaCO2指标Tab.1 Changes of lung water content and arterial blood PaO2、PaCO2 in 3 groups of rats ±s

表1 3 组大鼠肺组织含水率和动脉血中PaO2、PaCO2指标Tab.1 Changes of lung water content and arterial blood PaO2、PaCO2 in 3 groups of rats ±s
注:与C 组比较,aP <0.05;与M 组比较,bP <0.05
指标PaO2(mmHg)PaCO2(mmHg)肺含水率(%)C 组72.79±5.81 40.10±4.41 67.47±4.99 M 组62.25±5.31a 46.16±7.03a 81.57±5.36a B 组67.80±5.77b 43.76±3.88 75.91±3.69ab
2.3 氧化因子和炎症因子检测结果与C组比较,M组大鼠肺组织中过氧化物丙二醛(MDA)、过氧化氢(H2O2),和炎症因子白介素⁃6(IL⁃6)、肿瘤坏死因子⁃α(TNF⁃α)浓度显著升高;与M组比较,B组大鼠肺组织中过氧化物丙二醛(MDA)、过氧化氢(H2O2),和炎症因子白介素⁃6(IL⁃6)、肿瘤坏死因子⁃α(TNF⁃α)浓度降低,见表2。
表2 3 组大鼠肺组织中H2O2、MDA、IL⁃6 和TNF⁃α指标Tab.2 Changes of H2O2、MDA、IL⁃6 and TNF⁃α in 3 groups of rats ±s

表2 3 组大鼠肺组织中H2O2、MDA、IL⁃6 和TNF⁃α指标Tab.2 Changes of H2O2、MDA、IL⁃6 and TNF⁃α in 3 groups of rats ±s
注:与C 组比较,aP <0.05;与M 组比较,bP <0.05
组0.78ab 0.81ab 7.01b 5.30ab
2.4 标志物SPB 和CC10 的表达水平与C组比较,M组大鼠肺组织中Ⅱ型肺泡上皮细胞标志物SPB和气道黏膜上皮细胞标志物CC10的表达下调(P <0.05);与M组比较,B组大鼠肺组织中Ⅱ型肺泡上皮细胞标志物SPB和气道黏膜上皮细胞标志物CC10的表达上调(P <0.05),见图2。
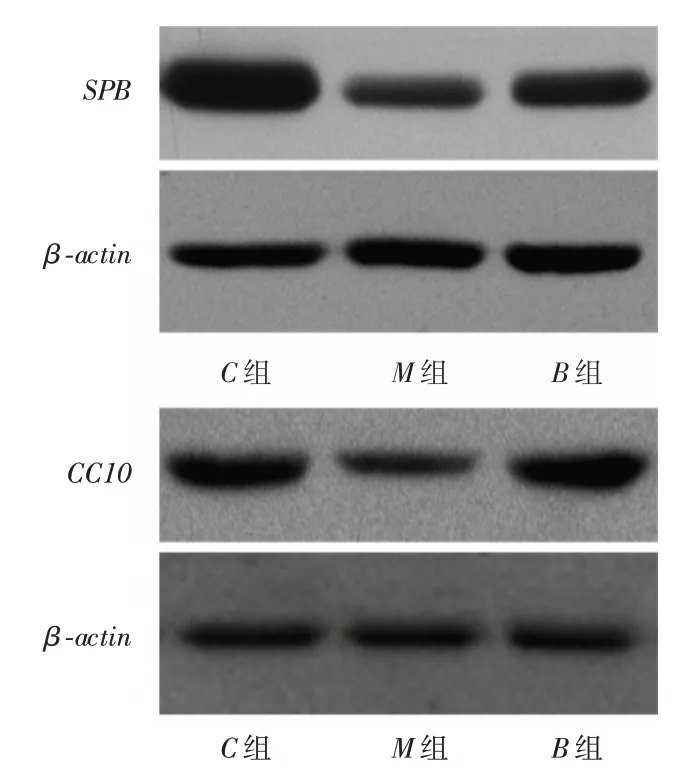
图2 3 组大鼠肺组织中SPB 和CC10 指标Fig.2 Changes of SPB and CC10 in 3 groups of rats
3 讨论
SPB和CC10分别是Ⅱ型肺泡上皮细胞和气道黏膜上皮细胞标志物,主要反应肺组织中Ⅱ型肺泡上皮细胞和气道黏膜上皮细胞的数量和功能[9-10]。本研究结果表明,与C组比较,M组大鼠肺组织充血、出血、水肿,炎性细胞浸润,PaO2下降;炎症因子IL⁃6、TNF⁃α和氧化因子H2O2、MDA水平升高;Ⅱ型肺泡上皮细胞和气道黏膜上皮细胞标志物SPB和CC10表达下调。这提示肺移植不仅导致大鼠肺组织充血、出血、水肿、炎性细胞浸润、PaO2下降;还可引起肺组织中炎症反应和氧化损伤,Ⅱ型肺泡上皮细胞和气道黏膜上皮细胞受损,进而诱发肺移植后急性肺损伤。
骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)被称为组织重建的“种子细胞”,许多组织或器官的缺损或病变均可以通过间充质干细胞移植进行治疗[11]。BMSCs除了具有多向分化潜能,还能在损伤部位反应性地分泌各类营养因子,这些因子不仅参与炎症调节和免疫反应,也参与了修复损伤的组织器官[12-13]。有学者研究[14-15]发现BMSCs可通过降低活性氧簇水平,提高机体抗氧化酶系统的活性,并减少炎症因子的释放,对脊髓损伤具有保护作用。Sca⁃1蛋白对细胞信号传导起到不可忽视的作用[16]。骨髓Sca⁃1间充质干细胞同时具备BMSCs和Sca⁃1双重优势。在本研究中,B组大鼠肺移植后给予骨髓Sca⁃1间充质干细胞处理,与M组比较,B组大鼠肺组织有少量的充血、出血,肺水肿减轻,PaO2升高;炎症因子IL⁃6、TNF⁃α和氧化因子H2O2、MDA水平下降;Ⅱ型肺泡上皮细胞和气道黏膜上皮细胞标志物SPB和CC10表达上调。这提示骨髓Sca⁃1间充质干细胞可减轻肺移植后的炎症反应和氧化损伤,修复受损的Ⅱ型肺泡上皮细胞和气道黏膜上皮细胞,提高氧分压,减轻肺水肿,改善肺功能。具体机制可能是:骨髓Sca⁃1间充质干细胞归巢至受损的肺组织,不仅可以改善局部内环境,而且可以定向分化为新的肺泡上皮细胞和气道黏膜上皮细胞,进而改善肺功能;骨髓Sca⁃1间充质干细胞具备分泌抑炎因子的能力,这些因子参与了炎症调节和免疫反应,减轻了肺组织的炎症和氧化损伤;骨髓Sca⁃1间充质干细胞还能够分泌多种营养因子,这些营养因子对受损的肺部细胞进行营养和修复,帮助其维持和恢复正常的功能。
通过研究骨髓Sca⁃1间充质干细胞移植对肺移植ALI的治疗作用及相关机制,有望为临床上治疗肺移植ALI患者提供有效、可行的治疗策略。但是,本研究仅收集肺移植成功后48 h的实验数据,存在一定的缺陷和不足,而骨髓Sca⁃1间充质干细胞对肺移植的远期生存和预后有待进一步研究。
综上所述,骨髓Sca⁃1间充质干细胞可能通过减轻炎症及氧化损伤,以及修复受损的肺泡及气道黏膜上皮细胞等途径减轻肺移植后急性肺损伤。
