新型冠状病毒肺炎患者静脉血栓形成的研究进展
2020-12-15杨逸成叶凯雁林凡熊长明
杨逸成 叶凯雁 林凡 熊长明
1中国医学科学院北京协和医学院阜外医院(北京100037);2南方医科大学第二临床医学院(广州510515);3北京大学人民医院血液科北京大学血液病研究所(北京100044)
2019年12月开始,新型冠状病毒(SARS⁃CoV⁃2)感染引起的新型冠状病毒肺炎(COVID⁃19)疫情在全球成为严重公共卫生问题。COVID⁃19主要传染源为患者和潜伏期感染者,通过呼吸道飞沫、接触和气溶胶等多种途径传播[1],临床症状以发热、咳嗽等呼吸道症状最为常见,严重可出现多器官功能障碍综合征、急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)和休克,临床上检验指标常提示患者淋巴细胞计数下降,C反应蛋白、心肌酶谱和心肌损伤标志物水平升高等,早期影像学表现为多发小斑片影及间质改变,可发展为双肺多发磨玻璃影、浸润影[2]。
近期,SARS⁃CoV⁃2诱导的凝血功能异常和静脉血栓栓塞症(venous thromboembolism,VTE)逐渐引起重视,是导致COVID⁃19患者病情加重和死亡的原因之一[3-5]。本文将对COVID⁃19患者的异常D⁃二聚体和其临床价值、SARS⁃CoV⁃2感染引起的VTE及其相关分子机制作一综述,以期为COVID⁃19患者更好的临床决策提供帮助。
1 COVID-19 患者D 二聚体水平升高
COVID⁃19患者中凝血功能检查常提示高凝状态,主要表现为D⁃二聚体的水平升高,并与疾病的严重程度和患者的死亡风险密切相关。
数据表明不少COVID⁃19患者中出现D⁃二聚体升高。CHEN等[6]纳入274例确诊患者,发现15.0%患者D⁃二聚体水平>21 000 μg/L;ZHOU等[7]的研究表明191例患者中D⁃二聚体升高的比例高达68%,其中26%的患者D⁃二聚体处于500 ~1 000 μg/L水平,D⁃二聚体水平高于1 000 μg/L的患者比例达到42%。ZHANG等[5]研究发现52.2%的COVID⁃19患者D⁃二聚体高于500 μg/L。MIDDELDORP等[4]共纳入131例COVID⁃19患者,D⁃二聚体>500 μg/L的患者比例更是高达84.0%,其中57%的患者D⁃二聚体>1 000 μg/L。
重症COVID⁃19患者中D⁃二聚体升高的比例更高。GUAN等[1]分析我国552家医院纳入的1 099例COVID⁃19患者,发现其中560例重症患者中59.6%存在D⁃二聚体水平500 μg/L,在非重症患者中的比例为43.2%;LI等[8]研究分析501例COVID⁃19患者发现重症和非重症患者中D⁃二聚体升高的比例分别为56.4%和31.1%。D⁃二聚体水平是COVID⁃19患者病情进展的独立预测因子[9-10],一项纳入5 279例患者的纽约研究[11]表明用D⁃二聚体>2 500 μg/L对疾病严重程度的预测价值比患者年龄和是否存在合并症更高,其中D⁃二聚体>2 500 μg/L的患者发展为急重症患者的风险增加3.93倍(OR =3.93,95%CI:2.6 ~6.0)。
此外,多项研究表明死亡患者的D⁃二聚体水平较存活患者高,该指标水平的升高是患者死亡风险增加的独立预测因子[12-13]。寻找能够准确预测COVID⁃19患者生存预后的D⁃二聚体水平具有重要的临床意义。ZHANG等[5]回顾性分析343例COVID⁃19确诊患者,发现能够预测院内COVID⁃19患者死亡的D⁃二聚体最适临界值为2 000 μg/L(灵敏度为92.3%,特异性为83.3%),当D⁃二聚体水平2 000 μg/L的患者与<2 000 μg/L的患者相比,其发生死亡的风险足足高出51.5倍,同时该研究提示D⁃二聚体水平变化可能是反映COVID⁃19患者治疗效果的早期指标。表1对不同研究报道的COVID⁃19患者D⁃二聚体升高的比例予以总结。
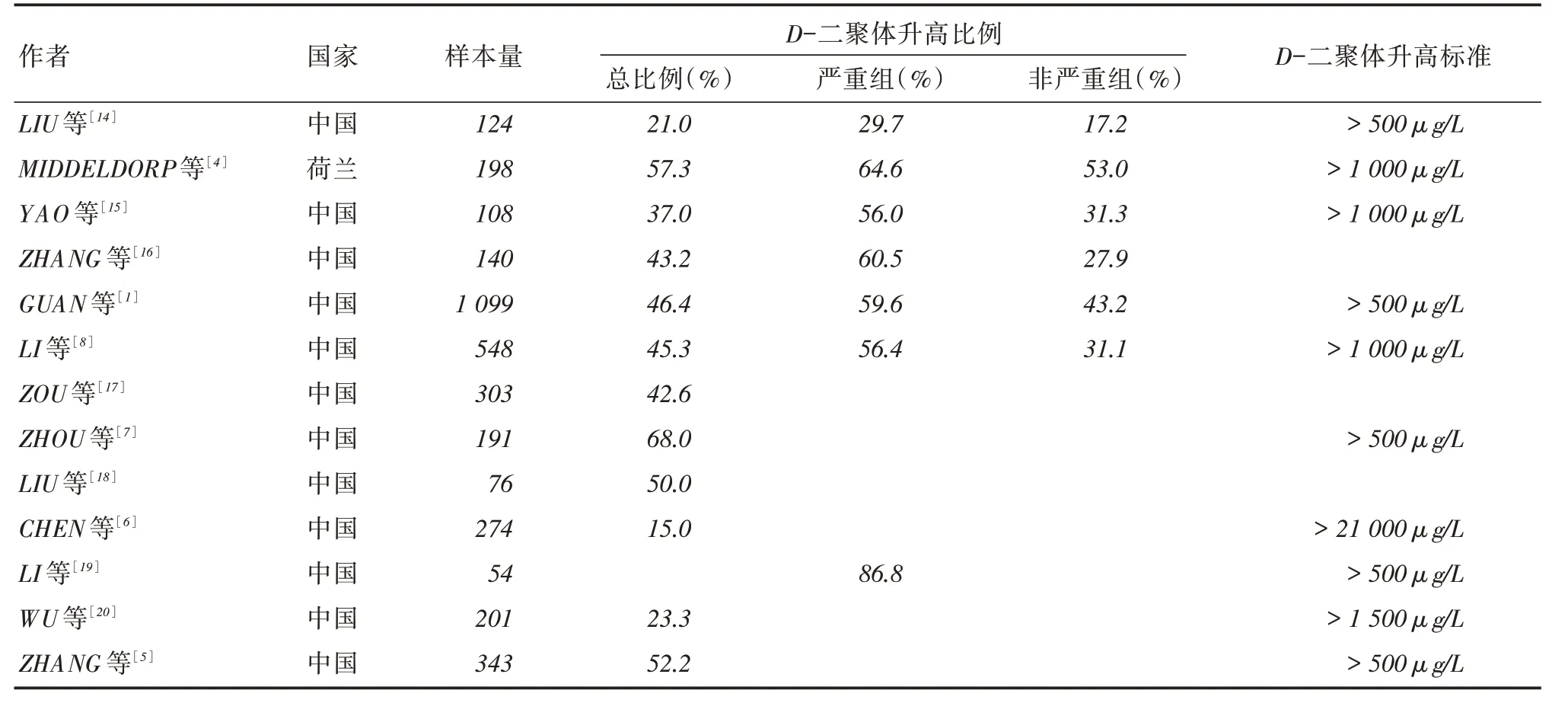
表1 COVID⁃19 患者中D⁃二聚体升高的比例Tab.1 Proportion of patients with COVID⁃19 with elevated D⁃dimmers
大量文献报道COVID⁃19患者中D⁃二聚体水平升高,然而受限于研究差异,得出的结果并不完全一致。首先,不同研究对D⁃二聚体升高的定义不同是造成结果差异的重要原因,部分研究将其定义为>500 μg/L,也有研究以1 000、1 500、21 000 μg/L为界划分;另一方面,年龄是引起D⁃二聚体水平升高的重要影响因素,随着年龄的增长D⁃二聚体的水平随之升高,而各研究纳入COVID⁃19患者的年龄有差异,也能部分解释为何上述COVID⁃19患者D⁃二聚体升高比例时存在较大差异;此外人种、合并基础疾病的不同以及是否采取预防性抗凝措施等因素也影响研究结果。D⁃二聚体水平的升高是COVID⁃19患者死亡风险的预测因子,然而今后仍需更大样本的临床研究明确其判断不同年龄层COVID⁃19患者预后的最适临界值以及D⁃二聚体动态变化对于指导患者治疗的意义。
2 COVID-19 与VTE
随着COVID⁃19患者并发VTE的报道,SARS⁃CoV⁃2感染引起的静脉血栓事件逐渐引起研究者们的重视。COVID⁃19患者中发生VTE的风险较高[21],COVID⁃19患者的尸检结果提示12例死亡患者中有7例(58%)存在深静脉血栓形成(DVT),且肺血栓栓塞症(PE)是导致其中4例患者死亡的直接原因[22]。
重症患者发生静脉血栓相关并发症的风险更高。FA等[23]开展的回顾性研究报道87%的重症COVID⁃19患者发生PE,并发静脉血栓事件使患者全因死亡风险上升5.4倍(HR=5.4,95%CI:2.4 ~12)。HELMS等[24]为进一步评估极重症COVID⁃19患者血栓形成的风险开展一项历史对照研究。该研究纳入150例发生ARDS的COVID⁃19患者至少随访7 d,研究表明相比于非COVID⁃19 ARDS患者,COVID⁃19 ARDS患者发生严重静脉血栓事件特别是PE(11.7 vs. 2.1%,P <0.008)的风险更高,在极重症COVID⁃19患者中需要更强的抗凝治疗。
COVID⁃19患者尤其是重症患者,其并发VTE特别是PE较为常见,应当引起足够的重视,如何预测COVID⁃19患者中VTE的发生风险,为患者提供更好的临床决策和降低病死率显得尤为关键。研究发现D⁃二聚体水平升高是COVID⁃19患者发生PE的危险因素[25],D⁃二聚体水平>1.0 μg/mL能有效预测COVID⁃19患者发生VTE风险,D⁃二聚体<1.0 μg/mL时对COVID⁃19患者发生VTE和PE的阴性预测值分别为90%和98%[26],其在诊断和筛选PE方面仍需要进一步验证。此外,D⁃二聚体作为预测COVID⁃19患者发生静脉血栓事件的指标,其在指导抗凝治疗等方面亦具有重要的临床价值,今后前瞻性研究中应当评估D⁃二聚体的水平变化在COVID⁃19患者抗凝治疗中的指导意义。
3 SARS-CoV-2 感染诱导血栓形成的机制
SARS⁃CoV⁃2诱导静脉血栓形成引起了学者们的重视,但其相关分子机制仍需要更多研究予以明确。按照国际病毒分类委员会的分类原则,冠状病毒的定种主要依赖于ORF1ab编码的7个结构域,包括ADRP、nsp5、nsp 12~16的氨基酸序列的相似程度。由于SARS⁃CoV⁃2的7个结构域的氨基酸序列与SARS⁃CoV的一致性>90%,因而两者均归类于套式病毒目、冠状病毒科、β冠状病毒属、Sarbecovirus亚属中的SARS相关冠状病毒种,两者存在很多相似之处[27]。目前研究提示内皮细胞的直接损伤、广泛的炎症反应和肾素⁃血管紧张素⁃醛固酮系统(RAAS)的异常等与SARS⁃CoV类似的致病机制可能参与了COVID⁃19患者并发静脉血栓事件的发生。
3.1 内皮细胞的直接损伤与SARS⁃CoV一样,SARS⁃CoV⁃2由S蛋白的受体结合结构域(RBD)和宿主细胞表面血管紧张素2(ACE2)受体识别后介导病毒入侵,且S蛋白的激活与TMPRSS2相关,TMPRSS2通过裂解ACE2和激活SARS⁃CoV⁃2蛋白介导病毒进入细胞[28-29]。WRAPP等[30]根据SARS⁃CoV⁃2的基因组序列,经过3D重建获得了S蛋白的三聚体结构,发现其与SARS⁃CoV中S蛋白结构存在结构差异,且SARS⁃CoV⁃2 S蛋白与ACE2之间的亲和力较SARS⁃CoV增长了10 ~20倍,更易侵入表达ACE2受体的细胞造成直接损伤。SARS⁃CoV⁃2可以直接损伤表达有ACE2受体的心肌细胞,同时病毒利用胞内的营养物质进行复制增殖,加重细胞负担并导致线粒体结构、功能异常和凋亡途径激活等机制造成心肌损害[31]。由于血管内皮细胞表面广泛表达ACE2受体,SARS⁃CoV⁃2也可能通过上述类似途径造成血管内皮细胞的损伤。正常的血管内皮细胞在抗血栓形成方面发挥着重要作用[31],正由于病毒引起的血管内皮损伤破坏细胞功能,从而导致机体血栓形成。
3.2 细胞因子风暴炎症反应是宿主抵抗感染的重要途径,有研究[32]指出SARS⁃CoV⁃2感染诱导的过度的炎症反应,又称细胞因子风暴驱动局部或者全身血管内皮功能障碍和损伤,导致血管通透性增加,凝血酶生成过多和纤维蛋白溶解受到抑制,从而引起血栓形成。
大量病毒与ACE2受体结合后可导致炎症细胞浸润和过度炎症反应,通过促进血管内皮细胞活化和内皮功能障碍诱导血栓前状态。止血过程和先天免疫系统之间存在广泛的相互作用,在感染过程中,血小板、凝血因子和先天性免疫系统(例如Mø、PMN和补体系统)相互作用形成血栓凝块,称为免疫血栓形成[13,33-35]。血小板活化后上调P⁃选择素并产生血小板⁃中性粒细胞复合物,有助于形成免疫血栓抑制病原体的扩散,但广泛的免疫血栓形成[35]和大量血小板⁃中性粒细胞复合物的累积可能是引起微血管病变和血管闭塞性血栓形成的重要原因[32]。
SARS⁃CoV⁃2感染诱导的细胞因子风暴引起患者损伤,HUANG等[36]报道COVID⁃19患者中存在高水平的促炎细胞因子和趋化因子、IL⁃1B、IFN⁃γ、CXCL10和CCL2水平升高提示Th1细胞功能的激活,且CXCL10、CCL2和TNF⁃α在入住ICU重症患者中水平更高。免疫效应细胞释放大量促炎细胞因子(IFN⁃α、IFN⁃γ、IL⁃1β、IL⁃6、IL⁃12、IL⁃18、IL⁃33、TNF⁃α、TGF⁃β)和趋化因子(CXCL10、CXCL8、CX⁃CL9、CCL2、CCL3、CCL5)并导致机体损伤,常是严重患者导致死亡的重要原因[37]。促炎性细胞因子,特别是IL⁃1β、IL⁃6和TNF⁃α能促进血管性血友病因子(vWF)多聚体的释放,诱导组织因子和FVII/FVIIa产生,使凝血酶生成增加并降低组织因子途径抑制物、抗凝血酶和活化蛋白C等水平,在内皮细胞、血小板、先天性免疫系统和凝血系统之间的广泛相互作用下导致高凝状态,促进静脉血栓形成。
有研究[38]开发出结构类似于抗体的特殊蛋白质能吸收过量的细胞因子,从而抑制细胞因子风暴对机体造成的损害,目前仍处于实验阶段,需要进一步探讨该特殊蛋白质应用于临床治疗的实际价值。
3.3 RAAS 的异常SARS⁃CoV⁃2与ACE2结合后降低ACE2酶的活性,引起血管紧张素Ⅱ(AngⅡ)水平升高,从而导致血管内皮功能障碍、血管收缩和炎症反应[39]。研究发现RAAS系统与凝血途径存在相互作用,AngⅡ的升高可能是促进COVID⁃19患者微血栓形成的又一机制。AngⅡ通过结合AT1受体后诱导内皮细胞表达组织因子和纤溶酶原激活物抑制物⁃1(PAI⁃1),造成tPA(组织型纤溶酶原激活剂)和PAI⁃1比例失衡,从而降低纤维蛋白溶解和促进血液高凝,加剧COVID⁃19患者的血栓形成[40-41],然而具体的分子机制仍有待更深入的研究予以明确。
此外,激素和免疫球蛋白在临床上的应用以及机械通气和其他有创操作导致患者血液高凝也是发生血栓并发症的危险因素。COVID⁃19患者发热和胃肠道症状等导致机体脱水状态,引起血液瘀滞也会增加血栓形成风险。
4 总结
COVID⁃19患者中D⁃二聚体水平升高较为常见,是疾病严重程度和死亡风险的预测因子,且其水平变化可能是反映患者治疗效果的早期指标。另一方面,COVID⁃19患者特别是重症患者发生VTE的风险很高,D⁃二聚体也有望成为预测患者发生VTE风险大小的有效指标。SARS⁃CoV⁃2感染诱导内皮的直接损伤、细胞因子风暴的释放和RAAS的异常可能是导致血栓形成的重要原因,仍需更多研究深入探讨SARS⁃CoV⁃2诱导血栓形成的分子机制,为更好地防控血栓事件的发生提供帮助。
