mTOR抑制剂雷帕霉素对癫痫后脑损伤保护机制研究
2020-12-15周弟弥甘露周成芳陈琳
周弟弥 甘露 周成芳 陈琳
南华大学附属第二医院神经内科(湖南衡阳421001)
癫痫是由于大脑神经元异常放电引起反复痫性发作的脑功能失调综合征。癫痫的发病机制尚不完全清楚,目前的抗癫痫药物仅控制癫痫症状,而不影响疾病的病理过程[1],并且约有三分之一的患者为难治性癫痫[2]。因而探讨癫痫的发病机制,寻找新的抗癫痫药物有着重要意义。
哺乳动物雷帕霉素靶蛋白(mammalian target of repamycin,mTOR)是一种与PI3K/Akt通路相关的蛋白激酶[3]。研究报道,mTOR不仅可以调节神经元和神经胶质的多种生理过程,还参与了突触结构和可塑性,这可能导致在病理条件下异常的神经元信号传导[4-5]。笔者推测,PI3K/Akt/mTOR信号通路很可能参与了癫痫的病理过程。小胶质细胞是中枢神经系统内固有免疫效应细胞,是促炎症因子和氧化应激的重要来源。研究[6]表明,活化的小胶质细胞可激活mTOR信号通路,引起神经元树突状损伤,并可能引起随后癫痫的病程[7]。基于以上原因,本研究选取了小胶质细胞为研究对象。
雷帕霉素(Repamycin,RAPA)是一种mTOR抑制剂,研究[8-9]表明RAPA对mTOR的抑制作用可减少癫痫发作的强度和频率,但是对于RAPA是否可以用于癫痫的治疗及其作用机制国内外鲜有报道。本实验通过建立大鼠癫痫模型,并予RAPA干预治疗,观察小胶质细胞活化,PI3K/Akt/mTOR及NF⁃kB/IL⁃6信号通路的表达变化,探讨RAPA在癫痫后脑损伤中的作用及机制。
1 材料与方法
1.1 实验试剂KA和RAPA(美国Sigma⁃Aldrich),BCA蛋白定量试剂盒(中国碧云天公司),PVDF膜(Millipore公司),ECL化学发光剂(Santa Cruz公司),Trizol试剂(GIBCO BRL公司),PI3K、Akt、mTOR、NF⁃kB、IL⁃6及β⁃actin小鼠抗大鼠抗体(Ab⁃cam公司),活化小胶质细胞标志物Iba1(美国Cell Signaling Technology),qRT⁃PCR及cDNA合成试剂盒(美国Thermo Scientific)。
1.2 癫痫模型的建立及分组选取40只6 ~8周龄雄性SD大鼠,随机分为4组,Control组、KA组、KA+ RAPA 5 mg/kg组及KA+RAPA 10 mg/kg组,每组10只,通过腹腔注射海人酸KA 15 mg/kg制作大鼠癫痫模型,参考Racine分级标准,出现Ⅳ~V级痫性发作为造模成功[10];KA诱导癫痫前2 h腹腔注射RAPA(5 mg/kg或10 mg/kg)预治疗,Control组仅注射生理盐水。大鼠癫痫后24 h断头取脑,收集大脑皮层组织,保存于-80 ℃冰箱,用于后续实验。
1.3 免疫组化染色观察小胶质细胞活化大鼠癫痫后24 h先用10%水合氯醛(0.3 g/kg)腹腔注射麻醉,断头,沿中线切开头皮并沿矢状缝剪开颅骨,取出大脑,分离大脑皮层组织,浸入4%多聚甲醛溶液中固定24 h。常规脱水、透明、浸蜡、包埋后,在皮质区连续切片,片厚5 μm。石蜡切片置于60 ℃烤箱中烘烤2 h,脱蜡至水,用pH 7.4的PBS冲洗三次。将脱蜡水化后的组织切片放入沸腾的柠檬酸盐缓冲液进行抗原修复,10 min后从缓冲液中取出玻片,用PBS冲洗3次。每张切片加1滴3%H2O2,室温下孵育10 min,以阻断内源性过氧化物酶的活性。PBS冲洗后每张切片加小鼠抗大鼠一抗Iba1(1∶100),室温下孵育2 h。PBS冲洗后每张切片加兔抗小鼠二抗,室温下孵育30 min。PBS冲洗后每张切片加1滴新鲜配制的DAB液显色,显微镜下观察切片染色情况。光镜下对每张切片随机选取5个面积相同的高倍视野(积相同的倍),肉眼计数每个视野Iba1染色阳性细胞数,取平均值即为活化的小胶质细胞数。
1.4 Western blot 检测PI3K、Akt、mTOR、NFkB、IL-6 蛋白含量大鼠癫痫后24 h断头取脑,分离大脑皮质,用玻璃棒将皮质匀浆至无肉眼可见碎片。加入RIPA裂解液与PMSF蛋白酶抑制剂,再次匀浆直到组织充分破碎。4 ℃下12 000 r/min离心10 min,离心的上清液即是总蛋白。取上清液,BCA法测定蛋白浓度。按说明书配制10%分离胶和浓缩胶并放至电泳槽内。样品与5×Loading buf⁃fer按体积4∶1混合,98 ℃煮沸5 min;上样时蛋白总量保持一致。向电泳槽中先加入电泳液,恒压电泳,蛋白从浓缩胶移动到分离胶;电泳结束后取出电泳架,切去多余的分离胶及浓缩胶;在转膜槽中加入转膜液,将蛋白转移到PVDF膜;转膜结束后用PBS浸泡PVDF膜,后用5%脱脂牛奶封闭,室温下水平摇床封闭2 h;弃去封闭液,敷一抗(小鼠抗大鼠):PI3K(1∶2 000)、Akt、(1∶1 000)、mTOR(1∶2 000)、NF⁃kB(1∶1 000)、IL⁃6(1∶5 000),4 ℃孵育过夜;用PBS洗膜后敷二抗(兔抗小鼠1∶2 000),在室温下孵育2 h,用PBS清洗10 min。等体积混合ECL发光液A和B,将PVDF膜浸泡在发光液中;约5 min后用显影仪扫描胶片;用Image J软件分析蛋白条带。
1.5 qRT-PCR方法检测PI3K、Akt、mTOR mRNA表达量取分离的大脑皮层组织,加入Trizol裂解液和氯仿,经过分离、沉淀、干燥等步骤得到总RNA。按照Thermo Scientific cDNA合成试剂盒的说明,加入样本RNA、逆转录酶、上游引物和下游引物合成模板cDNA。按照qRT⁃PCR试剂盒的要求,加入cDNA、上游引物和下游引物在PCR仪上进行DNA扩增。qRT⁃PCR循环扩增条件如下:PI3K,变性:95 ℃,45 s;退火:58 ℃,45 s;延伸:72 ℃,1 min;30个循环;Akt,变性:95 ℃,45 s;退火:52 ℃,1 min;延伸:70 ℃,1 min;30个循环;mTOR,变性:95 ℃,45 s;退火:56 ℃,45 s;延伸:72 ℃,1 min;30个循环;GAPDH(内参),变性:95 ℃,30 s;退火:58 ℃,30 s;延伸:72 ℃,30 s;28个循环;DNA扩增结束后4 ℃冷却,分析数据。qRT⁃PCR引物见表1。
1.6 统计学方法所有数据以均数±标准差表示,统计分析使用SPSS 20.0软件。两组间比较使用t检验,多组间比较使用单因素方差分析(ANOVA)。P <0.05表示差异有统计学意义。

表1 qRT⁃PCR 引物核苷酸序列Tab.1 qRT⁃PCR primer nucleotide sequence
2 结果
2.1 癫痫模型成功率共30只大鼠注射了KA,结果KA组有2只由于惊厥持续状态而导致死亡,KA+RAPA 5 mg/kg组及KA+RAPA 10 mg/kg组分别有1只未出现惊厥发作,造模成功率86.7%。最终每组选取8只大鼠用于后续实验。
2.2 RAPA减少小胶质细胞的活化Iba1免疫组化观察大鼠癫痫后24 h小胶质细胞活化情况(图1),活化的小胶质细胞可被染成褐色或棕褐色。Control组背景为淡蓝色,以静止小胶质细胞为主,胞体较小,有着细长的放射状分支,偶尔可见散在的活化小胶质细胞(图1A)。KA组背景呈黄褐色,细胞胞体变圆、体积变大,突起变短或消失,细胞呈阿米巴状或圆形(图1B);与Control组比较,小胶质细胞活化数量显著增加(P <0.05,图2)。KA+RAPA 5 mg/kg及KA+RAPA 10 mg/kg组背景颜色变浅,细胞体积较前变小(图1C、D);与KA组比较,活化的小胶质细胞显著减少(P <0.05,图2)。免疫组化染色提示RAPA可以减少癫痫后小胶质细胞活化,对脑损伤有保护作用。

图1 免疫组化观察癫痫后24 h 脑皮层组织小胶质细胞活化(×400)Fig.1 Microglia activation was observed by Immunohistochemistry in cerebral cortex tissues 24 hours after epilepsy(×400)
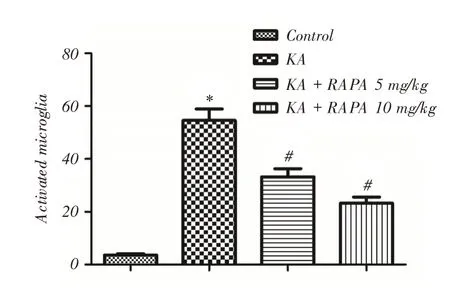
图2 Iba1 免疫组化染色并计数活化的小胶质细胞数Fig.2 The number of activated microglia were counted by Iba1 immunohistochemical staining
2.3 RAPA减少PI3K、Akt、mTOR蛋白水平为了探讨RAPA对PI3K/Akt信号通路的影响,Western bolt测定了大鼠癫痫后24 h大脑皮层PI3K、Akt、mTOR蛋白表达水平(图3A)。将条带进行光密度检测进一步得出了蛋白的相对表达量(图3B)。由图可以看出,癫痫后KA组PI3K、Akt、mTOR蛋白表达较Control组显著增加(P <0.05),RAPA治疗组PI3K、Akt、mTOR蛋白表达显著低于和KA组(P <0.05);进一步比较发现,KA+RAPA10 mg/kg组显著低于KA+RAPA5 mg/kg组mTOR蛋白表达(P <0.05)。
Western bolt结果显示,癫痫后KA组PI3K/Akt信号通路蛋白表达明显高于对照组,而RAPA能抑制KA诱导的PI3K/Akt信号通路改变;其中对mTOR蛋白表达抑制作用,KA+RAPA 10 mg/kg组显著强于KA+RAPA 5 mg/kg组。
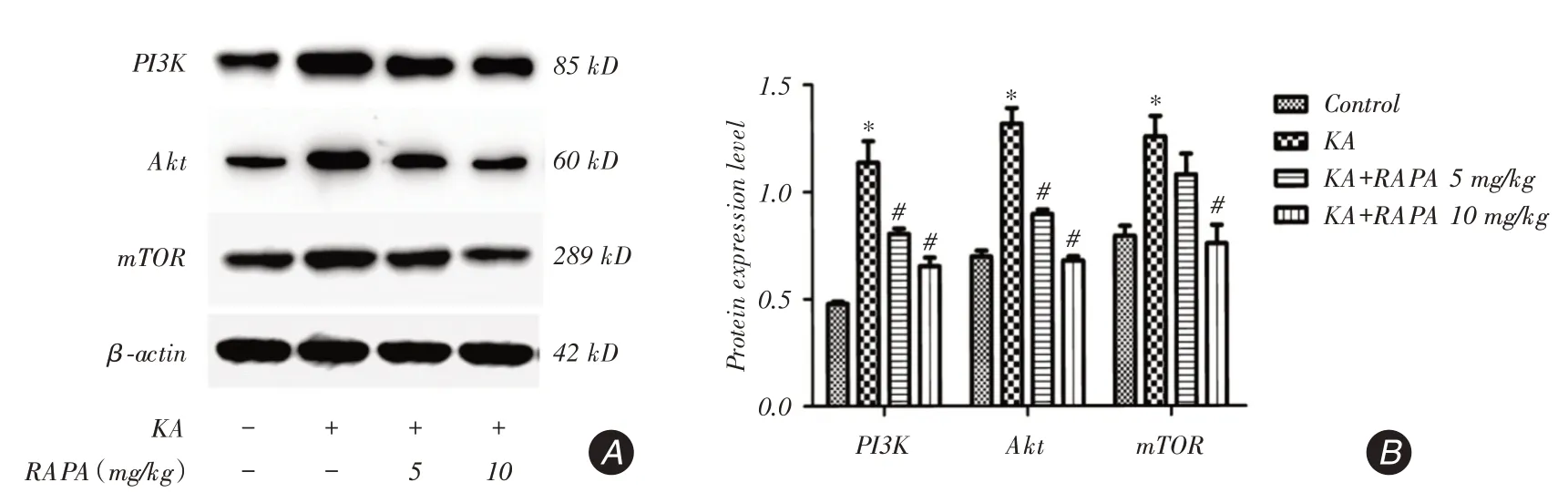
图3 Western blot 检测癫痫后24 h 大脑皮质PI3K、Akt、mTOR 蛋白表达量Fig.3 The protein expression of PI3K,Akt and mTOR were detected by Western blot in the cerebral cortex 24 h after epilepsy
2.4 RAPA减少PI3K、Akt、mTOR mRNA水平为了进一步探讨RAPA对PI3K/Akt信号通路的影响,qRT⁃PCR测定了大鼠癫痫后24 h大脑皮层PI3K、Akt、mTOR mRNA表达水平(图4)。具体结果如下:(1)癫痫后KA组PI3K、Akt、mTOR mRNA表达显著增加(P <0.05),而10 mg/kg RAPA治疗组能抑制三者表达增加(P <0.05);其中5 mg/kg RAPA治疗组能抑制Akt mRNA表达增加(P <0.05);(2)进一步比较发现,KA+RAPA 10 mg/kg组显著低于KA+RA⁃PA 5 mg/kg组PI3K、mTOR mRNA表达(P <0.05)。
qRT⁃PCR结果显示癫痫后KA组PI3K、Akt、mTOR mRNA表达较对照组显著增加,而RAPA能抑制KA诱导的PI3K/Akt信号通路改变。RAPA对PI3K和mTOR的抑制作用与剂量有关。
2.5 RAPA 抑制NF-kB/IL-6 炎症通路为了探讨RAPA对NF⁃kB/IL⁃6信号通路的影响,Western blot测定了大鼠癫痫后24 h大脑皮层NF⁃κB、IL⁃6蛋白表达水平(图5A)。将蛋白条带进行光密度分析(图5B),可以发现癫痫后KA组NF⁃κB、IL⁃6蛋白表达较Control组显著增加(P <0.05),RAPA(5 mg/kg或10 mg/kg)治疗后显著降低了两者的表达水平(P <0.05);进一步比较发现,KA+RAPA 10 mg/kg组显著低于KA+RAPA 5 mg/kg组IL⁃6蛋白表达(P <0.05)。

图4 qPCR 检测癫痫后24 h 大脑皮质PI3K、Akt、mTOR mRNA 表达量Fig.4 The mRNA expression of PI3K,Akt and mTOR were detected by qPCR in the cerebral cortex 24 h after epilepsy
该结果提示癫痫后可以激活NF⁃kB/IL⁃6炎症信号通路,而RAPA能抑制KA诱导的炎症信号通路改变;其中对炎症因子IL⁃6抑制作用与剂量有关,在本实验中RAPA 10 mg/kg效果更佳。
3 讨论
癫痫是常见的神经系统疾病,它的病理特征包括小胶质细胞的增殖,神经元数量的减少甚至消失,抑制性神经递质与兴奋性神经递质之间的失衡等[11]。现有的抗癫痫药物主要通过调节神经递质受体(如γ⁃氨基丁酸、谷氨酸和乙酰胆碱受体)或离子通道从而抑制神经元兴奋性[12-13],而不能从癫痫的发生机制去控制发作。本实验选择了海人酸KA诱导癫痫模型,因为该模型类似于人类颞叶癫痫模型,且该模型稳定性和重复性好。
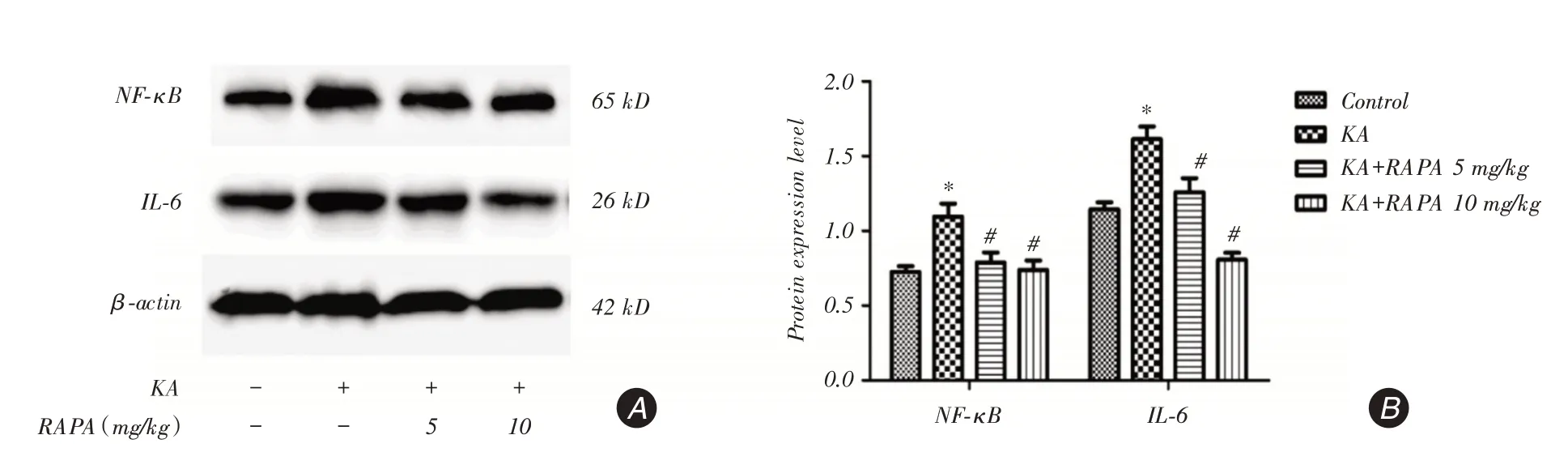
图5 Western blot 检测癫痫后24 h 大脑皮质NF⁃κB、IL⁃6 蛋白表达水平Fig.5 The protein expression of NF⁃κB and IL⁃6 were detected by Western blot in the cerebral cortex 24 h after epilepsy
小胶质细胞是中枢神经系统的主要抗原呈递细胞[14]。在正常情况下,小胶质细胞处于静止状态,受到异常刺激时可被激活,迅速增殖并迁移到受伤的部位,介导神经炎症以及诱导神经元凋亡[15]。因此,抑制小胶质细胞的激活和增殖可能是减轻癫痫后损伤的有效措施。本实验用KA诱导大鼠癫痫模型,免疫组化结果显示KA组活化的小胶质细胞数量较对照组明显增高,证实了小胶质细胞的活化参与了癫痫的病理过程。具体机制考虑活化的小胶质细胞分泌多种免疫效应分子,例如白介素IL⁃1、IL⁃6、IL⁃8、肿瘤坏死因子和氧自由基等[16],会破坏神经元、神经胶质细胞和血脑屏障,引起中枢神经系统的局部或广泛损伤,可引起癫痫发作并加重癫痫后脑损伤[17]。
磷脂酰肌醇⁃3激酶(phosphatidylinositide 3⁃ki⁃nases,PI3K),是一种胞内磷脂酰肌醇激酶,是多种生长因子和信号传导复合物。Akt是PI3K下游的作用靶点,可通过磷酸化底物调控凋亡、蛋白合成、代谢和细胞周期[18-19]。mTOR是PI3K相关激酶家族的成员,也是PI3K/Akt信号的下游因子。PI3K/Akt/mTOR信号通路通过抑制细胞凋亡在细胞生长中起重要作用,包括蛋白质合成、肿瘤生长和血管生成[20]。本实验测定了大鼠癫痫后大脑皮层PI3K/Akt信号通路变化,发现PI3K、Akt、mTOR蛋白和mRNA表达较对照组明显增高,提示PI3K/Akt信号通路参与了癫痫的病理过程。考虑原因如下:(1)mTOR过度激活能导致大脑皮质畸形和癫痫表型的基因表达[21];(2)PI3K/Akt信号通路参与细胞的合成与增殖,促进了小胶质细胞的合成,从而加剧了免疫炎症反应;(3)PI3K/Akt信号激活缺氧诱导因子,同时调控葡萄糖转运蛋白(GLUT),导致神经元过度激活[22]。但也有报道指出,PI3K/Akt信号通路对癫痫有保护作用,这是因为该通路可以减少神经元的凋亡和缺血性脑损伤[23],同时可能由于mTOR在细胞内存在mTORC1和mTORC2两种不同的复合体,可调节不同的细胞过程有关。
NF⁃κB是细胞质中一种重要的核转录因子,可启动或抑制有关基因的转录。白介素⁃6(IL⁃6)是一种炎症细胞因子,受到NF⁃κB的调节作用,在机体的炎症、免疫及应激反应中起到重要作用[24]。Western blot测定了大鼠癫痫后大脑皮层NF⁃κB、IL⁃6蛋白表达量,发现它们的表达量较对照组明显增高,提示NF⁃κB信号通路参与了癫痫的病理过程。主要病理机制可能是机体受到刺激时,小胶质细胞从静止状态转变为M1型活化状态,激活了NF⁃κB炎症信号通路,导致IL⁃6、IL⁃1β和TNF⁃α等炎症细胞因子水平明显增高以及诱导神经元的凋亡[25];同时NF⁃κB可进一步激活神经胶质细胞释放促炎细胞因子,这种细胞因子的释放能够增加局部神经元兴奋性,从而导致癫痫发作[26]。
雷帕霉素RAPA是mTOR特异性抑制剂,既往的研究中,RAPA可能通过调节特定离子通道如钾离子通道或控制神经元信号传导的蛋白质而间接影响神经元兴奋性[27]。在本实验中,KA诱导大鼠癫痫,观察到PI3K/Akt/mTOR信号通路被激活、小胶质细胞活化增加以及NF⁃κB炎症信号通路表达增加,而RAPA干预治疗对这些病理过程有明显的抑制作用,表明RAPA可以减少通过减少癫痫的病理过程从而起到脑损伤的保护作用。同时从实验结果可以发现,RAPA在剂量为10 mg/kg比5 mg/kg治疗效果更好,说明RAPA对脑损伤的保护作用可能有剂量依赖性。
RAPA目前临床上主要用于器官移植的抗排斥反应、自身免疫性疾病及抗肿瘤的治疗[28],在癫痫方面的研究还很有限。在本研究中,不仅证实了RAPA对癫痫后脑损伤有保护作用,同时也从病理学机制上做了进一步阐述,为临床上难治性癫痫药物的开发提供了新的思路。由于实验的局限性,未能对RAPA更多的干预剂量进行研究。在今后的试验中,将进一步增加药物对照组,以探讨RAPA最合适治疗剂量;同时将对癫痫后行为学的改变进行研究,为临床治疗提供更多的理论基础。
RAPA可以通过调节PI3K/AKt/mTOR信号通路抑制小胶质细胞增殖和活化,同时通过抑制NF⁃κB信号通路减少了炎症因子的表达,表明RAPA对癫痫后脑损伤有潜在的保护作用,为癫痫和其他神经系统退行性疾病的治疗提供了新的策略。
