淫羊藿次苷Ⅱ对舌鳞状细胞癌上皮⁃间质转化的抑制作用
2020-12-15莫志洋李英韩晓东王虹霞翁巧凤
莫志洋 李英 韩晓东 王虹霞 翁巧凤
青海省人民医院1颌面整形外科,2麻醉科(西宁810008);3青海大学附属医学院口腔科(西宁810001)
舌鳞状细胞癌(tongue squamous cell carcinoma,TSCC)是常见的口腔恶性肿瘤,发病率、病死率均较高[1-2]。上皮⁃间质转化(epithelial mesenchymal transition,EMT)是肿瘤转移、侵袭的起始步骤,与口腔鳞癌、喉癌、乳腺癌等恶性肿瘤发展过程密切相关[3-5]。淫羊藿次苷Ⅱ(icariside Ⅱ,ICSⅡ)是中药淫羊藿主要提取物,可增强免疫功能、延缓衰老、调节骨代谢,抗肿瘤作用显著。目前,临床对ICS Ⅱ的探索多围绕骨髓间充质干细胞成骨性分化、肿瘤细胞增殖等方面[6-7],鲜有关于其对TSCC EMT作用的研究。近年来有研究表明[8-9],Notch1/PTEN/FAK信号传导途径的异常激活是肿瘤形成机制之一,且参与调节多种组织细胞的生长、分化、凋亡,但关于该通路在TCSS EMT中的作用研究尚少。鉴于此,本研究将探讨ICSⅡ对TSCC细胞EMT影响,并探究其通过Notch1/PTEN/FAK通路的调控机制。现报道如下。
1 材料与方法
1.1 材料
1.1.1 细胞TSCC细胞Tca⁃8113,购自中国医学科学院肿瘤细胞库。
1.1.2 药物、主要试剂、主要仪器淫羊藿次苷Ⅱ(上海纯优生物科技有限公司,纯度>98%),胎牛血清、RPMI⁃1640培养基(美国Amresco公司),四氮唑盐(microculture tetrozolium,MTT)溶液、二甲基亚砜(dimethyl sulfoxide,DMSO)(美国Sigma公司),吉姆萨(Giemsa)染色液(南京亿迅生物科技有限公司),BCA蛋白定量试剂盒(日本Takara公司),兔抗人Notch1、PTEN、FAK、磷酸化FAK(p⁃FAK)单抗(美国Abcam公司),辣根过氧化酶标记的二抗(上海合星生物科技有限公司)。
NIB900⁃FL型倒置荧光显微镜(德国Leica公司),SpectraMax iD3酶联免疫检测仪(美谷分子仪器(上海)有限公司),Transwell小室(北京优尼康生物科技有限公司),TY⁃80电泳仪(南京普阳科学仪器研究所),Fluor Chem FC2凝胶成像系统(美国Bio⁃rad公司)。
1.2 方法
1.2.1 细胞培养、干预RPMI⁃1640培养基(含10%胎牛血清),37 ℃、5 % CO2培养箱常规培养Tca⁃8113细胞,隔天换液,倒置显微镜观察细胞生长状态,待贴壁80%左右,胰酶消化调整密度传代。取对数期细胞分装至96孔板,200 μL/孔,设为空白组,ICS Ⅱ低、中、高剂量组,每组5个复孔,至细胞再次贴壁80%左右,加入不同浓度ICS Ⅱ,使各孔终浓度分别为12.5、25、50 μmol/L,空白组加入等量PBS处理,继续常规条件培养。
1.2.2 细胞增殖抑制率测算MTT法:取各组干预24、48、72 h的Tca⁃8113细胞,弃去旧培养基后将新制备MTT溶液(浓度为5 μg/μL)滴入每孔中,20 μL/孔,于37 ℃、5%二氧化碳培养箱中培养4 h,弃去上层培养液,每孔加入DMSO溶液,100 μL/孔,充分震荡30 min后采用酶联免疫检测仪测定570 nm处吸光度(A)值,计算细胞增殖抑制率(%)=(A空白组⁃A剂量组)/A空白组×100%。重复3次取均值。
1.2.3 细胞迁移能力测定划痕试验:取各组干预48 h的Tca⁃8113细胞,胰酶消化,重悬,重新调整密度至2.0 × 104个/mL,接种于6孔板,孵育24 h待细胞铺满后弃去培养基。采用2 μL移液器枪头沿单层细胞划过,PBS轻吹去除细胞碎片,置入完全培养基继续孵育24 h后。采用显微镜观察,计算细胞迁移率(%)=(初始划痕宽度—测量时划痕宽度)/初始划痕宽度×100%。
1.2.4 细胞侵袭能力测定Transwell小室试验:取各组干预48 h的Tca⁃8113细胞,调整细胞密度为2.0 × 105个/mL的细胞悬液,取200 μL接种于Transwell小室(24孔趋化板,孔径8 μm)上室,下室中加入含10%胎牛血清培养基,孵育24 h擦去上室细胞,采用预冷PBS溶液冲洗,10%甲醛固定15 min,Giemsa染色后取少量悬液置于计数板中,显微镜观察穿膜细胞数量。
1.2.5 细胞中Notch1、PTEN、FAK、p-FAK 蛋白相对表达量Western blot法:取各组干预72 h的TSCC细胞,冰上裂解,12 000 r/min离心15 min(离心半径为8 cm),BCA试剂盒定量蛋白。取30 μg样品与上样缓冲液混合,凝胶电泳30 min,电转45 min,加入5%脱脂奶粉封闭液封闭2 h,加入一抗(1∶1 000)于4 ℃孵育过夜,TBTS冲洗,加入辣根过氧化物酶标记二抗(1∶10 000),常温孵育2 h,TBTS冲洗。20 min内曝光、显影。采用凝胶成像系统扫描,以Notch1、PTEN、FAK、p⁃FAK蛋白灰度值/内参β⁃actin灰度值表示蛋白相对表达量,计算p⁃FAK/FAK。
1.3 统计学方法采用SPSS 26.0统计学软件分析,计量资料以均数±标准差表示,多样本计量资料以方差分析检验,以SNK⁃q检验分析两两样本。P <0.05差异有统计学意义。
2 结果
2.1 各组增殖抑制率增殖抑制率组间比较,差异有统计学意义(P <0.05);ICS Ⅱ低、中、高剂量组24、48、72 h增殖抑制率均呈上升趋势(P <0.05);随时间延长各组增殖抑制率呈上升趋势(P <0.05)。见表1。
表1 各组增殖抑制率Tab.1 Comparison of proliferation inhibition rate in each group ±s,%
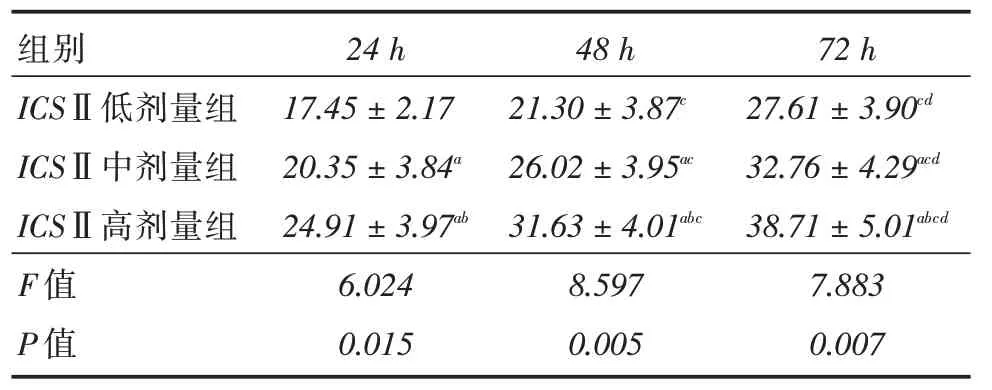
表1 各组增殖抑制率Tab.1 Comparison of proliferation inhibition rate in each group ±s,%
注:与ICS Ⅱ低剂量组比较,aP <0.05;与ICS Ⅱ中剂量组比较,bP <0.05;与24 h 比较,cP <0.05;与48 h 比较,dP <0.05
组别ICSⅡ低剂量组ICSⅡ中剂量组ICSⅡ高剂量组F 值P 值24 h 17.45±2.17 20.35±3.84a 24.91±3.97ab 6.024 0.015 48 h 21.30±3.87c 26.02±3.95ac 31.63±4.01abc 8.597 0.005 72 h 27.61±3.90cd 32.76±4.29acd 38.71±5.01abcd 7.883 0.007
2.2 各组迁移能力空白组,ICSⅡ低、中、高剂量组迁移率分别为(86.14±9.11)%、(72.62±7.45)%、(60.91 ± 8.14)%、(33.86 ± 5.16)%,迁移率组间比较,差异有统计学意义(F=42.669,P <0.001);空白组大于ICSⅡ低、中、高剂量组(t=2.569,P=0.033;t = 4.618,P = 0.002;t = 11.166,P <0.001);ICSⅡ低剂量组大于ICSⅡ中、高剂量组(t = 2.373,P =0.045;t = 9.564,P <0.001),ICSⅡ中剂量组大于ICSⅡ高剂量组(t=6.276,P <0.001)。见图1。

图1 划痕试验结果(×100)Fig.1 Scratch test results(×100)
2.3 各组侵袭能力空白组,ICS Ⅱ低、中、高剂量组每个视野穿膜细胞数分别为(119.86 ± 27.09)、(98.74±18.92)、(40.30±7.35)、(19.10±4.27)个,穿膜细胞数组间比较,差异有统计学意义(F = 38.851,P <0.001);空白组多于ICS Ⅱ低、中、高剂量组(t=2.469,P=0.039;t=6.338,P <0.001;t=8.216,
P <0.001);ICS Ⅱ低剂量组多于ICS Ⅱ中、高剂量组(t=6.438,P <0.001;t=9.181,P <0.001),ICS Ⅱ中剂量组多于ICS Ⅱ高剂量组(t=5.577,P=0.001)。见图2。
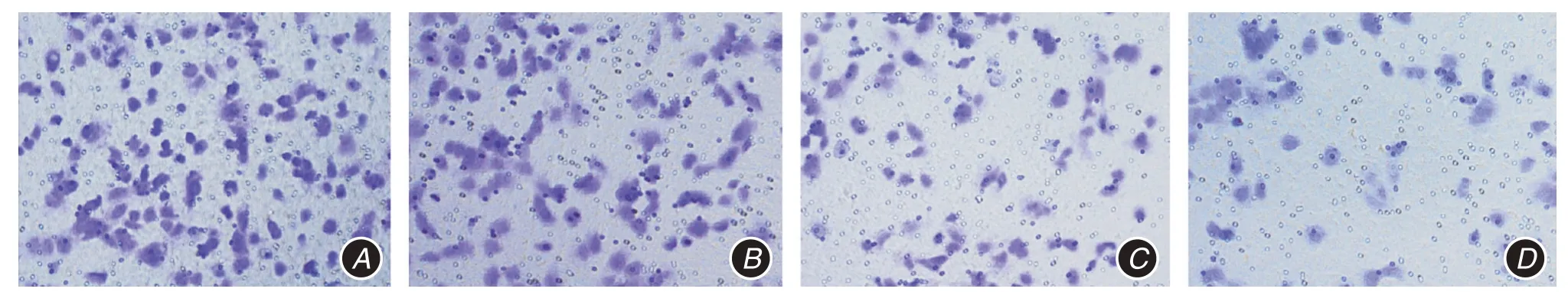
图2 Transwell 小室试验结果(×100)Fig.2 Transwell chamber test results(×100)
2.4 各组Notch1、PTEN蛋白相对表达量及p-FAK/FAKNotch1、PTEN蛋白相对表达量及p⁃FAK/FAK比较,差异有统计学意义(P <0.05);空白组,ICS Ⅱ低、中、高剂量组Notch1蛋白相对表达量及p⁃FAK/FAK呈降低趋势(P <0.05),PTEN蛋白相对表达量呈升高趋势(P <0.05)。见表2、图3。
3 讨论
TSCC是起源于舌复层鳞状上皮的头颈部恶性肿瘤,恶性程度高、浸润性强,病灶可浸润口腔颌面部、颈部重要组织结构,导致血管破裂、疼痛、张口受限等[10]。目前手术切除、放疗、化疗等综合疗法治疗TSCC可获取一定效果,但远期生存率并不理想[11]。研究[12]认为,肿瘤远处转移及局部侵袭是其恶性特征的主要表现,且是导致TSCC预后不良的重要因素,而EMT是该过程中的重要环节。因此,抑制EMT是改善TSCC预后、延长其生存期限的关键。近年来,随着对传统中药开发、应用力度的逐渐加大,从天然植物中提取化合物治疗肿瘤已成为临床研究热点。淫羊藿是小檗科淫羊藿属多年生草本植物,具有促进精液分泌、降压、降糖、利尿、抗肿瘤、抗衰老及增强造血功能和免疫功能等功效[13]。ICSⅡ提取自淫羊藿,其抗肿瘤作用近年来备受关注。
表2 各组Notch1、PTEN 蛋白相对表达量及p⁃FAK/FAKTab.2 Comparison of relative expression of Notch1 and PTEN protein and p⁃FAK/FAK in each group ±s

表2 各组Notch1、PTEN 蛋白相对表达量及p⁃FAK/FAKTab.2 Comparison of relative expression of Notch1 and PTEN protein and p⁃FAK/FAK in each group ±s
注:与空白组比较,aP <0.05;与ICS Ⅱ低剂量组比较,bP <0.05;与ICS Ⅱ中剂量组比较,cP <0.05
组别空白组ICSⅡ低剂量组ICSⅡ中剂量组ICSⅡ高剂量组F 值P 值Notch1 0.85±0.08 0.69±0.07a 0.44±0.04ab 0.21±0.02abc 118.935<0.001 PTEN 0.22±0.03 0.41±0.05a 0.68±0.07ab 0.80±0.08abc 93.367<0.001 p⁃FAK/FAK 0.84±0.09 0.58±0.06a 0.37±0.04ab 0.15±0.02abc 126.764<0.001
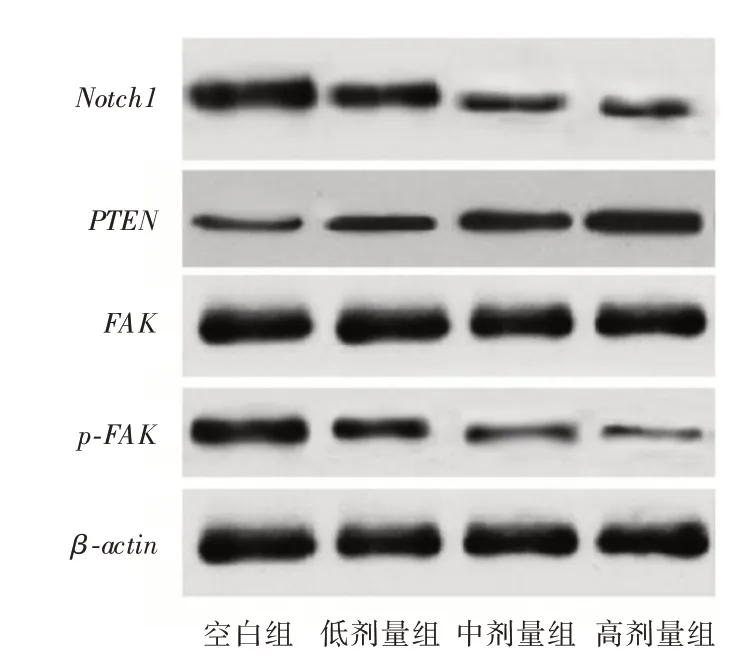
图3 蛋白免疫印记图Fig.3 Immuno⁃imprint of protein
本研究结果显示,ICSⅡ低、中、高剂量组增殖抑制率依次升高;空白组、ICSⅡ低、中、高剂量组迁移率依次降低,每个视野穿膜细胞数依次减少,提示ICS Ⅱ可抑制TSCC细胞增殖,降低其迁移、侵袭能力,且呈剂量依赖。ICS Ⅱ属淫羊藿黄酮苷类化合物,可抑制骨质疏松、保护神经系统,且在宫颈癌、肝癌中均表现出良好的抗肿瘤作用[14-15]。NI等[16]采用菌落形成、Transwell小室试验及迁移测定等方式发现,ICSⅡ可通过影响细胞内能量代谢,诱导癌细胞凋亡,降低其迁移、侵袭能力,与本研究结论相似,但本研究采用不同剂量ICSⅡ进行研究,更具说服力。SONG等[17]在探究ICS⁃Ⅱ对A549、H1299细胞迁移能力的影响中发现,ICS⁃Ⅱ可抑制由炎症因子诱导的EMT及癌细胞侵袭。本研究采用ICSⅡ干预TSCC细胞后,细胞增殖受到抑制,且迁移、侵袭能力降低,可能与其抑制该肿瘤EMT程序信号、调控相关基因表达有关。
此外,本研究中,ICSⅡ低、中、高剂量组Notch1蛋白及p⁃FAK/FAK呈降低趋势,PTEN蛋白呈升高趋势,推测ICSⅡ可能通过调控Notch1/PTEN/FAK信号通路,抑制TSCC细胞EMT,且呈剂量依赖性。Notch1通路是广泛参与细胞分化、发育、调控的重要信号途径,在不同肿瘤中发挥促癌或抑癌作用,甚至在同一肿瘤的不同阶段可发挥相反的生理作用[18-19]。LIU等[20]认为,Notch1基因在TSCC中异常高表达,采用Notch通路抑制剂DAPT可抑制TSCC细胞侵袭及转移。PTEN是最早发现的具有蛋白磷酸酶、脂质磷酸酶双重活性的抑癌基因,可通过多条通路调控肿瘤生物学行为[21]。Notch1基因可能通过负性调控PTEN参与TSCC疾病进程。FAK是位于胞质的酪氨酸蛋白激酶,可通过促使细胞增殖从而激发细胞侵袭性生长。PTEN可通过降低FAK酪氨酸磷酸化水平,减少肌动蛋白纤维数量、减弱细胞运动能力,抑制肿瘤黏附性生长,从而抑制肿瘤细胞增殖、迁移、侵袭[22]。本研究应用不同浓度ICSⅡ干预TSCC细胞,可能通过抑制Notch1表达及FAK磷酸化,上调PTEN而影响肿瘤细胞生长,降低其迁移、侵袭能力。
综上所述,ICSⅡ可抑制TSCC细胞增殖、迁移、侵袭能力,且呈明显剂量依赖性,推测其可能通过下调Notch1表达、上调PTEN表达、抑制FAK磷酸化发挥抗TSCC作用。基于ICSⅡ、Notch1/PTEN/FAK通路在TSCC治疗中的作用,不仅为TSCC药物的研发提供了更多的方向与思路,还为ICSⅡ应用于TSCC的控制提供了更多理论依据。然而,ICSⅡ对Notch1/PTEN/FAK信号传导途径下游信号分子的影响如何,以及作用于TSCC时是否存在其他调控机制尚未明确,这也将是下一步的研究方向。
