超化学计量比氧化铀晶体的研究进展
2020-12-11徐家跃李志超潘芸芳马文军
徐家跃,李志超,潘芸芳,周 鼎,温 丰,马文军
(1. 上海应用技术大学 材料科学与工程学院,晶体生长研究所,上海 204648; 2. 中核北方核燃料元件有限公司,包头 014035)
核电是重要的能源形式,在电能中占比呈逐渐上升趋势。全球现有在运行核电机组454台,在建核电机组54台,其中法国作为核电最发达国家,拥有58台在运行核电机组,发电量在其能源结构中占72.28%; 我国在运行核电机组44台,截至2018年我国核电发电量已累计近3千亿千瓦时[1]。核电的一个关键材料是核燃料棒,其主要成分是氧化铀或氧化铀钚混合物(MOX)。通常将粉末原料烧结成一定尺寸的二氧化铀陶瓷芯块,然后装在锆合金材料套管内,制成氧化铀核燃料棒。与金属铀、氮化铀、碳化铀以及锆外壳材料相比,UO2热导率非常低,衰变产物(如He气泡)容易造成陶瓷开裂,严重时会出现燃料棒中心部位局部过热,产生严重后果[2-3],日本福岛核事故很大程度上与燃料棒散热问题有关。UO2虽然不是一种新化合物,但由于它是放射性物质,需要特殊的研究环境,人们对其各种性能的研究和了解还远远不够。随着核电的快速发展,有关UO2的基础研究方兴未艾。2013年,美国新闻报道爱达荷州州立大学成功生长出较大尺寸氧化铀单晶,为进一步研究UO2性能及核燃料棒应用提供了新的思路[4]。2014年11月,美国科学家在Science上连续发表UO2高温特性、结构等研究成果[5-6]。此外,核废料处理也是核电发展的一个重要课题。核电站每年产生大量的贫铀(Depleted UO2,DUO2)需要处理,传统密封深埋措施存在很多隐患。变废为宝、开发氧化铀的应用是核废料处理的发展趋势。事实上,除了作为核燃料,UO2还是性能优异的半导体材料和热电材料[7-8]:对太阳光的全吸收使其成为效率最高的太阳能电池材料,它的热电系数是常用热电材料BiTe的4倍,禁带宽度与Si相近,它还具有强大的抗辐射能力,特别适合制作在特殊环境下使用的电子器件。
根据U-O相图,存在UO2、U3O8、U3O7、U2O5、U4O9和UO3等多种化合物。其中UO2很容易出现缺氧和过氧的形态(UO2±x),这种现象称为超化学计量比特性。UO2晶体生长早就受到重视,有气相法、浮区法、水热法等多种生长方法[7,9-11],但是晶体尺寸都比较小,质量也不高。Young等[11]利用水热法生长(111)和(100)晶面的UO2单晶(UO2.003),测得其光电功函数分别为(6.28±0.36) eV和(5.80±0.36) eV,为UO2单晶的半导体器件应用提供参考。Robins等[12]通过在熔融碱金属氯化物熔体中电解氯化铀酰获得3 mm长的单晶。Kavazauri等[13]研究了不同化学计量比UO2+x样品,发现热扩散率和热导率随着x增加而降低。Kruschwitz等[14]利用UO2半导体特性制备了中子探测器,通过中子与铀作用引起裂变,裂变产物沉积释放的能量能产生可被探测的电子-空穴对。众所周知,UO2具有超高的熔点(2878 ℃),这对坩埚的选择和生长方法都是巨大的挑战。本文系统总结了超化学计量比UO2晶体的研究进展,基于相图分析,结合晶体结构和生长工艺,讨论了超化学计量比对晶体性能的影响,为UO2晶体生长及其应用研究提供参考依据。
1 相图与结构
U作为天然放射性锕系元素,它有α、β和γ三种同素异形体,化学性质活泼,易被氧化成UO2。在一定条件下,进一步氧化UO2变成超化学计量比氧化铀(UO2+x)。在高温条件下还原UO2也可变为次化学计量比氧化铀(UO2-x)。在不同氧分压和温度条件下,UO2可以被氧化成U3O8、U3O7、U2O5、U4O9和UO3等含氧量更高的氧化物,U离子在氧化物中呈现+3、+4、+5和+6等不同价态。正因为存在多种铀氧化物,才构成了复杂的铀-氧体系。图1是综合多个局部相图绘制而成的U-O相图[15-17]。在UO2和UO3之间,有大量的相结构,主要包括萤石相(O/U=2~2.5)和层状结构(O/U=2.5~3)两种[18-19]。其中,UO2是面心立方萤石结构,空间群为Fm-3m,晶格参数a=b=c=0.547 nm,在室温条件下可以稳定存在,熔点为2878 ℃[20]。U4O9有α、β和γ三种相结构[21];U3O8主要是α和β两种相结构[22]; UO3则有7种晶型结构和1个非晶相[19]。
1) 次氧化铀。研究表明,UO2-x能在室温至1200 ℃范围稳定存在,但UO2-x的化学计量比受到温度和氧分压的影响[23]。在还原气氛下冷却淬火时,UO2-x会分解为UO2和U[24]。UO2-x的氧扩散速率大于UO2,阴离子空位活化能约为(49.0±12.6) kJ/mol,低于间隙缺陷的活化能,因此容易形成缺氧状态[25]。在氧化气氛和1000 ℃,氧进入UO2的晶格后形成了UO2+x[26]。在Ar-25%O2气氛下加热金属U,低于300 ℃氧化产物是UO2+x; 高于300 ℃则生成U3O8[27]。
2) UO2-UO2.25区间。UO2在室温环境下通常以理想化学计量比形式存在; 当温度升至300 ℃后,氧原子开始进入UO2晶格形成UO2+x; 温度升至1650 ℃附近,x可达到最大值0.28[28]。伴随着UO2+x计量比变化,U化学价态升高,离子半径也变小。U4O9通常以次化学计量比U4O9-y存在,α-U4O9-y相在80 ℃以下稳定,β-U4O9-y相在80~550 ℃稳定,γ-U4O9-y相在550 ℃以上稳定; 大约在550 ~700 ℃,U4O9有序相向无序相UO2+x转化[29]。在1123 ℃,U4O9分解形成U3O8-z和UO2+x[30]。Teixeira等[31]报道在170~275 ℃和非常低的氧浓度下,UO2表面氧化成U4O9; 而在300 ℃和Ar-(20%)O2条件下,UO2表面则被氧化成U3O7。在低温控氧的条件下,氧化UO2生成α-U3O7和β-U3O7; 将β-U3O7退火后能得到稳定的四方相UO2.3,在500 ℃能稳定存在[32]。Elorrieta等[33]加热UO2到200~250 ℃时,物质质量增加,表明样品被氧化,到300~400 ℃区间基本达到饱和,有可能生成过氧化铀U4O9或U3O7; 继续升温氧化,在450~500 ℃间增重再次达到饱和,UO2已经全部转化成U3O8。
3) U3O7、U2O5和U3O8等铀氧化物都在UO2.25-UO2.67(U3O8)区域。作为核燃料UO2的氧化产物,U3O8体积会膨胀36%,因此需要考虑核燃料包壳的破裂带来的核安全问题。U3O8主要有斜方结构(α和β相)以及六方结构(γ相)[34]。α-U3O8能在400 ℃稳定存在[35]。在250~500 ℃范围,α-U3O8转变为β-U3O8;γ-U3O8需要在高压和200~300 ℃下才可以存在; 当高于800 ℃后,形成超化学计量比U3O8+x;如果再持续加热,则会逐渐失去氧而转变为次化学计量比U3O8-x。张延志等[36]报道U3O8在300 ℃附近有结构相变,低于300 ℃时为底心正交结构,在300 ℃附近则转变成六方结构。在低浓度氧气条件下,UO2易氧化成U4O9和U3O7; 在接近400 ℃和中等氧分压下,UO2在短时间内被氧化成α-U3O8[22]。在800 ℃的空气环境下加热UO2,自然降温可得到α-U3O8; 而在1350 ℃的空气环境下加热α-U3O8,然后缓慢冷却至室温,则生成β-U3O8[37-38]。理论上,在高压气氛环境下,可以获得O/U比更高的氧化物。Olander[39]发现,在1330 ℃和1.52×104kPa下存在O/U比为2.60的氧化物,这是比常压下氧组分更高的化合物。Zhang等[40]在约8.1 GPa的压力下合成具有萤石型结构U3O8,它在1430 ℃和40 GPa的极端条件下能稳定存在。分析极端环境(高温和高压)条件下核燃料循环中各种氧化过程,对核燃料安全处理有重要的安全意义。亚稳态的U2O5主要结构是:α-U2O5(正交结构),β-U2O5(六方结构),γ-U2O5(单斜结构)[41]。在400~800 ℃和3×106~6×106kPa高压条件下,存在单斜萤石型结构和六方层状结构的U2O5同素异形体结构[42]。在170~275 ℃下,进一步氧化UO2可生成U4O9; 在300 ℃和Ar-20%O2气氛中,UO2被氧化为亚稳相U3O7[43]。
4) UO2.67-UO3区域。据报道UO3作为含氧量最高的铀的氧化物,有七种晶型结构(α-,β-,γ-,δ-,ε-,ζ-和η-)和一个非晶相,其中β-UO3是UO3相中最稳定的相。其中α-,β-,γ-,η-UO3有类似铀酰(UO22+)的结构,ε-和ζ-UO3也可能含有铀酰型配位。α-UO3是斜方结构,P-3m1空间群,a=0.3971 nm,b=0.6860 nm,c=0.4168 nm[43]。γ-UO3在-200~100 ℃间有三种相结构,在-200 ℃为赝四方结构; 在50 ℃转变为正交结构; 在100 ℃为四方结构[44]。室温加热γ-UO3至650 ℃仍保持稳定; 而高于此温度时,则分解成U3O8。在450 ℃和空气条件下,加热δ-和ε-UO3会转化成U3O8。在700 ℃和H2环境下,加热UO3得到深棕色的UO2。Brincat等[45]结合PBE+U理论计算,验证了γ-UO3是UO3相中最稳定的结构;α-UO3是最不稳定的;η-UO3是高压多晶型物,密度最低的δ-UO3可能会随着压力的增加而变得不稳定。
2 物理性能
2.1 光学性能
UO2具有优良的光学性质,作为高反射率镜面材料可应用于深紫外、软X射线以及天文物理领域。Schoenes[46]测试了室温下UO2单晶的反射光谱,测得晶体带隙为(2.1±0.1) eV,对应5f2→5f16deg跃迁;通过实验计算出吸收系数及介电常数(约5.1)。Shi等[47]结合第一性原理计算得出UO2带隙(2.3 eV)和静态介电常数(5.53),与Schoenes的实验结果基本一致。Singh等[48]使用GGA+U方法计算得出ThO2、UO2和PuO2的静态介电常数,分别为2.11、2.6和3.85,发现极化率和静态折射率随原子序数的增大逐渐增大。Chen等[49-51]利用磁喷法将UO2沉积在(111)Si衬底上,发现三种厚度薄膜与折射率和散光系数的变化规律:随着膜厚度增加,折射率变小,而消光系数变大; 厚度为637 nm的UO2薄膜,折射率(n)在2.1~2.65之间,消光系数(k)约为0.51; 计算出近绝缘态UO2的带隙为1.87 eV,U的6d轨道劈裂形成两个能级,且能级差为2.7 eV,与实验结果(2.8 eV)很接近,也验证了UO2的反铁磁性半导体基态性质。De Vetter等[52]测试了UO2单晶、纯度相对较高的铀矿石以及含杂质的块状铀矿物的光学常数,推导出UO2单晶的折射率(n)和消光系数(k)分别为nmax=(15.3±0.8),kmax=(15.8±0.8),预测UO2晶体有望应用在新型红外/微波光子学中。
通过对比铀氧化物的拉曼和红外光谱特征峰的位置和相对强度,可区分UO2、U3O8、U4O9和UO3[19,53-54]。化学计量比x对UO2+x晶体结构的影响均能在拉曼和红外光谱中得到反馈。UO2拉曼光谱主要在445、575、925和1145 cm-1处有峰,其中445 cm-1峰归结为T2g振动模,575 cm-1是拉曼禁阻LO振动模,925 cm-1则归结为2TOR振动模。在1150 cm-1附近目前尚有争议,Livneh等[55]认为是2LO模,而Shoenes等[46]认为是晶体电场中电子跃迁导致。吕俊波等[56]报道,在UO2+x拉曼光谱中,随着x增大,578和1150 cm-1处的特征峰强度减弱;x=0.19时,578 cm-1峰消失;x=0.32,445 cm-1峰发生红移至459 cm-1,1150 cm-1峰消失,是与U3O7结构相一致; 当x≥0.39,在459 cm-1峰发生分裂,同时出现235和754 cm-1新峰,特征峰与α-U3O8相似。红外光谱的研究表明,随着x增大,700 cm-1峰变弱,在645 cm-1附近出现新峰且强度逐渐增大; 同时,400~600 cm-1有新分裂的峰,且随着x增大而变强。Elorrieta等[33]系统研究了UO2+x晶体的温度依赖关系,认为微拉曼光谱分析是一种定量研究超化学计量比氧化铀的新方法。除了上述拉曼峰外,他们还观察到625 cm-1峰,认为是与氧化有关的振动峰。图2是在H2/N2气氛中不同温度下UO2的拉曼光谱,由图中插图显示,随着温度升高,T2g振动带由于体积膨胀等因素影响略微向低波数移动。图3揭示了不同氧化程度的UO2+x(0<x<0.25)的拉曼光谱。从图3中看出,随着x增加,445 cm-1峰逐渐变宽且上移,1150 cm-1峰逐渐减弱甚至消失,625 cm-1峰逐渐增强,560 cm-1峰则在x=0.09处出现转折点。这意味着晶体结构可能发生变化,Elorrieta等[53]由此总结出4个可能的结构重排区间:x<0.05、0.05<x<0.11、0.11<x<0.20和0.20<x<0.25。
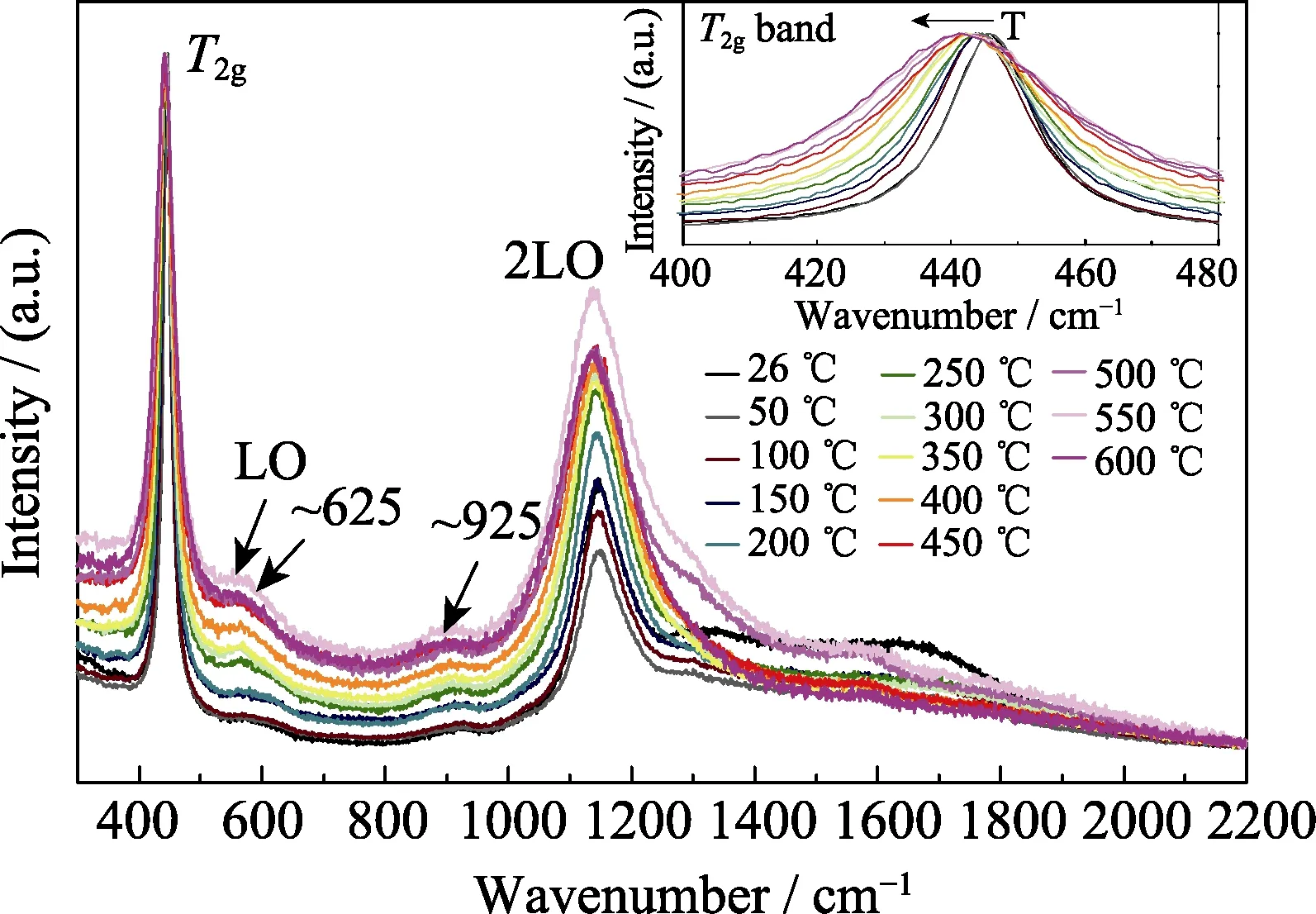
图2 不同温度下UO2的拉曼光谱[55]Fig. 2 Roman spectra of UO2 at different temperatures with inset showing their enlarged parts with the wavenumber from 400 to 480 cm-1[55]
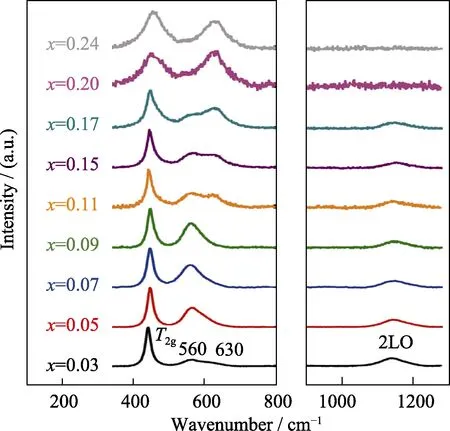
图3 超化学计量比UO2+x的拉曼图谱[33]Fig. 3 Raman spectra of UO2+x hyper-stoichiometric oxides[33]
2.2 电学性能
近年来,UO2、U3O8、U4O9和UO3的半导体特性受到极大关注。研究表明,UO2是p型本征材料,U3O8则是n型本征材料,中间存在一个p型与n型转变的成分区间[57]。与硅、锗和砷化镓等传统的半导体材料相比,UO2晶体在性能上有显著提高和改进,有望成为一个全新种类的高性能半导体,应用于未来电子学器件[7,58-59]。图4是室温下几种半导体材料的带隙-效率曲线。UO2的禁带宽度约为1.3 eV,介于硅(1.1~1.3 eV)与砷化镓(1.42 eV)之间,接近太阳能吸收的带隙-效率曲线顶点。它能吸收包括红外在内的多个波段太阳光,被认为是最高效的肖特基二极管太阳能电池材料,这表明UO2有望制成拥有最高转换效率的太阳能电池[60]。图5给出了UO2材料电导率与Seebeck系数,并与普通绝缘体、半导体、导体相比较[60]。室温下UO2电导率与硅相当,小于GaAs晶体的本征电导率,是一种优良的半导体材料。室温下UO2介电常数约为22,差不多是Si和GaAs的两倍(Si为11.2; GaAs为14.1),在集成电路领域具备更高集成度和高击穿电压的性能优势。UO2热电性能也很优异,室温下其Seebeck系数约为750 μV/K。相比之下,被认为极具应用潜力的热电材料Tl2SnTe5、Tl2GeTe5只有270 μV/K,传统Bi2Te3合金更低,因此UO2晶体在未来热电领域具有潜在的应用价值。
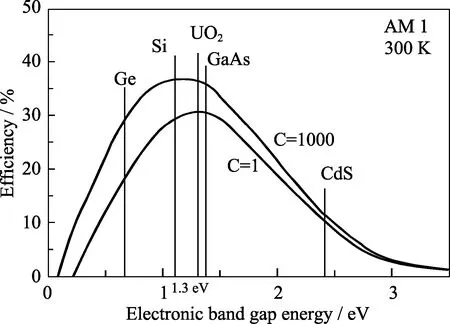
图4 典型半导体材料的带隙-效率曲线[60]Fig. 4 Bandgap-efficiency curve of typical semiconductor materials[60]

图5 UO2电导率与常见绝缘体、半导体和导体的对比[60]Fig. 5 Comparison of UO2 conductivity with common insulators,semiconductors and conductors[60]
理想化学计量比UO2被认为是最好的Mott绝缘体(Mott-Hubbard绝缘体),这样结构的单晶或多晶电导率相对稳定; 非化学计量比氧化铀(UO2±x)的电导率会受到氧分压和温度的影响。图6是UO2单晶电导率与温度之间关系图[61]。在光伏器件的制备中,在UO2中引入掺杂剂后可以提高材料的电导率[58]。Aronson等[62]推导出UO2+x电导率σ与化学计量比x关系方程(1)为:
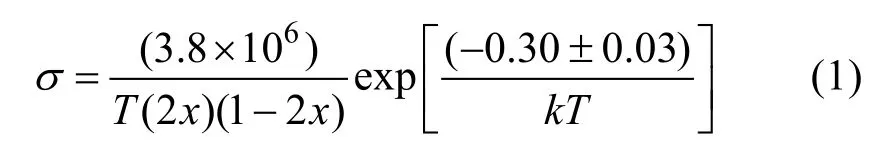
式中:x为化学计量比,T为温度(K),0.30 eV为活化能,k为玻尔兹曼常数。关于UO2导电机理,Aronson等[62]认为,每一个U4+离子可看作是一个能跳跃到U5+离子的电子,等价地,U5+离子可看作是一个能跳跃到U4+离子的空穴,所需活化能为0.30 eV。对于化学计量比UO2,电导率随温度升高而变大; 在温度不变时,电导率随化学计量比x增加而显著增大,在200 ℃以下UO2.000的电导率比UO2.014小两个数量级。Hampton等[63]研究了UO2单晶的介电性能,测得单晶和多晶的介电常数分别为25.3和22.8。Ruello等[64]研究表明, 1000 ℃附近,近化学计量比UO2的电导率出现最小值,证实这是非本征向本征p型半导体的转变。在非本征区域(T<1000℃),空穴迁移率是热激活的,激活能为0.17 eV。电导率和塞贝克系数显示,在T>1000 ℃时,电子迁移率和空穴迁移率的激活能是非常接近的。图7是UO2±x塞贝克系数与氧分压的关系曲线。在824 ℃以下,塞贝克系数几乎不变,都是正值,915 ℃时,Seebeck系数随氧分压增大快速升高; 温度高于1015 ℃时,Seebeck系数随氧分压增加迅速上升,从负值变为正值。Dugan等[65]利用HSE(Heyd-Scuseria-Ernzerhof)理论计算得出(111)取向UO2单晶带隙为2.19 eV,具有反铁磁基态; 实验测试表明,UO2是具有各向同性,带隙约为2.0 eV,与Djerassi等[66]的理论预期一致。
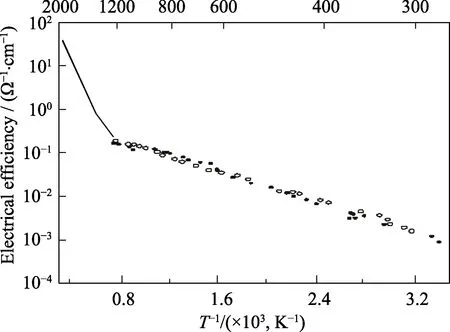
图6 UO2 单晶电导率-温度关系曲线[60]Fig. 6 Electrical conductivity of UO2 single crystals as a function of temperature[60]
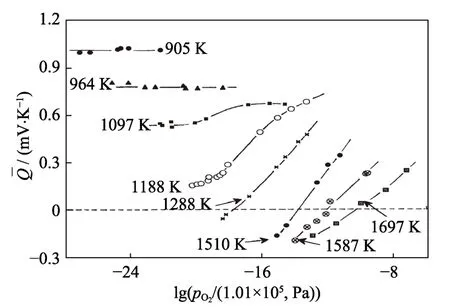
图7 UO2±x塞贝克系数与氧分压的关系[61]Fig. 7 Seebeck coefficients of UO2±x as functions of the oxygen partial pressure[61]
2.3 热学性能
氧化铀作为核反应堆的基础燃料,导热性直接影响芯块温场和内部的最高温度,研究氧化铀热力学性能对核燃料的使用寿命和改进十分重要,同时也对核事故处理和包层保护有指导意义。Young等[67-68]认为,在高温下由于热激活5f电子的出现,固态UO2中热激活电子对热导率有显著贡献,而熔体比热急剧下降,热传输机理从电子传输转变为辐射传输。理论上,氧化铀的热导率k主要是由声子kph、电子ke和光子krad共三个部分组成,均受到温度的影响。Harding等[69]推导出UO2(s)在500~2826.8 ℃的热导率方程式(2):
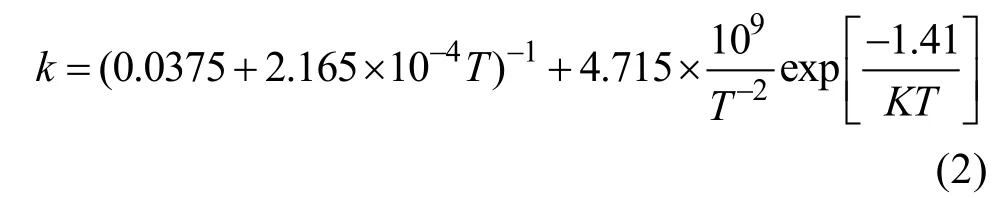
Aring等[70]研究了UO2单晶的低温热导率,在奈耳温度TN= -242.3 ℃附近,电导率下降了近两个数量级,表现出典型的反铁磁特性,归结为晶体中强的声子-磁子耦合。Moore等[71]报道在-193~147 ℃,近化学计量比UO2单晶和多晶材料热导率没有明显差异; Gofryk等[72]发现,立方结构的UO2单晶在-269.15~27 ℃表现出各向异性,这可能与声子-自旋散射有关,施加温度梯度将打破UO2立方对称性,带来热导率的各向异性。Ronchi等[73]研究了烧结氧化铀在2626.8 ℃以下的热性能,发现在约2400 ℃后UO2的热容依然保持增加趋势; 热扩散系数倒数随着温度的升高而线性增加到2327 ℃,更高温度下其斜率则显著变小。Kavazauri等[13]研究了非化学计量比氧化铀的热性能:图8和图9分别是热容和热导率随温度变化曲线。测试结果表明,虽然不同O/U比氧化铀的测量值略有差别,热容量随温度升高而增加、热导率随温度升高而降低的规律基本一致。Vlahovic等[74]测试了接近熔点的热扩散系数,认为UO2在230~1330 ℃区间热扩散系数随温度升高而降低; 在1730~2530 ℃区间热扩散系数趋于不变; 当加热至熔点附近,热扩散率会略微增大。

图8 样品UO2的热容[13]Fig. 8 Heat capacities of UO2 samples[13]
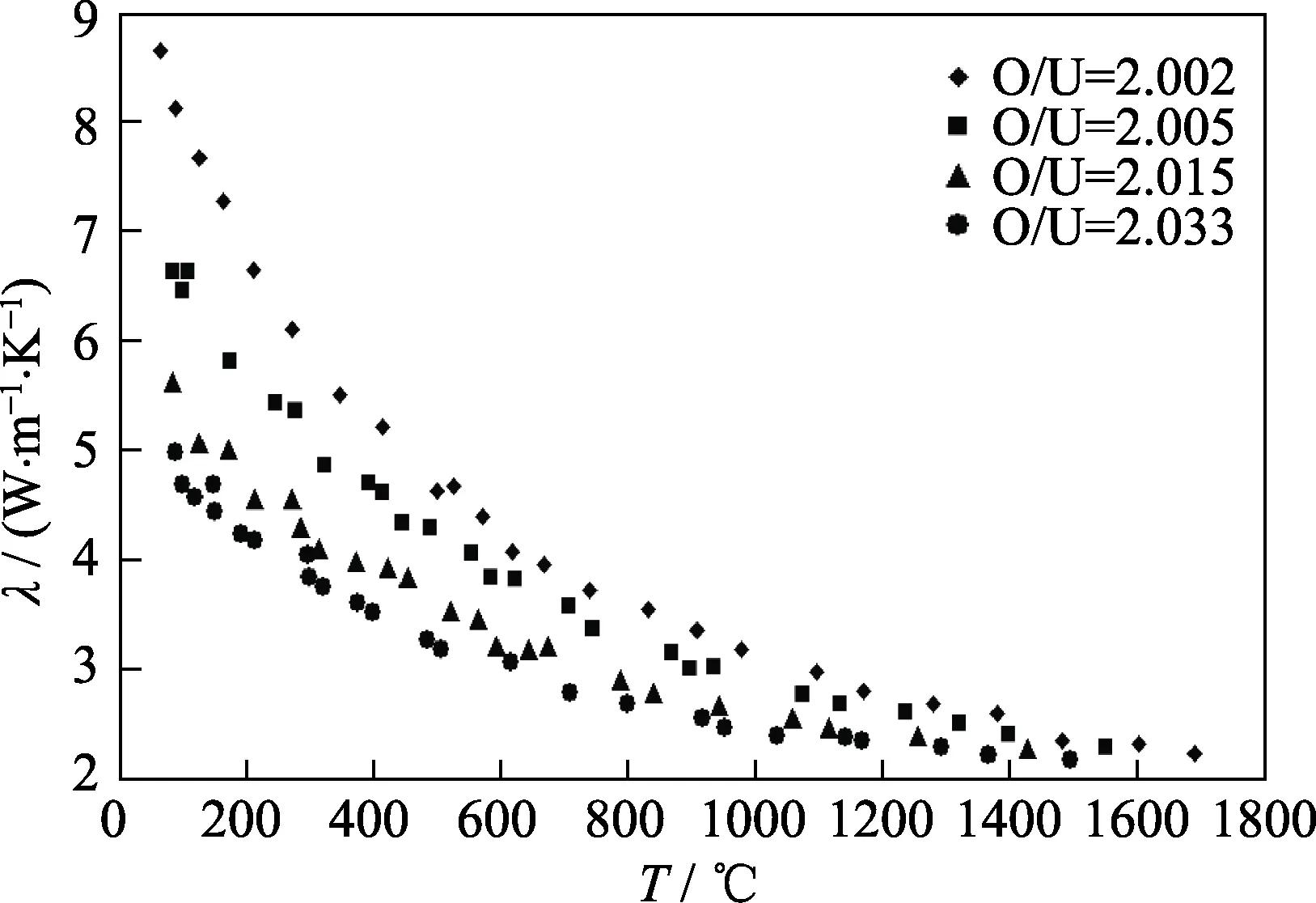
图9 不同组成的UO2热导率[13]Fig. 9 Thermal conductivities of UO2 samples with different compositions[13]
3 UO2晶体生长
3.1 熔体生长技术
UO2晶体熔点2878 ℃,属于难生长的超高温晶体,熔体法生长需要考虑加热方式、坩埚选择等诸多问题。熔体法生长UO2晶体主要局限在浮区法、冷坩埚法等几种技术。Chapman等[75]最早报道浮区法生长UO2晶体的研究结果。他们事先制备了致密的UO2多晶预制棒,采用射频加热和200/800 r/min转速,成功生长出直径半英寸、长度2英寸的晶棒(1英寸=2.54 cm)。UO2的半导体特性有助于原料棒中心导电,从而实现频率加热; 料棒表面热辐射造成热量损耗,使之形成硬壳,起到坩埚作用。所得晶棒中心部分为UO2晶体,晶体完整性较好,无金属铀包裹物,但多数晶体都存在微裂纹,择优生长取向为<110>,测得O/U为2.000~2.003。
Herrick等[76]利用冷坩埚法生长了UO2晶体和熔点3400 ℃的ThO2晶体。采用氢气还原处理U3O8工艺制备了高纯UO2原料,测得原料组分为UO2.00~2.02,也存在各种金属离子杂质。利用金属铀点火,形成初始熔池,功率24 kW,所得样品为黑色玻璃状晶体,表面被多晶粉末包围,最大尺寸为2~3 cm。化学分析测得其成分为UO2.19,XRD衍射晶格常数为0.5449 nm,对应成分可能是UO2.21,两者比较一致。粉末XRD衍射还发现存在大约5%的U3O8杂相。由于该方法无法使用籽晶,难以获得高质量单晶,Burgett等[77]提出生长工程化UO2晶体(Engineered single crystals)。所谓工程化UO2晶体,既可以是UO2单晶,也可以是含有一定结晶颗粒的UO2固体。希望通过高取向UO2晶体生长,为研究其基本物理性能提供材料保障。生长装置有2英寸(5.08 cm)的石英管保护,采用石墨感受器(Graphite susceptor)来点火,整个实验周期需要持续差不多1 w时间。最终获得了cm级尺寸黑色UO2晶体(图10),具体质量以及测试结果未见报道。此外,他们还研究了Ce置换(U1-xCexO2,x≤0.4)、Th置换、Ce/Th置换的UO2晶体,计算了晶体的化学膨胀率(因化学元素掺入引起的晶格变化)。
3.2 溶液生长技术
对UO2晶体,溶液生长技术主要有助熔剂法(高温溶液法)和水热法两种。助熔剂法能够显著降低晶体生长温度,适合难熔氧化物晶体生长,也常用于新材料的探索[78]。根据相图,有多种助溶剂可以用于UO2晶体,比如PbO、B2O3、Al2O3等。虽然Hillerbrand和Bard等早期开展过UO2晶体助熔剂法生长的研究,其后几十年来再未见相关工作的报道。2016年,Mann等[79-80]报道了UO2晶体水热法生长研究结果,如图11所示。他们系统研究了不同矿化剂对生长的影响,包括5种碱金属氟化物和5种碱金属氢氧化物; 研究了不同矿化剂配比对结晶的影响。将原料和矿化剂置于银安瓿的较低温区中,再将UO2的晶种悬浮在安瓿上部加热区的架子上,加入不同配比的矿化剂溶液以填充70%的安瓿。上下区域的温度控制在550~650 ℃,压力约172 kPa,生长周期大约7 d。初期生长很多尺寸小于1 mm的晶体,工艺优化特别是调控温度梯度后,获得2 mm以上的较大晶体,质量也较高。所得晶体出现明显的结晶学小面,确定一个显露面为(311)。他们还在CaF2基片上生长了UO2晶体,测试了晶体的各种光谱。他们使用6 mol/L的CsF矿化剂溶液和UO2原料,原料和结晶区的温度分别保持在650和600 ℃,在1.73×108Pa的压力下保持45 d,生长出两个<111>和<100>取向的近化学计量比UO2晶体。水热法优势在于生长温度较低,大约在600 ℃,远低于UO2的熔点。同时,近平衡态生长有助于提高晶体质量,密封的生长环境有利于价态的严格控制。迄今为止,还未见大尺寸、高质量晶体的报道。

图10 冷坩埚法生长的UO2晶体[77]Fig. 10 UO2 crystal prepared by the cooling-crubile melting method[77]

图11 水热法生长的UO2晶体[79]Fig. 11 UO2 crystal prepared by the hydrothermal method[79]
UO2晶体的气相生长技术主要包括升华法、气相输运法(CVT)和气相沉积法(CVD)等。Lierde等[9]最早开展升华法生长UO2晶体的研究。他们将烧结的UO2压片装在一个中空的腔体里,两端设计有温度相对低的电极,抽真空密封。由于UO2晶体是半导体,几乎不导电,最初通过内置灯丝加热,达到一定温度后UO2可以直接通电加热。在低于熔点的某个温度下利用其蒸汽压将UO2输运到腔体冷端,结晶生长出尺寸4~12 mm、质量为5 g的半球形UO2晶锭。UO2从管内部升华后转移到温度较低的电极上形成沉积物。晶锭表面存在大量晶界凹槽和生长小面,预示着可能存在晶界迁移生长。所得晶体为黑色颗粒,分析晶体成份接近化学计量比。升华法非常适合生长UO2这样的超高温晶体。此外,UO2作为半导体往往需要掺杂,无论是气氛掺杂还是事先掺杂到烧结料中,升华法都有利于掺杂。
3.3 气相生长技术
Singh等[81]从动力学角度研究了UO2晶体的化学气相沉积(CVD,Chemical Vapor Deposition)。通过对UO2在Cl2、Br2、I2气氛中的热力学计算,得出氯气具有最大的输运效果。为了确保化学计量比,UO2基片及UO2源压片事先在氢气气氛下1400 ℃处理40 h,然后移到石英管里。实验在直径17~20 mm、长度13~15 cm的密封石英管内进行。在(100)和(111)取向的UO2基片上生长了UO2晶体,氯气压力控制在133~2667 Pa、温度梯度913~970 ℃。晶体形貌呈现为大量的生长小面。光谱分析和维氏硬度测试都显示,所生长的UO2晶体纯度明显优于基片。晶体位错缺陷密度低,仅为2×105cm-2,而基片则为107cm-2量级。大量实验表明,氯气压力的变化和温度梯度的控制是晶体生长的关键。氯气压力太大,晶体则容易开裂。要想获得较高质量的晶体,需要控制较低的氯气气压(<1333 Pa)和较高的基片温度(>950 ℃)。Faile等[82]改用TeCl4作为输运载体,将UO2源封闭在熔融石英管中,从1050 ℃源(高温端)经过一个梯度区在950 ℃区域(低温端)沉积结晶。石英管长度20 cm,气氛组成包括0.2 g/cm3的UO2、4.5 mg/cm3的TeCl4和0.18 mg/cm3氩气。氩气有助于减少对流引起的固液界面的气流涨落,进而抑制缺陷形成和多晶生长。石英管直径越大,越容易生长更多晶体。采用内径33 mm的石英管,获得晶体总质量18 g,其中大晶粒分别为1.3、0.9 g,说明采用CVT法可生长出1 g甚至更大的UO2单晶。气相法主要缺点是晶界多,晶体完整性差。
4 总结与展望
氧化铀作为核燃料已广为人知,其高温特性值得关注。高温下氧化铀燃料发生氧化反应,不仅带来巨大的热辐射,还会生成各种缺陷,影响燃料棒性能,甚至导致坍塌。研究氧化铀晶体的结构、热性能、电性能以及超化学计量比对这些性能的影响,有助于进一步了解UO2核燃料棒特性,为更好地利用核燃料提供新的思路。
近年来,氧化铀作为功能材料越来越受到重视。理想化学计量比UO2被认为是最好的Mott绝缘体,这种材料理论上应该是导体,但实验上却不导电,因此此结构的单晶或多晶电导率通常是相对稳定的。这是因为基态时其价带全满,但导带全空,5f电子传输跃迁时产生U3+-U5+电子对组态,束缚了电子的流动,研究其电子特性有助于了解作为重费米子U化合物的超导起源。铀的几种氧化物,如UO2、U3O8、U4O9和UO3,都具有半导体特性。UO2是p型本征材料,U3O8则是n型本征材料。室温下UO2的禁带宽度约为1.3 eV,介于硅(1.1~1.3 eV)与砷化镓(1.42 eV)之间,介电常数为22,约为Si和GaAs的两倍(Si为11.2; GaAs为14.1),在集成电路领域具备更高集成度和高击穿电压的性能优势。与传统半导体材料硅、锗和砷化镓等相比,UO2晶体在多个性能参数上显示出优势,有望成为一个全新的高性能半导体种类。UO2热电性能表现优异,在室温下,它的Seebeck系数约为750 μV/K,在热电器件上具有巨大的应用潜力。UO2晶体能吸收包括红外在内的5个波段的太阳能,被认为是最高效的肖特基二极管太阳能电池材料,有望制成拥有最高转换效率的太阳能电池。有人认为,如果把现有的核废料做成UO2晶体太阳能电池,完全可以取代现有的Si太阳能电池,达到既减少生产硅又能够处理核废料的效果。
当然,UO2晶体的功能应用还有很远的距离,其中一个主要问题是晶体生长困难。UO2熔点高达2878 ℃,传统生长方法如提拉法、下降法都无法生长该晶体,对加热方式和坩埚材料都是极大的挑战。目前UO2晶体生长技术主要有三类:1) 熔体生长技术,包括太阳能炉、冷坩埚炉、弧形熔融炉和密封区熔炉,都采取辐射加热,不需要坩埚,因此晶体污染少,主要缺点是大的温度梯度引入的热应力及缺陷。2) 气相生长技术,包括CVT、CVD、升华法等,主要缺点是晶界多,完整性差; 3) 溶液生长技术,主要有助熔剂法、电沉积法、水热法等,主要问题是包裹物缺陷较多。由于上述方法都是在极端条件下生长晶体,目前晶体尺寸都比较小。虽然水热法生长温度较低,价态容易控制,生长过程更接近平衡态,被认为是很有前途的生长技术,但晶体依然比较小,溶液体系以及生长工艺还有待优化。随着冷坩埚生长技术的不断进步,非常期待在立方晶系、超高熔点的氧化铀晶体生长方面取得突破,在贫铀核废料处理方面更有潜力。
第二个难题是如何准确控制UO2晶体的化学计量比。UO2既可以缺氧也可以过氧,超化学计量比特性是UO2晶体的基本特征,也是基础研究的重要阵地。虽然超化学计量比对晶体性能的影响已有很多文献报道,但缺少高质量晶体的物性实验研究。未来各种生长技术的发展,相信一定能够获得组分严格控制的高质量晶体,绘制出组分-性能变化规律的准确图谱。
